干细胞源性星形胶质细胞分化中的生长状态研究
欧 亚,元小冬,张丽丽
(华北理工大学附属开滦总医院,河北 唐山063000)
中枢神经系统退行性疾病已经成为我国人口与健康领域中的重大科学与社会问题。目前,神经退行性疾病的发病机制尚不完全清楚,也缺乏有效的治疗方法,而干细胞或神经元和神经胶质细胞等目标细胞移植被认为是最有前途的治疗方法之一[1,2]。星形胶质细胞是胶质细胞中数量最多、具有重要功能的细胞,可以通过分泌多种神经因子来实现对神经元的营养修复作用。星形胶质细胞分泌的神经营养因子等活性物质在脑内广泛分布,对神经细胞有一定的营养作用,在保护神经细胞、促进轴突生长、神经损伤修复和维持正常的脑功能中有重要意义。研究发现[3-8],脂肪间充质干细胞(ADSC)可在体外培养扩增,并通过化学诱导剂分化为星形胶质细胞。但分化过程中细胞数量逐渐减少,严重影响进一步实验的开展。因此,本实验通过体外培养及诱导技术,检测诱导过程中细胞生长状态,并分析导致细胞死亡的原因,为今后实验打下理论基础。
1 材料与方法
1.1 实验取材
本研究所用的脂肪组织为华北理工大学附属开滦总医院美容整形中心和唐山金荣整形美容医院健康成人腹部皮下吸脂整形术后的脂肪组织废弃物。此项研究经志愿者同意并经华北理工大学伦理委员会批准。
1.2 ADSC的体外提取、培养
脂肪组织取材后,应用Ye等人[3]的方法,将细胞置于恒温培养箱中进行培养。随后每3天换液1次,大约在10-14天细胞长满瓶底,按照1∶2比例进行传代,之后继续应用培养液进行培养。
1.3 ADSC向星形胶质细胞诱导分化
收集生长状态良好的第3-6代ADSC,制成细胞爬片,待细胞生长至70%左右融合时,开始应用以IBMX为主要成分的化学诱导剂(DE-1)进行诱导分化[4],依据诱导分化反应时间分别分为诱导48 h组、诱导7 d组、诱导14 d组、诱导 21 d组。同时,选取按常规培养无诱导剂的未诱导细胞作为对照组。
1.4 光学显微镜及透射电子显微镜下观察诱导后细胞形态
倒置相差显微镜下观察未诱导及诱导48 h、7 d、1 4d和21 d时的细胞形态并摄片。消化、离心收集诱导分化48h的成人ADSC。3%戊二醛、1%饿酸固定,丙醛脱水,环氧树脂包埋,超薄切片机切片,2%醋酸铀和枸橼酸铅染色,透射电镜下观察细胞超微结构、拍照记录。未诱导的ADSC作为对照。
1.5 免疫荧光细胞化学染色法检测GFAP表达
取未诱导及诱导后48 h、7 d、14 d、21 d细胞制作爬片,行免疫细胞化学GFAP染色。一抗为鼠抗人GFAP单克隆抗体工作液。操作按试剂盒说明书进行。荧光显微镜下观察并摄片。GFAP染色阳性细胞胞质为棕黄色。计算GFAP染色阳性细胞百分比。
1.6 MTT法检测分化反应中的细胞存活状态
培养到第3代的脂肪基质细胞应用胰酶体外消化离心。按1×105/孔的细胞密度将离心后细胞种板(12孔板最为适宜)。在孔板中加入DE-1化学诱导剂,分别诱导48 h、7 d、14 d、21 d,每一时间点作为一个诱导组,未诱导组中不加诱导剂,而是加入完全培养基。加入MTT工作液后,用酶标仪检测各时间点细胞吸光度值(OD值),绘制细胞生长状态曲线(以OD值为纵轴,以时间为横轴)。
1.7 AnnexinⅤ/PI双染法检测细胞凋亡
采用诱导分化后48 h、7 d、14 d、21d时的星形胶质细胞,胰酶消化离心。PI染液孵化,之后流式细胞仪检测。采用未加入诱导剂的人脂肪基质细胞作为对照组。每个组重复实验3次。
1.8 数据统计学分析
所得实验结果应用Excel 2003 建库,之后数据采用SPSS13.0软件包进行统计学整理,所得结果以均数±标准差代表,同一组内不同时间点间的比较均采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 成人ADSC的原代及传代培养
经过分离、提取的脂肪基质细胞培养至24小时可以看到细胞贴付于培养瓶底。首次换液后可在镜下观察到细胞的形态多样、大小不一,多呈现为类圆形、黑点状(图1a)。培养48 h时,多数ADSC胞体变为长梭形,呈类似于成纤维细胞样形态。7-10 d左右细胞增殖速度加快,镜下可见大量梭形细胞呈漩涡状排列,细胞生长到14 d可达到90%融合。传至第3-6代时,细胞形态基本均匀,呈长梭形,杂质细胞基本去除,此时细胞增生活跃,3-6天即可铺满整个瓶底(图1b)。
2.2 ADSC诱导过程中细胞形态学变化
诱导至5 h时,ADSC形态逐渐开始发生变化,胞体折光性逐渐增强,胞质以胞核为中心向内回缩,ADSC的原始外部胞膜轮廓逐渐模糊。16 h左右细胞胞体折光性显著增强,呈圆形或多边形,胞浆回缩更为明显。低倍镜下可见细胞伸出多条突起,但高倍镜下发现细胞这些突起为胞浆不均匀回缩所致,且某些细胞仍能看到ADSC细胞膜的原始外部轮廓(图2a)。48 h,光镜下可见典型的星形胶质细胞形态,即胞体圆形,伸出多条细长突起,部分一级突起伸出多条次级突起,胞核圆形,居中,可见到1-2个核仁,但部分细胞的突起末端分化不完全(图2b)。此后至诱导后14 d,细胞形态基本保持不变(图2c)。21 d时,胞体折光性减弱,呈三角形或不规则形,部分突起回缩,仅有2-3条较短突起。28 d时,大量细胞脱落、死亡。
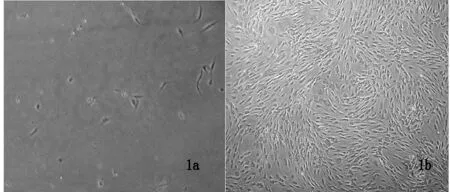
图a为原代培养3 d时细胞,贴壁细胞呈黑点状;b为成人ADSC传代至第3代3 d时,成纤维细胞样形态,并呈旋涡状生长。
图1成人ADSC原代及传代培养后倒置相差显微镜下的细胞形态变化特征
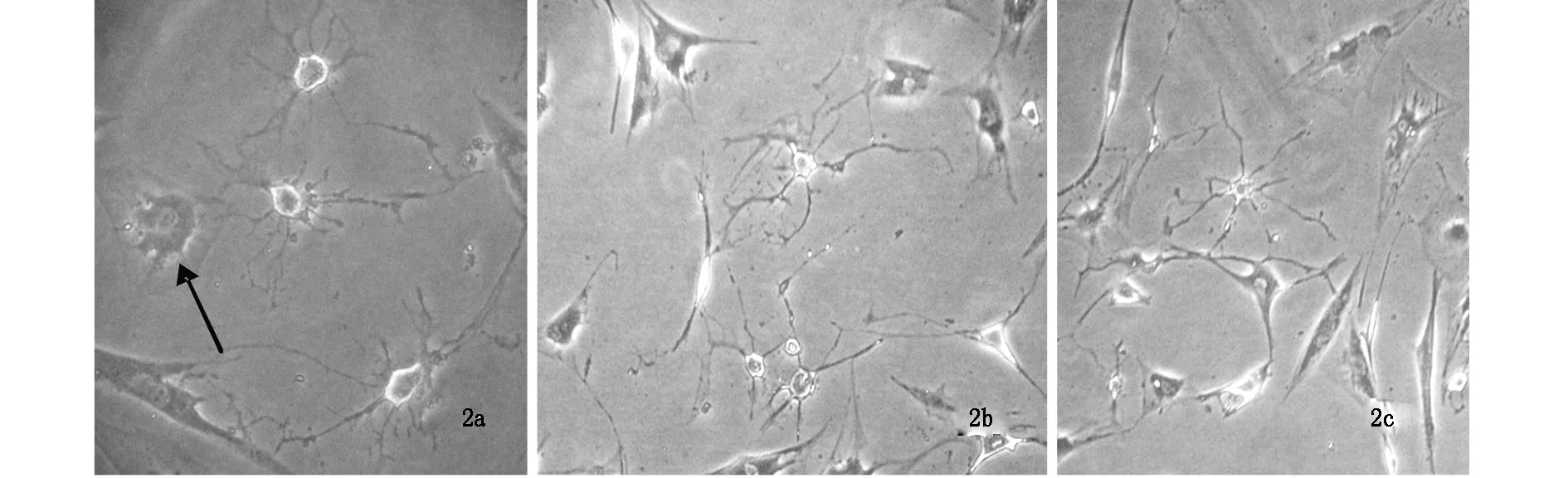
图a箭头所示为未分化完全细胞;图b为诱导后48 h细胞;图c为诱导后14 d细胞。
2.3 诱导后细胞GFAP免疫细胞化学表达
未诱导组无GFAP阳性表达,而在诱导后各个时间组(48 h-21 d)中均可见部分阳性表达细胞,且阳性表达部位主要集中于诱导后细胞的胞体和突起(图3,表1)。GFAP阳性表达率在诱导后7 d与14 d组之间无明显差异(P>0.05),在第7 d组高于48 h组(P<0.05),14 d组高于21 d组(P<0.05)。
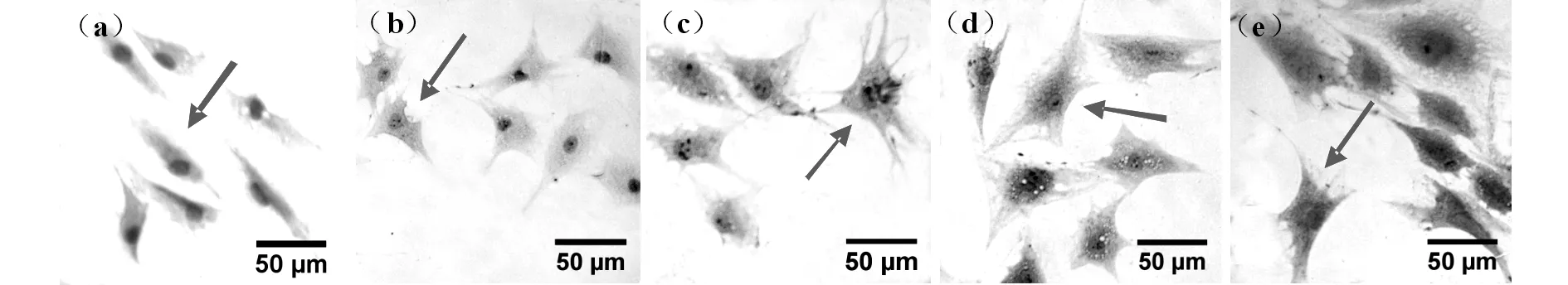
图a-e分别GFAP在未诱导细胞及分化后48 h、7 d、14 d、21 d的星形胶质细胞中的表达结果,箭头所示为阳性表达。

因子n未诱导48 h7 d14 d21 dGFAP150±0.0049.87±4.8476.67±4.3274.47±6.6856.47±5.36*
2.4 MTT法检测分化过程中细胞的生长趋势
干细胞源性星形胶质细胞在分化过程中OD值结果如图4所示。可以发现细胞存活率随诱导分化时间的延长而逐渐呈现下降趋势,且各组之间(未诱导及诱导后48 h-21 d)具有统计学差异(图4)。

图4 MTT法检测诱导过程中细胞的生长曲线
2.5 流式细胞术检测分化不同时间点的细胞凋亡
通过流式细胞仪检测,发现分化前后各组之间的细胞存活率差异具有明显的统计学意义(P<0.05)。分化后48小时细胞在诱导后各组中数量最多,存活率最高,之后随分化时间的延长凋亡率逐渐上升,存活率逐渐下降,至21天时存活率达到最低。同时发现,早期细胞凋亡率随着诱导时间的延长而逐渐呈现上升趋势,未诱导细胞凋亡率最低,21 d时最高。各组间差异具有统计学意义(P<0.05)。而且细胞晚期凋亡率或坏死率亦随分化时间延长逐渐上升,未诱导最低,21 d达高峰,各组间差异具有统计学意义(P<0.05)。实验的机械损伤率在各组间差异无统计学意义(P>0.05)(图5,表2)。
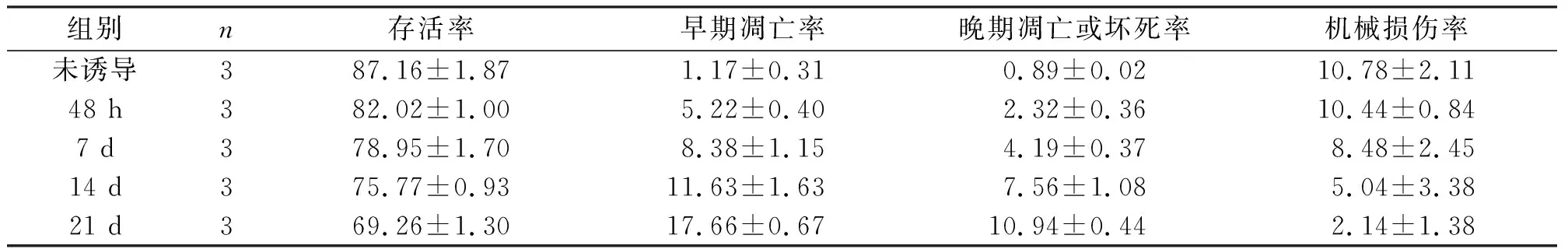
表2 流式细胞术检测此诱导反应中细胞存活状态(x—±s) %
注:n代表实验重复3次。

图a-e分别为未诱导细胞及诱导后48 h、7 d、14 d、21 d的细胞凋亡分布情况。左上象限UL: 为机械损伤细胞,右上象限UR:为晚期凋亡或坏死细胞,左下象限LL :为活细胞,右下象限LR:为早期凋亡细胞。
图5流式细胞术检测诱导反应中细胞凋亡分布图
3 讨论
脑血管疾病发生时,AS出现死亡或功能障碍,致使其对损伤神经元的支持、再塑及修复作用减弱,导致更多神经细胞的变性甚至死亡,进而进一步加重脑功能障碍。由于AS为永久性细胞且人脑内神经干细胞的数量少、分布局限,AS的自我更新、修复能力远不能满足临床自我修复治疗的需要,因此干细胞或AS移植在进行组织修复与功能重建中有重要的临床意义,被认为是治疗脑血管疾病最有前途的治疗方法之一,成为当前神经科学家和临床医生研究的焦点。然而,截止到目前,常被临床及实验室用于细胞移植治疗的胚胎干细胞和骨髓基质细胞等干细胞因涉及临床来源和伦理等方面的问题,使其深入研究受到了极大的限制;ADSC具有体内含量丰富,临床易于取材,分离纯化方法简便,诱导反应易于操作、安全,自体移植无伦理问题等特点,引起了研究者的广泛关注。
本研究证明,ADSC可在体外培养及分化。经DE-1诱导剂干预,诱导分化的星形胶质细胞具有明显的细胞突起,胞体、胞核外观圆形,胞核居中,可见到1-2个核仁。分化第7 d至14 d,细胞的镜下形态已基本发育成熟。免疫组化结果显示,该时间点所检测到的GFAP阳性表达率也均达到高峰,提示细胞分化成熟。前期的大量结果显示,在这种化学诱导反应的第7 d时所获得的细胞,已经具有了正常星形胶质细胞的膜电位等电生理功能[9-13]。然而,如果继续延长细胞分化时间,细胞衰老现象逐渐显现,胞体不饱满,突起回缩变短,数量减少,甚至消失,死亡的细胞数量明显增加。同时,本研究的MTT法和流式细胞术分析结果显示,随着诱导时间逐渐延长,诱导至14 d时的细胞存活率已明显低于7 d存活率。因此,我们可以得出结论,应用IBMX诱导的星形胶质细胞可在体外存活3周,在诱导的第7天获得的星形胶质细胞的数量最多,效率最高,此时即可以终止这种诱导反应。但细胞存活率随诱导时间逐渐下降。细胞凋亡是造成诱导过程中细胞死亡的主要因素。因此,寻找导致细胞死亡的原因及机制可以延长分化后细胞存活时间,为今后开展进一步药物筛选、临床细胞移植提供更为足量的种子细胞。

