桦褐孔菌黄酮含量测定及抗氧化研究
林雪松,李秀格,崔鑫鑫,靳 微,李 敏*
(吉林农业科技学院中药学院·吉林吉林·132101)
桦褐孔菌(Inonotus obliquus),主要分布在西伯利亚、俄罗斯和远东地区、波兰、北欧、中国大、小兴安岭和长白山地区、黑龙江、日本北海道及北美北部等纬度在北纬 45°~50°的寒冷的地区[2]。又名白桦茸等,是一种生长在桦树上的药用真菌[1]。现代研究表明,桦褐孔菌中主要化学成分为三萜类、甾醇类和生物碱类化学成分[3],具有抗癌、抗氧化、降血糖、抗病毒、抗真菌等多种生物活性[4~5]。迄今,有关桦褐孔菌的质量研究报道较少。本实验拟对八个产地的桦褐孔菌进行总黄酮含量测定及抗氧化研究,为桦褐孔菌质量研究提供理论基础,进一步扩大桦褐孔菌资源的开发,保证其及相应制剂的稳定性。
1 材料与方法
1.1 仪器与材料
桦褐孔菌样品为实地采集或由相关单位提供,样品信息如下S1-西藏林芝、S2-黑龙江黑河、S3-黑龙江牡丹江、S4-黑龙江伊春、S5-吉林长白山、S6-吉林吉林、S7-俄罗斯西伯利亚、S8-日本北海道,留样凭证存放于吉林农业科技学院药物分析实验室。
抗坏血酸 (维生素C,南京化学试剂有限公司);DPPH (1,3-二苯基-2-三硝基苯肼);KH2PO4;Na2HPO4;芦丁标准品(吉林生物制品检验所);无水乙醇;甲醇;5%亚硝酸;10%硝酸铝;0.1mol/L氢氧化钠 (以上试剂均为分析级)。
CP114电子天平(奥豪斯仪器有限公司);G-08A型高速中药粉碎机 (浙江瑞安市百信药机器械厂);TDL-40B离心机 (东旺仪器设备有限公司);DHG-9035A型电热鼓风干燥箱(上海源长实验仪器设备厂);恒温水浴锅 (天津市泰斯特仪器有限公司,DK-98-II);THC型数控超声波提取器 (济宁天华超声电子仪器有限公司);UV-2500紫外可见分光光度计 (日本岛津公司);N-1100型旋转蒸发仪(瑞士布其有限公司)。
1.2 实验方法
1.2.1 标准曲线的制备
精密吸取标准芦丁对照品溶液 (200μg/mL)0、1.0、2.0、3.0、4.0、5.0 mL, 分别置于 10 mL 比色管中, 各加60%乙醇至5 mL;加5%NaNO2溶液0.5 mL,摇匀放置6 min后,加10%A1(NO3)3溶液 0.5mL,摇匀,再放置6min;加4%NaOH溶液4mL,摇匀放置10~20 min。在510 nm波长处,以第1管溶液做空白分别测定吸光度,以吸光度对浓度进行回归,绘制标准曲线,并计算回归方程。
1.2.2 总黄酮含量测定
将桦褐孔菌烘干、粉碎,精密称取50℃干燥至恒重的桦褐孔菌粉末1g,置于三角瓶中,加入50%乙醇100mL,超声波调至 60℃条件下,超声 15~20min,过滤,收集滤液,提取两次,用50%乙醇定容,即得。
精密吸取黄酮提取液1.0mL置于10mL比色管中,按各加60%乙醇至5mL进行操作,加5%NaNO2溶液0.5 mL,摇匀放置 6min;再加 10%Al(NO3)3溶液 0.5mL,摇匀放置6min;加4%NaOH溶液4mL,摇匀放置10~20 min。在510nm波长处,测定吸光度。X=(A+0.0052)×10×100/(6.03×m×1000)
式中,X为样品中总黄酮含量(以芦丁计)%;A为吸光度,m为样品的质量g。
1.2.3 方法学考察
加样回收率 精密称取S1、S2两份样品,各3份,分别将对照溶液 1.0、2.0、3.0mL 置于三角瓶中,按“1.2.2”提取及测定。
精密度 精密称取S3样品5份平行样,置于三角瓶中,按“1.2.2”提取及测定。
稳定性 选择S6样品进行稳定性实验,在0、15、30、45、60 min 测定其吸光度。
1.2.4 黄酮抗氧化能力测定
羟基自由基(-OH)的测定:向试管中加入1.00mL蒸馏水,FeSO4溶液2.00mL,水杨酸-乙醇1.50mL,最后加H2O2(0.03%)0.10mL启动反应,振荡混合,在波长510nm处测定其吸光度值A0。
向试管中加入样品提取物溶液1.00mL,FeSO4溶液2.00mL,水杨酸-乙醇 1.50mL,最后加 H2O2(0.03%)0.10mL启动反应,振荡混合,水浴 37℃,保温 30min,离心(3000r,10min),在波长510nm下测量各自的吸光度值AS。
自由基清除率计算公式为:D=(A0-AS)/A0×100%。
式中,A0为空白管的吸光度,AS为加入自由基清除剂后的吸光度。
2 结果与分析
2.1 总黄酮测定结果
2.1.1 标准曲线
由图1标准曲线可知,芦丁含量与吸光度呈现良好的线性关系,得到回归方程为Y=6.3x-0.0052,相关系数为r=0.9992。

图1 芦丁的标准曲线Fig.1 Calibration curves of rutin
2.1.2 加样回收率考察
由表1结果可知,样品回收率为98.58%~101.30%,均值为99.98%,RSD为1.34%,表明回收率良好,方法准确度较高。
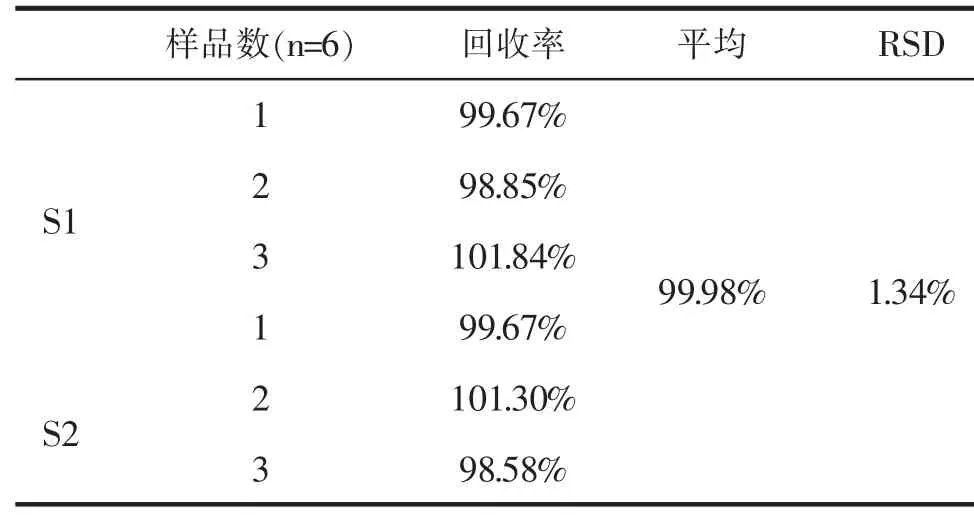
表1 加样回收率考察Table 1 Sample recovery rate
2.1.3 精密度考察
由表2结果可知,RSD为1.94%,表明该方法精密度良好。

表2 精密度考察Table 2 Precsion experiment
2.1.4 稳定性考察
由表3可知,吸光度值的RSD为1.64%,结果表明供试品在60 min内稳定。
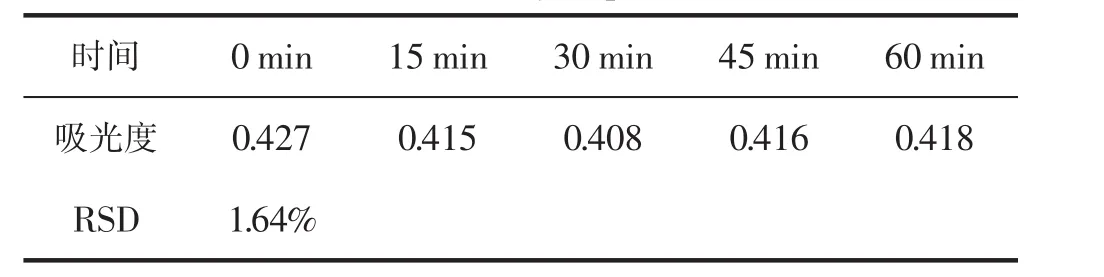
表3 稳定性考察Table 3 Stability experiment
从回收率、精密度和稳定性可看出,本实验加样回收率、精密度及稳定性均良好,方法可行。
2.1.5 黄酮的含量测定
不同产地桦褐孔菌总黄酮含量见表4。

表4 桦褐孔菌总黄酮含量Table 4 The total flavones of Inonotus obliquus
桦褐孔菌总黄酮含量方差分析结果见表5。
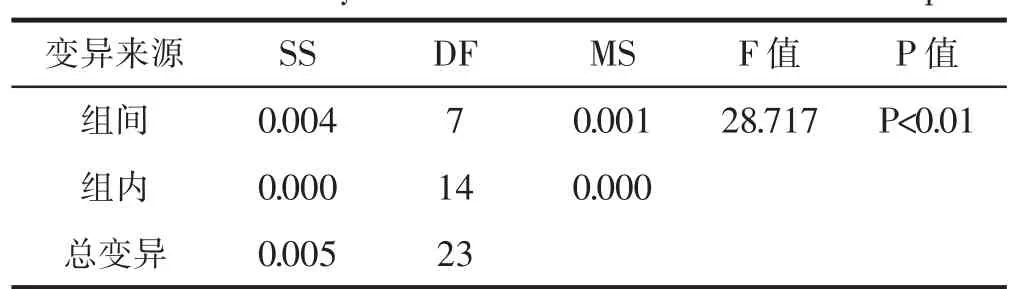
表5 桦褐孔菌总黄酮含量的方差分析Table 5 Yariance analysis of the total flavones in Inonotus obliquus
由表5可知P<0.01,故在显著性水平0.01下,不同产地桦褐孔菌中总黄酮含量存在差异显著性。

表6 桦褐孔菌总黄酮含量的多重比较Table6 Multiplecomparisonsof thetotal flavonesinInonotusobliquus
由表6可以看出,产地S5桦褐孔菌总黄酮平均含量最高,与产地S2无显著差异,显著高于产地S4,且极显著高于产地 S6、S8、S7、S1、S3;产地 S2 平均含量次高,与产地S4无显著差异,且极显著高于产地产地S6、S8、S7、S1、S3、S5;产地 S1 平均含量次低,与产地 S3 无显著差异;产地S3桦褐孔菌总黄酮平均含量最低。
2.2 抗氧化能力测定结果
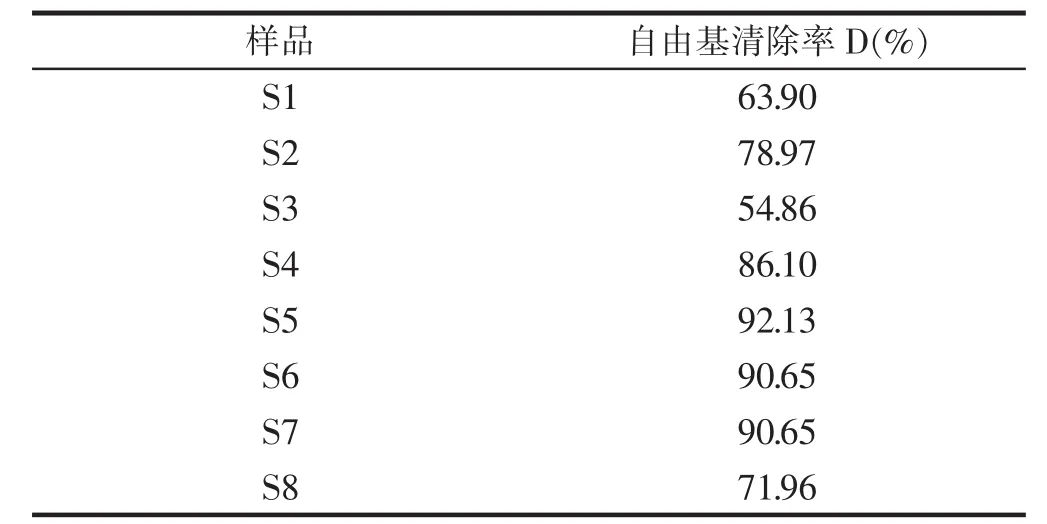
表7 桦褐孔菌总黄酮对羟基自由基清除率Table 7 Radical free rate of the total flavones in Inonotus obliquus

表8 桦褐孔菌总黄酮对羟基自由基清除率的方差分析Table8 Yarianceanalysis of radical freerate of the total flavones in Inonotusobliquus
由上表可知P<0.01,故在显著性水平0.01下,不同产地桦褐孔菌中黄酮对羟基自由基清除能力存在差异显著性。

表9 桦褐孔菌总黄酮对羟基自由基清除率多重比较Table9 Multiplecomparisons of radicalfreerate of the total flavonesin Inonotusobliquus
由表9可看出,产地S5桦褐孔菌中黄酮清除羟基自由基平均能力最好,与产地S7、S6、S4无显著差异,显著高于产地S2,且极显著高于产地S8、S1、S3;产地S7平均能力次好,与产地S6、S4、S2无显著差异,极显著高于产地S8、S1、S3;产地S1平均能力次差,与产地S3无显著差异;产地S3桦褐孔菌中黄酮清除羟基自由基平均能力最差。
3 结论
不同产地桦褐孔菌总黄酮含量测定结果表明,其含量关系为S5-吉林长白山>S2-黑龙江黑河>S4-黑龙江伊春>S6-吉林吉林>S8-日本北海道>S7-俄罗斯西伯利亚>S1西藏林芝>S3-黑龙江牡丹江,各产地黄酮含量均较低,其中S5-吉林长白山桦褐孔菌中的总黄酮含量最高 (0.072μg/g),S3-黑龙江牡丹江总黄酮含量最低(0.031μg/g)。抗氧化能力测定结果表明,S5-吉林长白山、S7-俄罗斯西伯利亚、S6-吉林吉林、S4-黑龙江伊春的总黄酮清除羟基自由基的效果均较好,无显著差异。综上所述,不同产地桦褐孔菌在总黄酮含量方面存在着差异,且总黄酮有一定的抗氧化能力,这为桦褐孔菌的开发利用提供一定的理论基础。

