MiRNA-503胞内转染对大鼠脂肪干细胞成骨分化的影响
卓丽丹,李 红,郭红延
干细胞具有多向分化的能力,其骨向分化能力的增强可促进骨组织的增加[1,2],这个分化过程主要受一些调控因子和复杂的信号通路调节,包括核心蛋白基因RUNX2、BMP、P13K/AKT等[3]。近年来研究发现,一种长度为21~25 bp内源性小分子核糖核酸(micro ribonucleic acid,MiRNA)可以通过调控网络的方式靶向关键转录因子或者信号通路,参与干细胞骨向分化[4-6]。MiRNA-22阻遏组蛋白去乙酰化酶6的翻译,使RUNX2的抑制作用减弱,促进干细胞骨向分化[4];MiRNA-21通过靶向人第10号染色体上的磷酸酶和张力蛋白调节P13K/AKT通路,促进干细胞骨向分化[5];MiRNA-30e通过靶向人低密度脂蛋白受体相关蛋白6抑制 Wnt/β catenin信号通路,下调β catenin,RUNX2表达量减少,对于骨分化具有抑制作用等[6]。近期一项研究表明,在牵张成骨的动物模型中MiRNA-503表达有所提高,但其作用机制尚不清楚[7]。本实验在体外将MiRNA-503转染入脂肪干细胞(adipose stem cells,ADSC)中探讨MiRNA-503是否促进干细胞的骨向分化,现报道如下。
1 材料和方法
1.1 实验动物 SD大鼠3~4周,雄性,体重35~45 g,由军事医学研究院动物房提供[动物使用许可证号:SCKK(京)2016-0006 ],标准化饲养1周。动物一般情况检查状态良好,体温、呼吸、精神状态好。
1.2 实验试剂 α-MEM、 H-DMEM、Opti-MEM(Gibco,美国);血清(天津灏洋生物制品科技有限公司,中国);碱性磷酸酶(alkaline phosphatase,ALP)试剂盒、胰蛋白酶、RNA提取试剂盒、Ⅳ型胶原酶、dispase酶、地塞米松、左旋抗坏血酸、β-甘油磷酸钠、氢化可的松、3-异丁基-1-甲基黄嘌呤(3-Isobutyl-1-Methylxanthine,IBMX)(Sigma,美国);大鼠间充质干细胞表面标志抗体CD29、CD90、造血干细胞的表面标志抗体CD34、白细胞表面标志抗体CD45、胰岛素(达科为生物技术有限公司,中国);cDNA反转录试剂盒、PCR 反应试剂盒(Toyobo公司,中国);Trizol、lipofectamine 3 000 (lipo-3 000,Invitrogen,美国);MiRNA-503、阴性对照核苷酸(Negative control CY3)(苏州吉玛基因有限公司,中国);β catenin、RUNX2、骨涎蛋白(BSP)、骨钙素(OCN)引物序列(梓熙生物科技有限公司合成,中国);青霉素、链霉素、异丙醇、丙酮、4%多聚甲醛(国药基团化学试剂有限公司,中国);油红O粉(上海试剂三厂,中国);eppendorf管(EP管,Axygen公司,中国)。
1.3 实验仪器 CO2细胞培养孵箱(Thermo,美国);倒置显微、流式细胞仪(BD,美国);离心机(Heraens Cryofuge 8 000,德国);Ⅰ型超净工作台(苏州净化设备厂);反转录聚合酶链式反应(reverse transcriptionpolymerase chain reaction,RT-PCR)检测仪(Axygen公司,中国)。
1.4 方法
1.4.1 细胞培养 取5只健康SD大鼠,在腹部剪梭形切口,暴露腹股沟脂肪垫,取腹股沟处白色脂肪,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗,去除脂肪外面粘连的包膜、肉眼可见的小血管及较明显结缔组织。将脂肪组织剪碎约1 mm3,加入1 ml Ⅳ型胶原酶、1 ml dispase酶、4 ml 0.25%胰酶、4 ml H-DMEM,放置37 ℃、5%CO2孵箱中消化15 min,随后使用100目、200目过滤网过滤,1 000 g 离心5 min,完全培养基(10%国产血清,1‰青霉素,1‰氯霉素,90%α-MEM)重悬计数,按照1×105/cm2接种于培养皿中,第2天首次进行换液去除未贴细胞,随后观察,待细胞长至90%时一部分细胞进行冻存,剩余细胞按照1∶3传代用于后续实验。
1.4.2 ADSC进行成骨、成脂诱导 P2代细胞生长达90%消化计数,以1×105/孔接种至6孔板培养板中作为诱导组,置于37℃,5%CO2培养箱中培养 24 h进行成骨、成脂诱导。成骨诱导液(10%国产血清、10 mmol/L β-甘油磷酸钠、1 mol/107L 地塞米松、50 mg/L左旋抗坏血酸);成脂诱导液(α-MEM,15%国产血清,终浓度1 μmol/L地塞米松,0.5 μmol/L IBMX,10 ng/ml胰岛素,1 μmol/L氢化可的松),每间隔1 d更换诱导液。另外5×104/孔接种至12孔板为对照组只添加完全培养基。
1.4.3 ALP染色 成骨诱导分为成骨诱导组和对照组,诱导7 d按照ALP试剂盒说明进行ALP染色,两组细胞弃上清,PBS清洗2次 ;加入固定液(1.96 ml去离子水、0.04 ml柠檬酸、7.5 ml丙酮)30 s,去离子水清洗2次;加入染色液(0.05 ml固蓝BB盐、2.35 ml去离子水、0.1 ml萘酚AS-MX磷酸盐),6孔板1 ml/每孔、12孔板500 μl/每孔,室温静置30 min后,去离子水洗涤2次,留少量的液体拍照。
1.4.4 油红O染色 成脂诱导分为成脂诱导组和对照组,诱导12 d进行油红O染色:(1)配置油红O,油红O粉0.5 g,加异丙醇100 ml,60 ℃水浴,玻璃搅棒搅至完全溶解;(2)用PBS将两组洗涤2遍后,使用4%多聚甲醛固定30 min。(3)去离子水洗涤2遍后,加入油红O(6孔板1 ml/每孔,12孔板500 μl/每孔)染色10 min。去离子水洗涤2遍后即刻在显微镜下拍照。1.4.5 胞内转染 将已证明具有成骨、成脂能力的ADSC P0代细胞复苏培养至P2代,ADSC以2×105/孔接种至6孔板培养板中,加入2 ml完全培养基,置培养箱中培养 24 h 以使细胞密度达到60%~80%,实验前2 h将完全培养基更换为α-MEM。实验分为实验组(N组)转染MiRNA-503和对照组(NC组)转染 Negative control CY3,相关序列见表1。准备2支EP管(A和B管),A 管中加入 400 μl Opti-MEM+4 μl lipo3 000+4 μl MiRNA-503,B 管中加入 400 μl Opti-MEM+4 μl lipo3 000+4 μl Negative control CY3,轻吹3~5次混匀,室温下静置5 min。将混合液分别加入两组细胞培养液中,放置孵箱中继续培养48 h以充分转染。

表1 MiRNA-503和Negative control CY3相关基因序列
1.4.6 细胞流式检测 细胞转染完成后,细胞消化重悬,制备1 ml PBS悬液,其中细胞数为1×106,N组准备五支EP管标记为11、12、13、14、15,每管1 ml PBS悬液;NC组同样准备五支标记为21、22、23、24、25。两组分别加入相应抗体 1 μl ,CD45(11、21),CD29(12、22),CD90(13、23),CD34(14、24),空白对照(15、25)放置摇床30 min,温度4℃。测试前清洗后加PBS至总体积为400 μl,然后使用流式细胞检测仪检测细胞表面标记情况。
1.4.7 成骨诱导鉴定 转染完成后,两组样品均换成成骨诱导液,成骨诱导7 d进行ALP染色和RT-PCR检测。成骨诱导7 d,检测两样本成骨相关基因水平,使用Trizol提取总RNA,测量RNA浓度,定量反转录形成互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),然后进行RT-PCR检测。成骨相关基因引物为RUNX2、BSP、OCN相关引物序列见表2。RT-PCR的反应体系为:2×T5 Fast Qpcr Mix 10 μl,上下引物分别为 0.5 μl,cDNA 1 μl,DEPC 水 8 μl,反应体系为 20 μl体系,扩增条件为 95 ℃ 5 s、60 ℃ 34 s,共40个循环。

表2 成骨相关基因引物序列
1.5 统计学处理 采用SPSS 22.0软件进行统计分析,计量资料以±s表示,组间比较采用独立样本t检验。以双侧P<0.05为差异有统计学意义。使用Image J 软件分析图片结果。
2 结 果
2.1 ADSC形态学观察 ADSC P0代细胞成细梭状,其中部分细胞呈三角形等不规则形态(图1A)。经传代纯化细胞,P3代ADSC纯度较高,ADSC长梭状,呈涡旋式分布,类似成纤维细胞(图1B)。

图1 ADSC细胞形态学特征(光镜,×100)
2.2 ADSC成骨、成脂染色 成骨诱导组ALP染色(42.712±4.055),细胞胞浆内含较多的ALP蓝色颗粒(图2A);成脂诱导组油红O染色(47.607±6.604),细胞胞浆内含橘红色的类似串珠状的脂滴(图2C),均高于对照组(7.383±1.840,2.780±0.278,图2B、图2D)差异有统计学意义(t=13.742,P<0.001;t=11.747,P=0.007)。
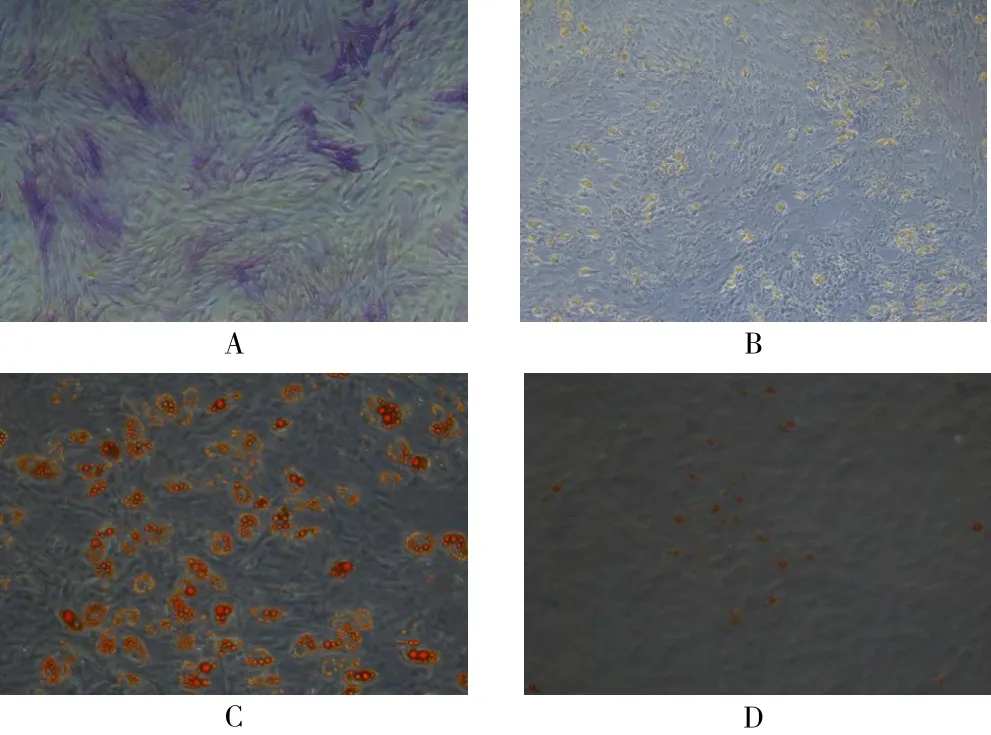
图2 ADSC成骨、成脂诱导染色
2.3 转染后细胞检测
2.3.1 流式细胞检测结果 CD29和CD90阳性表面抗原高表达,N组CD29表达量99.8%,CD90表达量99.9%;NC组CD29表达量99.6%,CD90表达量99.2%;CD34、CD45等阴性表面抗原低表达,N组CD34表达量0.6%,CD45表达量0.4%;NC组CD34表达量0.3%,CD45表达量0.0%,见图3。
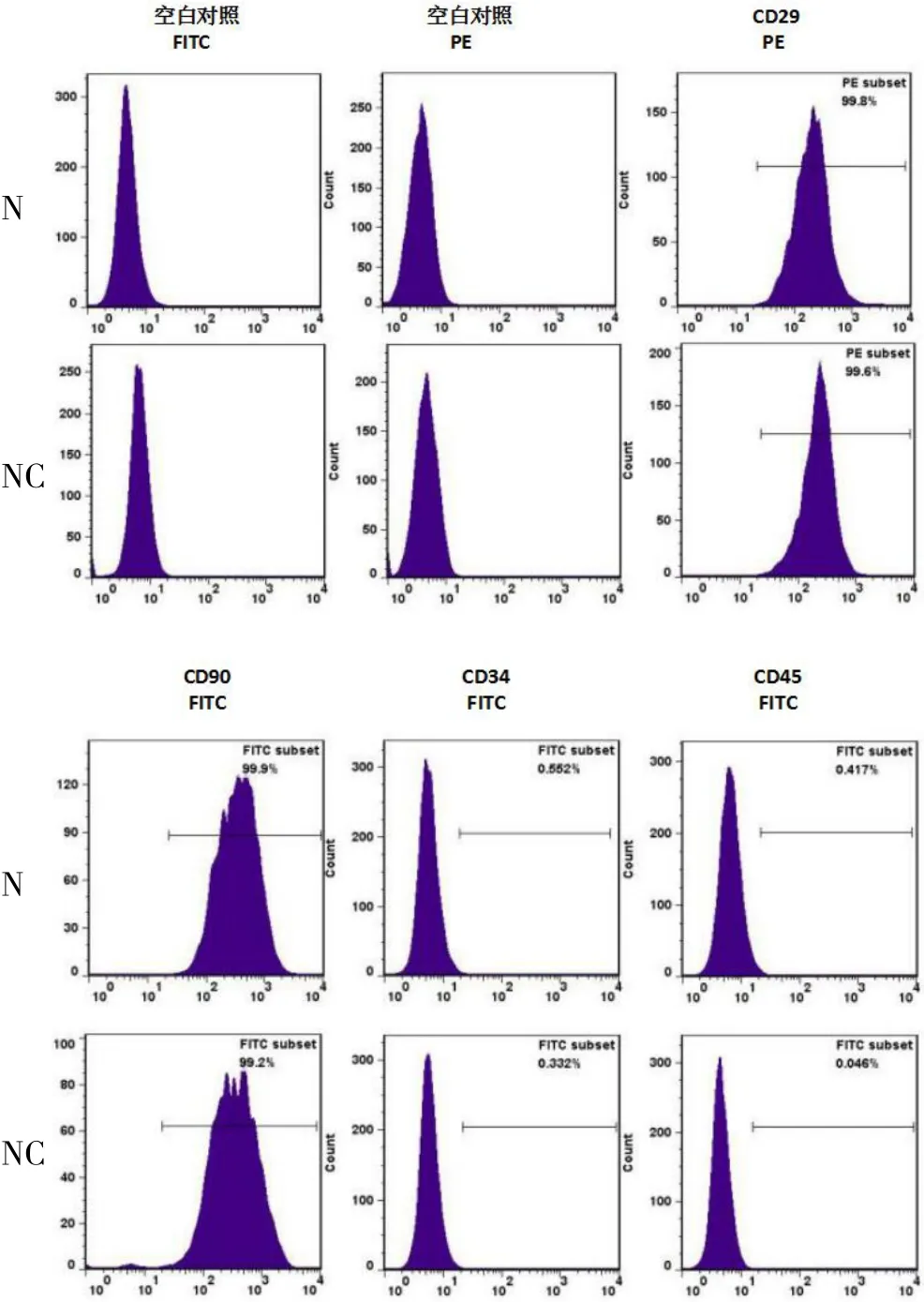
图3 转染后两组ADSC 细胞表面标志抗原的表达
2.3.2 ALP染色 N组阳性细胞(104.014±13.773,图4A)高于NC组(44.111±1.925,图4B),差异有统计学意义(t=9.952,P=0.009)。
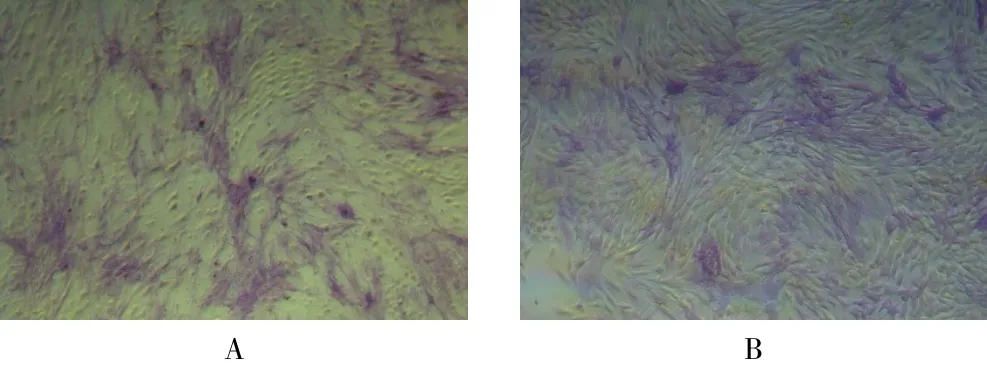
图4 转染后两组细胞ALP染色结果
2.3.3 成骨相关基因检测 N组表达成骨相关基因RUNX2、BSP、OCN均强于NC组,差异有统计学意义(P<0.05,图 5)。

图5 转染后成骨诱导7 d 两组成骨相关基因的表达
3 讨 论
本实验通过贴壁培养提取原代ADSC,生长速度较快,细胞纯度较高具有多向分化干性,与2001年Zuk等[8]首次从脂肪组织中分离出一种成纤维样细胞,具有自我更新和多向分化的能力的ADSC 描述相符。由于其来源广、易培养等优点,已经成为骨组织工程的种子细胞。尽管基因工程在修复骨组织缺损和再生治疗领域中表现出巨大的潜力,但仍存在一些不足,如转染质量控制、转染效率以及安全性等[9-11]。实验中采用非病毒lipo-3 000作为载体,流式结果显示N组和NC组特异性表面抗原没有明显差异,说明转染后ADSC仍保持着多向分化的潜能,也提示这种转染方式是安全的,为基因转染干细胞提供一种安全、有效的新思路。
ALP染色阳性是成骨细胞的特异现象,ADSC转染完成后成骨诱导7 d, ALP染色结果显示N组ALP的表达高于NC组。ALP是成骨分化过程中早期表达的蛋白之一,ALP活性越高,说明成骨分化能力越强。ALP具有转运磷酸盐、Ca2+、ATP酶或作为钙结合蛋白的作用,并且具有启动钙化程序的作用,以促进骨向分化。本实验采用RT-PCR的方法检测RUNX2、BSP、OCN的基因表达量。RUNX2、BSP、OCN是骨分化过程中重要的调控因子,其表达量可反映干细胞的成骨能力,RUNX2 是成骨分化过程中关键的调控因子,能够调控众多基因的转录,RUNX2缺失鼠中成骨细胞的分化完全被抑制,均不发生骨膜内成骨和软骨内成骨[12]。BSP是骨标志性蛋白基因,它是一种硫酸化的磷蛋白和高度糖基化,能激活成骨细胞,促进骨矿化[13]。OCN是一种一般仅由成骨细胞表达的基质蛋白基因,具有调节基质钙化的作用,其浓度可以作为成骨细胞活动的标志[14]。RT-PCR结果显示N组成骨相关基因表达明显强于NC组,说明MiRNA-503促进ADSC骨向分化,但作用机制尚不清楚。笔者运用生物学信息的方法,搜索Target Scan网站,获得300多个MiRNA-503可能的靶基因,其中与成骨基因密切的相关因子如:Wnt3α、Smad7、Wnt2b等,MiRNA-503在ADSC可能靶基因将在后续的实验中进行验证和筛选。
综上所述,MiRNA-503在ADSC骨向分化的过程中起促进作用。目前仍待解决明确MiRNA-503促进干细胞骨向分化的作用机制;转染MiRNA的量和质的控制问题[15-17]。随着研究的逐渐深入,基因化的骨组织工程或许是将来临床治疗骨组织缺损和骨缺失的一种简单、高效、方便的创新性的治疗方法。

