棘球绦虫和其它寄生性绦虫乙酰胆碱酯酶和烟碱型乙酰胆碱受体作为潜在药物靶点的研究进展
刘川川,樊海宁,马 兰,格日力
棘球蚴病又称包虫病,是由多房棘球绦虫和(或)细粒棘球绦虫的幼虫棘球蚴寄生于机体所导致的慢性人兽共患疾病,其成虫主要寄生在狐狸、狗的肠道,经粪便排出的虫卵具有传染性,人为其中间宿主。包虫病可以在不同的宿主器官如肝脏、肺、甚至是心脏和脑中寄生。目前,尚无有效的预防棘球蚴病的疫苗[1],并且治疗主要依赖于阿苯达唑,该药通过干扰虫体的能量代谢发挥作用。但ABZ因其肠道吸收率低,且必须在肝脏转化为砜类才能发挥作用,对肝脏的副作用较明显。因此,探索治疗棘球蚴病新的治疗靶点是十分必要的。绦虫、吸虫等寄生虫体内缺乏循环系统和内分泌腺体,而神经系统是产生调节运动、生长发育等信息物质的关键结构[2]。棘球绦虫等蠕虫寄生虫依赖于其神经肌肉组织中的快速突触传递,与外界环境相互作用并对其作出反应[3]。因此,研究者希望通过特异性阻断寄生虫神经递质来达到驱除寄生虫的目的。目前,已经上市销售的一些驱虫药(如左旋咪唑、噻嘧啶、莫奈太尔和敌百虫等)主要作用于线虫神经肌肉系统上的nAchR以及由此引发的离子通道活性改变[3-5]。神经肌肉活动的抑制可能导致肌肉功能和基本活动的丧失,包括宿主附着、进食、交配以及信息的及时传递,从而干扰寄生虫的寄生和生长,导致寄生虫在宿主体内被杀灭,效果显著。而针对棘球绦虫和其它寄生性绦虫nAchR和AchE的药物研发仍处于空白。
1 棘球绦虫的神经系统
绦虫神经结构周围缺乏明显的鞘层或明确的边界,相对与脊椎动物结构较为低等。棘球绦虫中枢神经系统由2部分构成[3,6]:第一部分是大脑神经节和神经循环,吸盘的神经支配以及与周围神经系统相连的纵向神经索起源于该层;第二部分是一个旋转的神经环和它的分支组成,贯穿于虫体头节以外的节片,主要分布于寄生虫的皮层、肌肉以及生殖系统发挥调节作用[7]。棘球绦虫体内缺乏内分泌腺体以及完整的循环系统,神经系统是产生激素、神经递质以及调节肽的唯一结构,对棘球绦虫的生长、发育、生殖至关重要。棘球绦虫的突触结构中也以突触小泡作为物质运输的形式,但其突触结构表现出比高等动物更多样的方式[8-9]。基于此,人们希望通过特异性阻断神经递质、神经肽等物质与相关受体的结合或影响其降解与合成过程,达到对抗绦虫而不影响机体的正常功能。
2 棘球绦虫胆碱能神经系统
在棘球绦虫胆碱能系统中[6,10],AchE通过水解乙酰胆碱来调节乙酰胆碱与细胞乙酰胆碱受体之间的相互作用,使离子通过电化学梯度进入或离开虫体。AchE的主要作用是通过使神经递质Ach的快速水解来终止胆碱能突触的传递,具有很高的催化活性[11-12]。通过Na+、K+或Ca2+的内流使膜去极化,信号通过阳离子选择性乙酰胆碱受体和Ach介导肌肉收缩,对蠕虫产生明显的影响,通常表现为麻痹、瘫痪[13]。根据有关成年吸虫的研究显示[14],外源性胆碱能激动剂可能导致成年吸虫性麻痹,nAChR在曼氏血吸虫肌纤维的激活过程中起着重要作用。此外,当乙酰胆碱酯酶功能活性受到抑制时,乙酰胆碱酯酶的含量越高,对nAChR的刺激就越强,导致nAChR的脱敏和离子通道的关闭[10,15]。在哺乳动物细胞的研究中[16-17],17个已知同源亚基(α1-α10,β1-β4,γ、δ、ε)组装成不同的nAchR亚型,包括肌肉型nAChRs和神经型nAChR亚型。肌肉型nAchR的5种亚基组合形式在发育阶段比较固定(α12β1γδ),能够通过与乙酰胆碱结合而激活,从而导致缓慢的代谢反应。随着棘球绦虫基因组测序的完成,目前已识别出棘球绦虫nAchR中有α和β亚基,对于其它亚基还未见报道[18]。
3 棘球绦虫nAchRs
目前,只有少部分棘球绦虫nAchR亚基被鉴定出来,其功能也未得到证实。烟碱乙酰胆碱受体是环配体门控离子通道(LGICs)超家族的成员,在神经递质乙酰胆碱或外源配体(如尼古丁)结合后参与信号转导。nAChRs包含两个或多个α亚基,而α亚基与相邻亚基组成的二聚体接合面是Ach结合的关键。每个nAChR亚基的跨膜域由四个螺旋跨膜结构组成(M1-M4)[17]。nAchR各亚基的M2结构域形成离子通道,该离子通道仅在Ach结合引起的变构构象变化时打开。该通道对Na+和K+具有较高的渗透性,Ca2+约占其总渗透率的2.5%[19]。Ach与nAChR亚基的配体结合域(胞外部分)结合,活化的nAChR导致五聚体蛋白的结构改变,导致配体门控离子通道的打开。随着对棘球绦虫测序的完成,目前所发现的棘球绦虫nAchR受体亚型仍然较少,但在参与哺乳动物神经信号传递的关键亚基(如α4β2)在棘球绦虫测序中却未能发现;对已发现亚基的功能研究仍未进一步研究。棘球绦虫跨膜nAchR受体亚基胞外段也存在由13个氨基酸组成的特征性半胱氨酸环结构(图1),提示棘球绦虫nAChRs是环配体门控离子通道超家族的成员;同时,该环结构在参与Ach和nAchR的结构结合和寄生虫的神经传递有重要作用[20-21]。通过对已发现亚基模体结构分析,发现棘球绦虫nAchR亚基中存在着高度保守的门控离子通道配体结合域和跨膜域(表1)。最近研究者提出了G蛋白与神经元nAChRs之间存在直接耦合,这导致了一种新的假设[22],即神经元烟碱乙酰胆碱受体的主要胞内环中的某些氨基酸构成了G蛋白的结合位点,与G蛋白受体结合可以调节细胞nAChRs的活性和信号传导,这一过程在结构上与配体门控离子通道的打开有关,并通过相关实验得到证实。
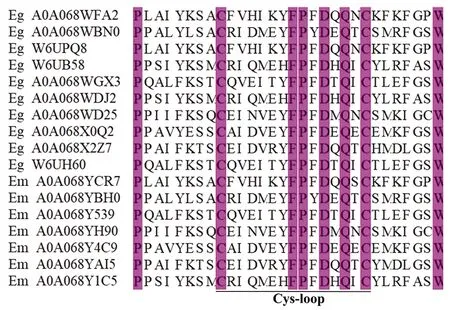
图1 棘球绦虫跨膜nAchR受体C-FP-D-Q-C特征性结构Fig.1 Characteristic structure of transmembrane nAchR receptor C-FP-D-Q-C of Echinococcus
5-羟色胺(5-hydroxytryptamine,5-HT)是一种抑制性神经递质,为G蛋白偶联受体家族成员,广泛分布哺乳动物组织中,尤其是大脑皮层及神经突触内。G蛋白与受体结合可以调控nAchR的活性。研究发现[23]绦虫5-HT受体在棘球绦虫原头节和成虫以及包虫囊壁中均有表达,该受体在调控寄生虫神经肌肉控制方面起主导作用,同时在调控发育和繁殖方面也有重要作用。5-HT 在无脊椎动物的各种生命活动中同样发挥了重要的作用,很多的5-HT受体已经从不同物种中克隆出来,但克隆出的寄生虫5-HT受体与哺乳动物5-HT的亲和力都很低,表明非脊椎动物5-HT受体与哺乳动物受体结构存在差异,基于此筛选对寄生虫5-HT 受体高选择性,而对非靶标生物无害的药物是新型杀虫剂的另一个研制目标。早在1994年[24-25],研究者采用免疫细胞化学技术鉴定了棘球绦虫神经系统5-HT受体的定位和分布,神经细胞体和神经纤维对5-HT免疫反应发生在成对 的外侧神经节、后侧神经节和星状神经节,它们的连合部和头节中的神经环,以及遍及蠕虫全身向后延伸的十条纵向神经索中,同时发现其分布与乙酰胆碱酯酶的分布相一致,但5-HT受体表现出更广泛的分布范围。之后研究者采用间接免疫荧光技术鉴定在原头节中5-HT受体和神经肽的定位和分布[26],其在中枢神经环、环状神经和支配吸盘的神经丛中的定位与成虫相同。考虑到5-HT受体在寄生虫生物学中的重要作用,以及5-HT受体相对于哺乳动物的差异,5-HT受体被认为是抗包虫病的药物靶点。在原头节培养中添加5-HT后,短时间内其运动能力明显增强;但在加入5-HT转运体抑制剂西酞普兰后,消除了5-HT诱导的运动性增加,而5-HT受体拮抗剂昂丹司琼却无明显作用,表明西酞普兰能抑制5-HT转运蛋白,也证明了其受体结构与哺乳动物的差异[27];同时原头节用含5-HT培养基孵育几天后诱导向中绦期分化,而中绦期的幼虫在宿主体内能以无性繁殖的方式产生原头蚴,表明5-HT在棘球蚴的发育过程中具有一定的神经功能和促发育作用[27]。但到目前为止,在棘球绦虫神经肌肉连接处,5-HT的确切作用机制尚不清楚。在其它无脊椎动物的研究中发现[23,28],5-HT的应用增加了可释放突触小泡的总突触池的大小,以响应突触前膜末端的动作电位。可以假设,在添加5-HT后,类似的作用机制可能会以类似的方式作用于棘球绦虫的神经肌肉连接处,但还需要更多的实验来验证这一假设。
然而,乙酰胆碱和寄生虫的乙酰胆碱受体结合如何导致离子通道的打开仍有待研究。根据哺乳动物的研究以及有关棘球绦虫的研究,预测棘球绦虫潜在胆碱能信号通路,如图2。
4 棘球绦虫AchE
早期研究发现[29],一种特殊的酶存在于棘球绦虫头节匀浆和生发囊中,其对乙酰胆碱的水解率是丁酰胆碱的45倍,其活性可被毒扁豆碱和乙基四磷酸酯(有机磷杀虫剂)抑制。西班牙科学家实验发现[30],细粒棘球蚴会释放乙酰胆碱酯酶等多种酶类,这些酶可以穿过生发层和囊壁,进入宿主组织,破坏宿主产生的乙酰胆碱;棘球蚴产生这些酶可能是对抗棘球蚴病化疗药物的有吸引力靶标,可以通过药物抑制酶的活性导致乙酰胆碱累积,阻塞神经功能。这些研究都证实了棘球绦虫有乙酰胆碱酯酶(AchE)的存在。乙酰胆碱和乙酰胆碱酯酶抑制剂可以放松蠕虫的肌肉组织,减少寄生虫的蠕动,最终导致瘫痪[31]。
大多数单克隆抗体仅能与寄生虫的乙酰胆碱酯酶相互作用,而不与脊椎动物宿主乙酰胆碱酯酶发生作用,表明宿主与寄生虫酶具有不同的表位结构及空间构象[32]。因而针对棘球绦虫及其它寄生虫AchE特异性的抗原表位是药物设计和疫苗开发的靶点,同时药物可能表现出对脊椎动物较低的毒性。棘球绦虫等蠕虫乙酰胆碱酯酶分布于寄生虫的表面,可用于评估抗蠕虫药物的有效性[33]。研究者使用钙调素拮抗剂处理棘球蚴引起棘球蚴表层被膜明显改变,头钩脱落,并且在其培养上清液中检测出AchE的表达明显增加,但有趣的是在未处理组培养上清液中也检测到AchE的存在,对此一个可能的解释是由于AchE与细胞膜上成分的相互作用的方式导致很容易被释放到培养基中,是一种独特的附着部分[33],同时也表明AchE可能也分布于棘球蚴表面。研究者使用白藜芦醇处理绦虫后[6],导致吸盘松动并出现麻痹,其乙酰胆碱酯酶的表达量下降,表明白藜芦醇可能通过抑制其乙酰胆碱酯酶的活性而导致绦虫体壁肌肉松弛。
表1 棘球绦虫烟碱乙酰胆碱受体保守结构分析
Tab.1 Conserved structure analysis of nicotinic acetylcholine receptors in echinococcus
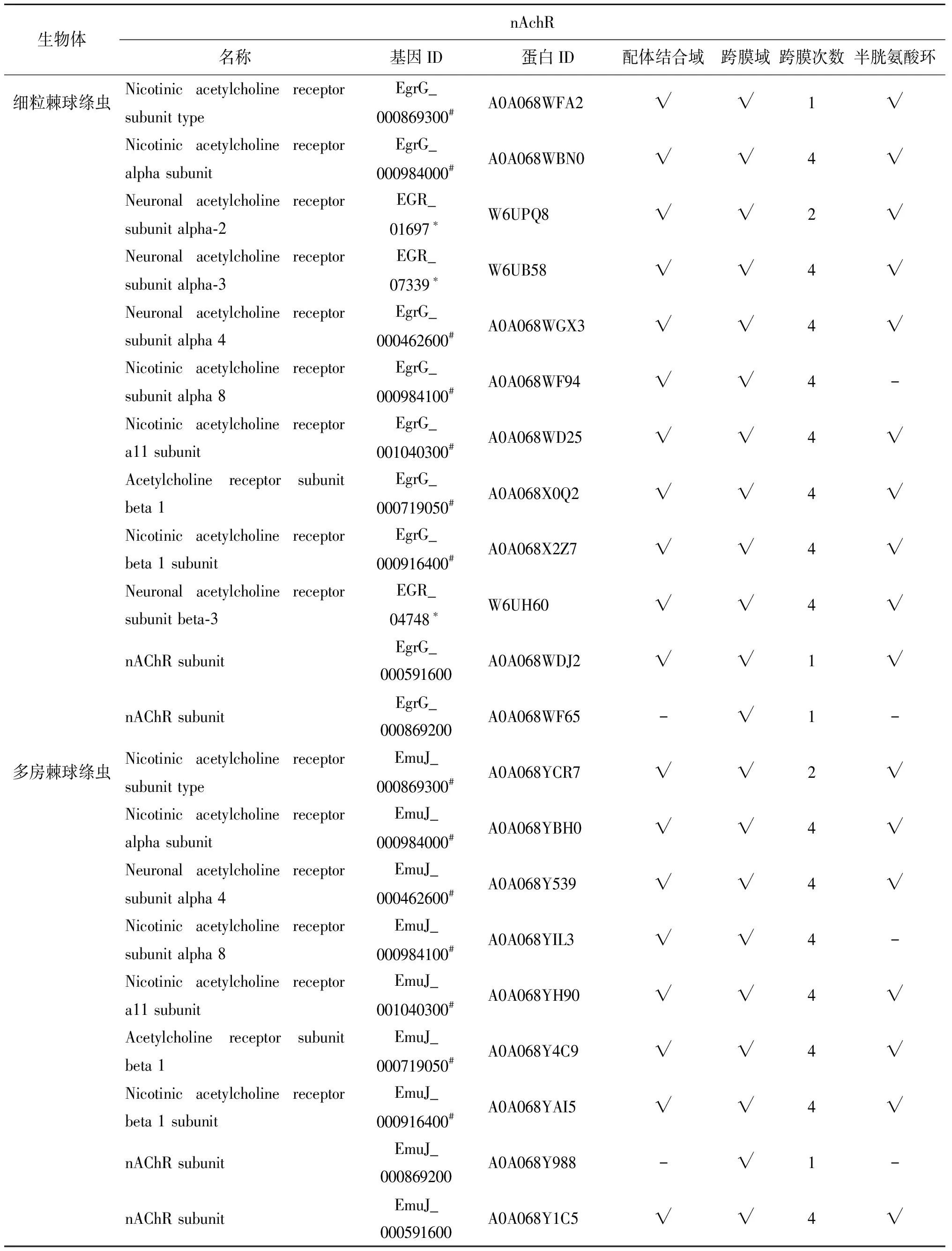
生物体nAchR名称基因ID蛋白ID配体结合域跨膜域跨膜次数半胱氨酸环细粒棘球绦虫Nicotinic acetylcholine receptor subunit typeEgrG_000869300#A0A068WFA2√√1√Nicotinic acetylcholine receptor alpha subunitEgrG_000984000#A0A068WBN0√√4√Neuronal acetylcholine receptor subunit alpha-2EGR_01697∗W6UPQ8√√2√Neuronal acetylcholine receptor subunit alpha-3EGR_07339∗W6UB58√√4√Neuronal acetylcholine receptor subunit alpha 4EgrG_000462600#A0A068WGX3√√4√Nicotinic acetylcholine receptor subunit alpha 8EgrG_000984100#A0A068WF94√√4-Nicotinic acetylcholine receptor a11 subunitEgrG_001040300#A0A068WD25√√4√Acetylcholine receptor subunit beta 1EgrG_000719050#A0A068X0Q2√√4√Nicotinic acetylcholine receptor beta 1 subunitEgrG_000916400#A0A068X2Z7√√4√Neuronal acetylcholine receptor subunit beta-3EGR_04748∗W6UH60√√4√nAChR subunitEgrG_000591600A0A068WDJ2√√1√nAChR subunitEgrG_000869200A0A068WF65-√1-多房棘球绦虫Nicotinic acetylcholine receptor subunit typeEmuJ_000869300#A0A068YCR7√√2√Nicotinic acetylcholine receptor alpha subunitEmuJ_000984000#A0A068YBH0√√4√Neuronal acetylcholine receptor subunit alpha 4EmuJ_000462600#A0A068Y539√√4√Nicotinic acetylcholine receptor subunit alpha 8EmuJ_000984100#A0A068YIL3√√4-Nicotinic acetylcholine receptor a11 subunitEmuJ_001040300#A0A068YH90√√4√Acetylcholine receptor subunit beta 1EmuJ_000719050#A0A068Y4C9√√4√Nicotinic acetylcholine receptor beta 1 subunitEmuJ_000916400#A0A068YAI5√√4√nAChR subunit EmuJ_000869200A0A068Y988-√1-nAChR subunitEmuJ_000591600A0A068Y1C5√√4√
#基因ID来源于http://www.genedb.org/Homepage;*基因ID来源于https://www.ncbi.nlm.nih.gov/;蛋白ID来源于https://www.uniprot.org/

图2 预测棘球绦虫胆碱能信号途径Fig.2 predicted the cholinergic signal pathway of echinococcus
表2 棘球绦虫AchE基本信息
Tab.2 Basic information of AchE in echinococcus
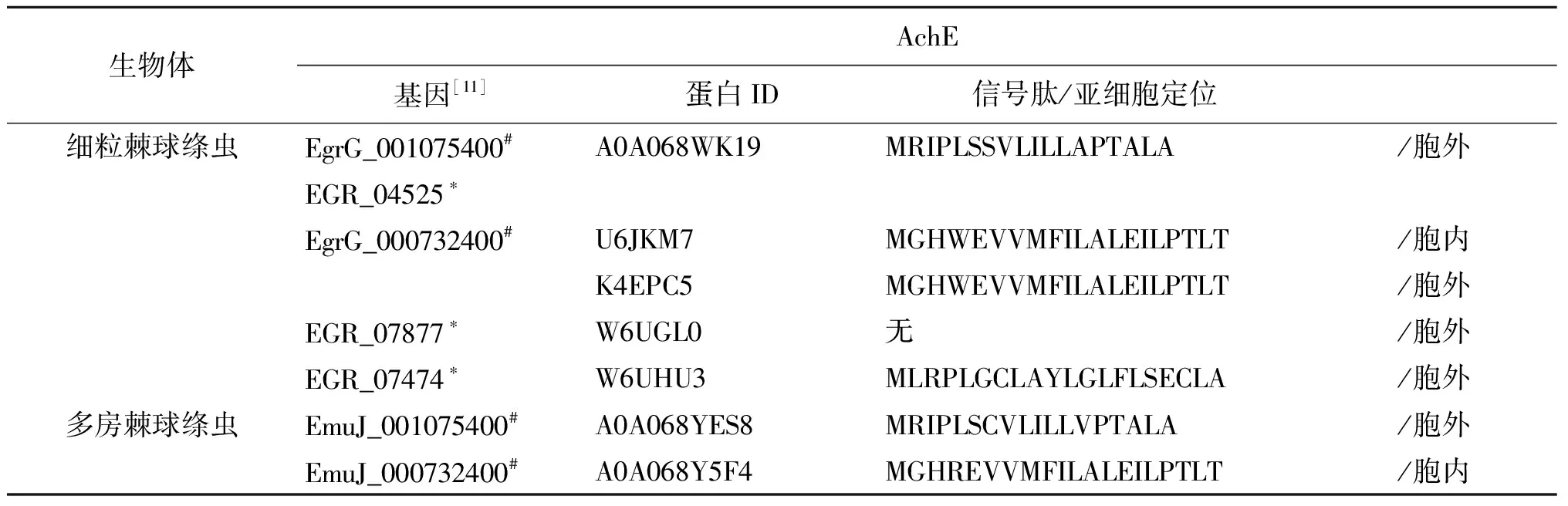
生物体AchE基因[11]蛋白ID信号肽/亚细胞定位细粒棘球绦虫 EgrG_001075400#A0A068WK19MRIPLSSVLILLAPTALA/胞外EGR_04525∗EgrG_000732400#U6JKM7MGHWEVVMFILALEILPTLT/胞内K4EPC5MGHWEVVMFILALEILPTLT/胞外EGR_07877∗W6UGL0无/胞外EGR_07474∗W6UHU3MLRPLGCLAYLGLFLSECLA/胞外多房棘球绦虫EmuJ_001075400#A0A068YES8MRIPLSCVLILLVPTALA/胞外EmuJ_000732400#A0A068Y5F4MGHREVVMFILALEILPTLT/胞内
#基因ID来源于http://www.genedb.org/Homepage;*基因ID来源于https://www.ncbi.nlm.nih.gov/;蛋白ID来源于https://www.uniprot.org/
5 其它寄生虫绦虫AchE和nAchRs研究进展
近年来,随着对多种棘球绦虫基因组的研究,对寄生性绦虫的寄生机制及潜在的作用靶点的识别提供了理论依。但目前对于棘球绦虫及其它寄生性绦虫相关受体的鉴定及功能研究相对缺乏,而在吸虫和线虫相关受体的研究取得了较大的进步。早期的研究表明[34],在秀丽隐杆线虫体内乙酰胆碱是控制运动的主要兴奋性神经递质,而AchE是调节的关键酶,并证实了四种AchE基因可以编码不同的酶。最近的研究表明,线虫分泌乙酰胆碱酯酶的功能之一可能是改变宿主细胞因子环境,抑制M2巨噬细胞的发育,从而增进寄生虫的生存。在成年肝片吸虫脑神经细胞胞体和脑神经节的神经束中也检测到乙酰胆碱酯酶的存在[35],进一步研究还发现乙酰胆碱酯酶反应产物与含有透明球状突触泡的突触末端相关,反应产物定位于突触前端和突触后端对位区的突触接触部位,这种酶的分布与它作为胆碱能传递降解酶的功能一致[33,35];同时,肝片吸虫能影响机体胆碱和嘌呤的代谢,进而影响疾病的发病机制和进程[36]。在血吸虫中发现AchE存在于血吸虫表面,并能调节葡萄糖代谢[37-38];研究者使用RNA干扰技术敲除AchE在血吸虫成虫和虫卵中的表达,这导致了它的转录减少,影响了胆碱能信号传导和葡萄糖摄取的相关重要基因的表达[39]。在大肠杆菌中表达重组AChE后免疫接种小鼠,接种疫苗组的雄性蠕虫数量、肝肉芽肿密度和成熟肠卵数量均较对照组减少,表明乙酰胆碱酯酶在雄性蠕虫的代谢中起着重要作用,并间接影响雌性的繁殖力,导致未成熟卵的释放量增加和肝肉芽肿体积减小[39]。新近研究发现[40],聚吡啶钌(II)能抑制血吸虫AchE活性,处理后对葡萄糖的吸收能力明显下将,糖原储存明显减少。这些研究都进一步证明了AchE在寄生虫的生长发育、运动及影响宿主方面的中药作用。在寄生虫的不同发育阶段[41],乙酰胆碱酯酶的分子形式和功能活性的存在较大的差异,在成虫阶段表现更为突出,这种变化可能反应了复杂神经系统的存在,尤其在寄生虫发育的晚期是必须的。
AchR作为潜在驱虫药物的靶点越来越受到关注,AchR是胆碱能激动剂或拮抗药物的主要靶点,代表药物有左旋咪唑、噻嘧啶、三苯双脒和得曲恩特[42]。寄生虫体内存在多种类型的nAchR,只有少部分受体亚型被鉴定出来,各受体亚型的功能仍不确定,并且针对nAchR不同亚基药物联合使用表现出比单药使用更加明显的疗效[43]。秀丽隐杆线虫体内已被证明具有两种刺激性AchR[42,44]:一种对左旋咪唑敏感,由3个α亚基(LEV-8、Cel-UNC-38、UNC-63)和2个非α亚基(LEV-1和UNC-29)组成的五聚体;另一种对尼古丁敏感,由acr-8和acr-16组成,acr-8的缺失对信号的传递无影响,而acr-16亚基的基因消融可以消除体壁肌肉中的非左旋胆碱能反应。从猪蛔虫中分离出的3种AchR亚型为N型、L型和B型,介导蛔虫体壁肌肉的收缩,每种亚型对胆碱能驱虫剂的敏感性不同[45]。研究者在爪蟾卵母细胞中表达编码蛔虫unc-29和unc-38亚基发现,两亚基的比例会影响驱虫药物的敏感性[46]。通过对寄生线虫模型的4个nAchR亚型的鉴定,证明每个亚型都获得了独特的功能特征,这些功能是基于转基因秀丽隐杆线虫的表型研究和非洲爪蟾卵母细胞受体重组的电生理学基础上获得的[47]。基于秀丽隐杆线虫的研究发现[47],寄生虫可以通过改变nAchR受体的组合形式,导致其功能发生差异,药物因作用靶点结构改变而失效。
大量的研究表明,寄生虫nAchR亚基存在不同的亚型,不同的亚型执行特有的功能,同时各亚型在组合成多聚体时能发生构象改变,从而导致寄生虫对药物敏感性下降和耐药的产生。
6 小 结
抗包虫病药物引起的耐药性、低生物利用度和水溶性差、严重的副作用限制了其使用。因此,迫切需要研制治疗包虫病感染的新型药物。AchE和nAchR在寄生性蠕虫神经肌肉和其他信号系统中起着重要作用,是目前市场上销售的许多驱虫药物的靶点。了解AchE和nAchR的分子特征和功能特性以及它们在中枢神经系统的分布,将推动高效驱虫剂的研发进程。有关棘球绦虫的研究还远落后于脊椎动物,许多功能性分子的作用还未证实。目前,应用RNA干扰技术在了解寄生虫各亚基功能上取得了一定的进步。随着对棘球蚴病早期诊断试剂研发的不断进展[48-49],对包虫病治疗特效药物的研发提出了更加严格的考验。
利益冲突:无

