神经内镜与神经导航辅助显微镜下经鼻蝶入路切除垂体瘤的疗效比较
王宁 刘立军 陈妮娜
垂体瘤临床症状较为典型,可以表现为肢端肥大、闭经、阳痿、不育头痛等,有相关流行病学调查指出,在鞍区肿瘤中最为常见的类别为垂体瘤,占比超过60.96%,其中青壮年男性尤为常见。垂体瘤主要影响患者激素分泌,进而影响到生长发育过程,其在我国居民中发病率呈逐年升高趋势[1]。垂体瘤在临床上当前治疗方式仍以手术切除为主,药物治疗为辅[2]。不同手术方式由于手术路径或创口大小的差别,导致患者治疗效果存在明显差异。神经导航的出现使得显微镜下切除技术得到了重新发展,但该方法由于对患者颅脑开窗手术造成的伤害相对较大[3]。神经内镜因其微创的特点被广泛推广,但该技术在对头部精确定位上存在一定劣势。本研究分别使用神经内镜、神经导航辅助显微镜技术对垂体瘤患者进行手术,以期了解两种方法的疗效差异,为临床实践提供理论支持。
资料与方法
一、一般资料
选取湖北医药学院附属襄阳市第一人民医院神经外科自2016年1月至2018年7月收治的160例垂体瘤患者,用硬币投掷法随机将患者分为神经内镜组(神经内镜下经鼻蝶入路切除垂体瘤)和神经导航组 (神经导航辅助显微镜下经鼻蝶入路切除垂体瘤),每组80例。诊断参照《脑垂体瘤临床诊断与治疗》,患者对研究和手术方法均知情同意,研究获得医院医学伦理委员会批准。2组患者一般资料比较,差异无统计学意义(P>0.05,表1)。2组患者均衡性好,具有可比性。
纳入标准:(1)经专家会诊和论证,建议择期手术治疗;(2)无相关药物过敏;(3)患者基本情况可以耐受手术和麻醉;(4)患者无其他分泌系统疾病或肿瘤疾病;(5)未合并其他器官重大疾病;(6)无严重并发症。排除标准:(1)预期生存期少于3个月;(2)术前伴有神经功能衰弱或痴呆。
二、治疗方法
患者均采取头仰卧位,气管插管后进行全身麻醉、常规消毒(头部和面部)和铺巾,其中80例患者使用神经内镜进行手术治疗,另外80例患者使用神经导航辅助显微镜进行手术治疗,手术入路均为经鼻蝶入路。

表1 2组患者的一般资料比较
(1)神经内镜组:使用神经内镜寻找中鼻甲和鼻中隔,沿着中鼻甲和鼻中隔之间的通道填塞副肾棉条扩张手术通道并暴露蝶窦开口,由其向后弧形切开鼻中隔黏膜,充分的暴露蝶窦前壁,再磨钻磨除蝶窦前壁和蝶窦间隔,除去蝶窦的黏膜充分显露鞍底。下部磨开1.5 cm的骨窗,暴露硬膜后进行常规穿刺。穿刺针穿刺鞍内安全,确认排除动脉瘤后电灼并十字切开,确认肿瘤。取瘤钳留足标本后,刮圈沿鞍内不同角度顺序依次刮除肿瘤,至肿瘤镜下全切,确认无肿瘤残留。充分止血,查看无明显出血,人工脑膜重建鞍膈,术侧填塞膨胀海绵条[4]。
(2)神经显微组:头架固定、后置显微镜,打开薄层CT数据导入神经导航工作站进入工作界面[5]。逐步分离鼻中隔的软骨黏膜,使用牵开器撑开之后,采用神经导航实时定位显露蝶窦的开口,分离鼻腔黏膜后凿开蝶窦前壁随后扩大,导航确定鞍底的位置,暴露鞍底,扩大鞍底面积为1 cm×1 cm,刮圈沿鞍内不同角度顺序依次刮除肿瘤,至肿瘤镜下全切,确认无肿瘤残留。充分止血,查看无明显出血,人工脑膜重建鞍膈,术侧填塞膨胀海绵条。
三、观察指标
记录患者手术过程中手术时间、术中出血量、术后住院时间。治疗前、治疗后(术后2周)后分别对患者生长激素含量进行检测,生长激素水平包括催乳 素 (prolactin,PRL)、生 长 激 素 (growth hormone,GH)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)。治疗后对患者临床疗效进行评定:治愈(内分泌症状恢复正常,体征及临床症状消失,MRI提示为全切除),显效(内分泌症状趋于正常,体征及临床症状大部分消失,MRI提示为次全切除或部分切除),有效(内分泌症状恢复部分,体征及临床症状部分消失,MRI提示部分切除),无效(内分泌症状仍旧明显,体征及临床症状无改善,MRI提示为较少部分切除)[6]。同时,记录患者住院期间并发症发生情况,包括尿崩症、低血钾症、视力障碍、颅内出血、鼻腔出血。
四、统计学分析
采用SPSS21.0进行统计学分析,计数资料(性别、垂体腺瘤类型、肿瘤侵袭性、内分泌异常症状、视野缺损、手术全切)采用率(%)描述,比较采用χ2检验;计量资料(年龄、病程、肿瘤直径;PRL、GH、ACTH 含量)采用均数±标准差(±s)描述,2 组比较采用独立样本t检验;组内治疗前后的比较采用配对t检验;等级资料(临床疗效)的比较采用秩和检验。以P<0.05为差异具有统计学意义。
结 果
一、2组患者手术相关指标比较
2组患者手术时间、术中出血量、术后住院时间差异具有统计学意义(P<0.05),神经内镜组患者手术时间、术中出血量、术后住院时间显著低于神经导航组患者。详细信息见表2。
表2 2组患者手术相关指标的比较(±s)

表2 2组患者手术相关指标的比较(±s)
?
二、2组患者治疗前后生长激素水平比较
治疗后神经内镜组患者PRL、GH、ACTH含量显著低于神经导航组患者,差异具有统计学意义(P<0.05)。与治疗前比较,所有患者治疗后PRL、GH、ACTH含量均有明显下降。详细信息见表3。
表3 2组患者治疗前后生长激素水平比较(±s,ng/L)

表3 2组患者治疗前后生长激素水平比较(±s,ng/L)
PRL:催乳素;GH:生长激素;ACTH:促肾上腺皮质激素
?
三、2组患者治疗后临床疗效比较
2组患者临床疗效构成的差异有统计学意义(Z=8.857,P<0.05)。 神经内镜组患者治疗有效率为92.50%,神经导航组患者治疗有效率为81.25%,2组患者临床有效率比较,差异有统计学意义(P<0.05)。详细信息见表4。
四、2组患者术后并发症比较
2组患者术后并发症比较,神经内镜组尿崩症、视力障碍、鼻腔出血并发症构成显著少于神经导航组,差异有统计学意义(P<0.05)。详细信息见表5。

表4 2组患者治疗后临床疗效比较[例(%)]
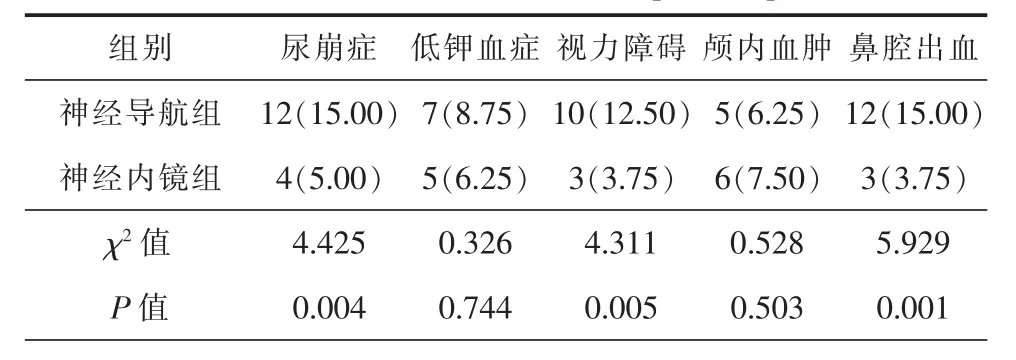
表5 2组患者并发症比较[例(%)]
讨 论
垂体瘤常发生于青壮年时期,因其对患者生长和发育影响较大而广受临床学者的关注。患者通常表现为因肿瘤压迫垂体周围组织而引发的症状群,如激素分泌异常等[7]。目前该疾病的治疗以手术为主,以前行开颅术切除瘤体,后逐渐发展为显微镜下切除,再到如今神经内镜及神经导航辅助的应用,使手术创伤大大减少,也缩短了术后恢复时间,而且定位更加准确后使手术风险也大大降低,但是随着神经导航技术的不断完善,各临床操作的疗效又显现出新的差异[8]。
本研究发现,神经内镜组患者的手术时间、住院时间均短于神经导航组,术中出血量少于神经导航组,提示神经显微组相比神经内镜组在临床各项指标上更有优势。虽然两种技术均为微创技术,但由于手术视野和操作技术的不同,两种技术在临床上存在一定差异:神经导航技术可以通过获得三维立体图像来快速判别患者的局部组织结构,从而明确手术路径,但是该技术使用单一管状视野,易造成局部光线严重不足,使临床医师在手术过程中操作节奏放缓,从而延长手术时间,术中出血量也自然增加;神经内镜则避免了该缺陷,通过使用高强度照明系统可以快速对细微结构进行处理。同时由于占位性病变造成的中线紊乱,导致在神经内镜的视野条件下很难清晰的辨别周围组织,但神经导航技术有助于提升经蝶入路的精确性,针对手术入路偏差的纠正效果尤为明显。有学者提出,鞍旁海绵窦、斜坡、前颅底等方向侵袭的巨型垂体瘤一直给神经外科的操作造成巨大挑战,尤其是手术盲区的存在使得手术时间极大延长,患者术中出血量也无法得到有效控制[9,10]。而笔者试验的神经导航技术则可以在较深的术野位置进行正确操作,同时仪器上的look ahead功能可以用于预先发现神经探头前面的组织结果,对患者神经血管起到更好的保护作用。
本研究发现,2组患者治疗后的PRL、GH、ACTH指标含量显著下降,这与手术过程中占位性病变的解除,神经功能得以正常恢复有关。研究还发现,神经内镜组治疗后生长激素PRL、GH、ACTH指标含量均显著低于神经导航组,两种方法对垂体瘤切除程度存在一定差异[11,12]。神经导航技术应用于垂体瘤患者,往往是在术前采集影像学资料,术中难免存在导航偏倚的情况,导致手术存在一定的误差;神经内镜则可以实时对患者细微结构进行操作,实现最大程度地切除原发病灶。神经内镜也存在局限性,即只能获得二维平面图像,会导致神经内镜图像随着手术入路角度或径深差异而造成图像发生不同程度地扭曲和变形[13-15]。神经导航辅助下能够准确快速地定位,找到蝶窦开口,暴露鞍底,确定手术路径,但该技术手术时间总体长于神经内镜治疗,所以患者应激状态和炎症水平也会明显高于神经内镜治疗[16,17]。
本研究中2组患者的尿崩症、视力障碍、鼻腔出血的发生率差异有统计学意义,其中神经内镜组各并发症发生率相对较低,这与手术对于手术路径的伤害以及垂体瘤的彻底清除程度有关,相较于神经内镜呈平面状的成像而言,显微镜的三维立体成像相对更好,但术中根据术前影像进行操作,难免导致路径迷失或发生偏差[18-20]。因此视野相对更广的神经内镜能够帮助术者更好地暴露路径以及垂体瘤,避免损伤神经、鼻腔,减少术后并发症的发生率,尤其对于蝶窦发育不正常,或者是多次复发的垂体瘤切除神经导航辅助显微镜下经鼻蝶入路肯定是首选。本研究中神经内镜组有效率(92.50%)高于神经导航组(81.25%),也进一步证实了神经内镜的技术优势。
综上所述,随着神经导航辅助技术的不断完善,瘤体的定位也更加准确迅速,但是相较于神经内镜治疗,其操作空间比较狭小,术者操作较为局限。两种治疗方法各有千秋,应根据患者自身特点和手术医生的擅长来制定最合适的手术方法。

