一体化同步扫描PET/MR研究进展
赵紫婷,徐 磊,周蕾蕾,蒋红兵,3*
(1.南京医科大学附属南京医院,南京市第一医院医疗设备处,南京 210006;2.南京医科大学附属南京医院,南京市第一医院核医学科,南京 210006;3.南京市卫生信息中心,南京 210003)
0 引言
医学影像学已经由形态解剖学影像发展到以组织代谢、功能成像及受体、基因表达为主体的分子影像。将现有成像方式进行整合,得到优势互补的联合成像设备具有更大的发展潜力和应用价值[1]。PET成像可提供人体生理代谢信息,具有探测灵敏性、分子靶向性。然而,低空间分辨力使得PET应用受限。PET/CT利用CT为PET提供解剖位置与衰减校正信息,拓展了PET的应用范围,但两系统数据并非同步采集,存在呼吸运动导致的配准误差。MR成像具有多参数、多序列、高软组织分辨力且无电离辐射的优势,一体化同步扫描PET/MR能够获得PET和MR在时间、空间上精确配准的图像。但由于成像条件的限制,MR的引入也随之带来了两系统难以兼容、图像伪影繁杂、成像视野(field of view,FOV)受限、PET图像衰减校正困难等问题。为使PET和MR合并成单一的成像系统,充分发挥二者融合后优势,研究人员先后通过结构设计与PET组件革新,实现PET与MR的融合。随着硬件的进步与图像重建算法和衰减校正的优化,一体化PET/MR实现数据同步采集,成像质量得到进一步提升,目前已初步应用于临床。本文就一体化PET/MR在硬件配置及成像技术方面的进展作一综述。
1 一体化PET/MR设备的发展进程
1.1 PET/MR结构设计
在传统PET和PET/CT中,γ光子由探测环中的闪烁晶体检测,并由光电倍增管(photomultiplier tube,PMT)记录。但磁场环境会对PMT产生干扰,没有屏蔽的金属部件会影响MR磁场的均匀性,降低MR的成像质量。为避免PET与MR相互干扰,Philips公司推出采用分体式设计的Ingenuity TF PET/MR[2]——通过可旋转检查床串联彼此独立的PET与MR系统,二者依次独立完成图像采集与重建,再经过配准得到融合图像,但无法实现数据同步采集,且图像采集时间长、设备占用面积大。随着磁场兼容性PET探测材料的发展,PET/MR结构实现了由分体式到PET插入式、完全集成式的飞跃(如图1所示),真正实现两成像模式的一体化融合。
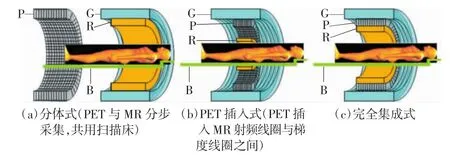
图1 一体化PET/MR结构设计横截面示意图[2]
PET插入式[3]:2006年Siemens公司推出第一台脑PET/MR设备,由标准的3.0T MR扫描设备及与磁场兼容的PET探测装置组成,可实现图像采集在时间和空间上的同步,但扫描孔径缩小,使得其应用受限。完全集成式[4-5]:2010年Siemens公司推出首台同机融合、能够进行同步扫描的全身一体化PET/MR——Biograph mMR。该设备将PET探测器嵌入MR射频线圈与梯度线圈之间,其间进行放射性散射屏蔽和射频系统屏蔽,减少PET与MR信号间的干扰,真正实现PET与MR等中心、同容积的同步扫描。随后GE公司于2016年首次推出配备飞行时间(time of flight,TOF)功能的一体化PET/MR系统——SIGNA PET/MR,将TOF技术引入一体化PET/MR系统。
1.2 PET探测装置
首先被提出并运用到一体化PET/MR中的是LSO-APD检测模块[6],其由磁场敏感度低的雪崩光电二极管(avalanche photodiode,APD)与硅酸镥(lutetium oxyorthosilicate,LSO)晶体组成。LSO晶体体积小[7](最小可达到2 mm×2 mm×20 mm),易于整合到MR腔体中,同时可以提高PET图像的空间分辨力。但APD对温度的稳定性要求相对较高且信号放大增益低、时间分辨力较差,无法胜任TOF功能。
之后,SIGNA PET/MR[8]采用硅光电倍增管(silicon photomultiplier,SiPM)与 25.0 mm×4.0 mm×5.3 mm的镥闪烁体,时间分辨力达到390~400 ps。SiPM对磁场敏感度低,且工作电压低、光电转化率高,其温度稳定性、能量分辨力、时间分辨力均优于APD,已成为TOF-PET探测器的最佳选择。与传统PMT相比,SiPM的灵敏度和空间分辨力提高一倍以上,时间分辨力已提高至400 ps以内[9]。
在此基础上发展起来的数字硅光电倍增管(digital SiPM,dSiPM)使得时间与空间分辨力进一步提升,但受到梯度磁场切换的影响,增加了不必要的电磁噪声,还有待进一步研究[10]。新型闪烁晶体探测器的出现,提高了PET成像的空间分辨力,使得PET与MR同机融合成为可能,并推动了TOF技术的发展。
2 图像重建
分体式PET/MR的图像重建依赖于两成像模式各自的重建算法及图像的异机融合配准,PET与MR重建算法的发展对于图像的精确融合定位至关重要。目前,利用一体化PET/MR设备的同步数据进行两成像系统联合重建是这一领域的热点问题,也是未来PET/MR图像重建的研究方向[11]。下面主要阐述PET图像重建中的TOF技术、点扩散函数(point spread function,PSF)与运动校正在一体化PET/MR中的应用。
2.1 TOF技术
TOF技术产生于20世纪80年代初期,随着晶体材料的发展与运用、PMT性能的优化、计算机处理能力的提升,TOF技术逐渐应用于临床[12],并于2006年产生首台TOF-PET/CT[13]。TOF技术在PET及PET/CT成像中的应用价值已得到相关研究证实[14-15],主要包括:提高图像信噪比(signal noise ratio,SNR)与病灶的标准化摄取值(standardized uptake value,SUV),缩短采集时间,减少金属伪影,减少呼吸状态不匹配对衰减校正的影响[16]。上述优势同样在TOF-PET/MR中得到证实[17-18](如图2所示)。
此外,TOF技术在PET/MR中体现了更大的应用价值。TOF技术能减少区域分割衰减校正导致的组织分割错误,校正截断伪影[18],从而提升PET/MR的衰减校正精度。在具备TOF功能的PET/MR设备中,PET与MR能够使用同一呼吸、心电和指脉门控信号,保证PET与MR同步扫描,为呼吸门控快速扫描奠定基础。若无TOF技术,PET/MR在胸腹部的应用会受到限制,尤其是无法获得精准定量化的结果[19]。TOF-PET/MR一般只需要TOF-PET/CT成像所需正电子药物剂量的40%就能得到临床可接受的影像质量[20],在低剂量成像中具有一定的优势。
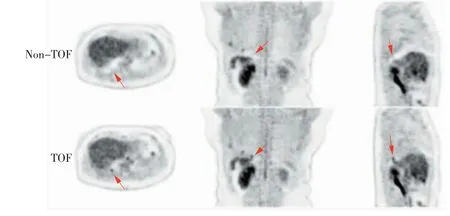
图2 TOF技术在基于MR的衰减图与相应PET图像呼吸状态不匹配时的表现[18]
2.2 PSF
TOF技术与其他图像重建算法结合能够进一步提升重建图像的质量,包括有序子集最大期望值法(ordered subsets expectation maximization,OSEM)与PSF。OSEM属于代数迭代方法类,重建的图像结构及层次清楚,伪影、变形少,定位及定量较准确,图像质量好。基于PSF的PET图像重建迭代算法能够利用点源测试所得的PSF,有效定位响应线(line of response,LOR)的实际几何位置,补偿几何失真,从而提高PET图像的空间分辨力和SNR[21]。目前,在一体化同步扫描TOF-PET/MR中采用PSF重建技术,可以获得亚毫米级分辨力[22],这在小病灶的诊断中必不可少。有研究表明,联合使用TOF、PSF和OSEM,能够显著提升图像重建效果[23]。
2.3 运动校正
为获取被测物体精确的运动信息、减少运动伪影对PET图像质量的影响,有必要进行运动校正。目前较为常见的PET头部运动校正包括基于帧和基于LOR的方法[24]。基于帧的方法是将重建后的各帧PET数据与MR图像配准后得到相应的运动信息(包括平移、旋转等),再将各帧图像作对应的反变换,也就是对重建后的PET图像的校正。该方法简单易行,但对PET图像质量有一定的要求,而且图像的重建过程会引入一定的噪声。基于LOR的方法是根据每个符合事件所对应LOR上的光子位置信息进行运动补偿。相较于前者,该方法只需对原始数据进行操作,不涉及重建,既能避免引入噪声,又能降低时间成本。
在此理论基础上,产生2种PET/MR成像的运动校正方法[25]:一种是重建后再融合(post-reconstruction registration,PRR),将每个门控采集的图像分别重建后融合至一个标准门控中,形成校正效果平均化的图像。该方法同样无法避免引入噪声,在静态扫描中可用延长扫描时间加以补偿。另一种是运动补偿图像重建(motion-compensated image reconstruction,MCIR),即通过迭代重建法直接重建出运动补偿图像。然而,这些方法的可行性都需要临床实践的进一步证实。
3 图像的衰减校正
PET显像受光子衰减和散射影响,需要通过衰减校正获得精确定量的图像。PET与PET/CT分别采用放射性核素源(68Ge/68Ga)与X线扫描获取人体组织与硬件对于511 keV光子的衰减图,即μ图。目前,PET/MR采用的校正方法主要包括:基于MR的衰减校正(MR based attenuation correction,MRAC)和基于PET发射数据重建的衰减校正。MRAC通过MR图像获得μ图,无电离辐射,可辅助PET/MR系统进行运动校正,改善部分容积效应[26],主要包括区域分割法和图谱配准法。基于PET发射数据重建的衰减校正能够获得较精确的μ图,有助于MRAC中截断伪影的校正。但目前,仅通过MR图像或PET发射数据尚无法获得扫描系统硬件部分的μ图,需要对其进行额外处理[27]。
3.1 区域分割法
该方法最初采用解剖结构显像较好、利于观察的T1WI MR图像,将人体组织按照不同的衰减特性进行分类,并赋予511 keV下相应的衰减系数,用于PET图像衰减校正[28]。其主要缺点在于:对于不同个体而言,忽略了组织的个体差异性;对于同一个体而言,即便在有差别的情况下,组织的分类数仍是固定的,不适用于本身密度不均匀的器官和组织(比如颅脑和肺组织)。此外,对于在常规MR图像中信号相近但透射衰减系数相差明显的组织结构(比如骨皮质与近端气腔),这种方法存在极大的组织分类误差。为此,在该理论基础上结合特殊的MR序列,更有助于精确的组织分割[29]。
(1)两点Dixon序列对水和脂肪进行更细致的分割,可将MR图像分为空气、肺、脂肪或软组织(如图3所示)。而骨组织在该序列呈现低信号,并被错误地赋予软组织的衰减系数。
(2)超短回波时间(ultrashort echo time,UTE)序列利用超短横向弛豫时间(T2)可获取较高信号强度的骨组织图像,用于头颅PET的衰减校正[30]。但空气与骨组织交界区域的分割误差仍不可避免。
(3)利用UTE序列结合Dixon序列得到新的三回波序列(UTE triple-echo,UTILE)对组织进行分类,可以得到基于MR图像的4级分类,实现全身骨骼和软组织的快速分离[31]。然而,该序列目前仅适用于小FOV成像,且仍不能实现副鼻窦的准确分割。
(4)基于UTE序列,有研究发现,利用零回波时间(zero echo time,ZTE)采集极短的 T2MR 信号,可进一步显示骨组织中骨小梁的结构[32],实现气腔、骨组织和软组织的分割,但同时受到采集时间增加的限制。
目前,针对不同扫描部位选择不同MR序列进行衰减校正,可得到较为理想的结果。
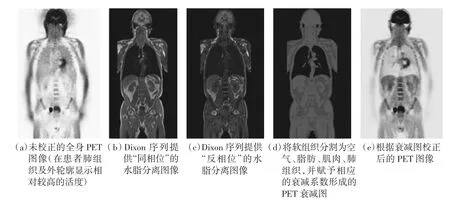
图3 基于MR的软组织衰减校正[29]
3.2 图谱配准法
图谱配准法采用预先获得的图像模板和实际采集的患者解剖图像进行配准,通过相应的组织成分差异,得到各组织的实际衰减系数,进而产生每例患者特有的衰减图。图谱配准法结合深度学习技术,可以获得具有连续衰减系数的衰减图,减少校正误差[33]。近期,在一项关于深度学习技术用于MRAC(深度MRAC)的研究中[34],研究人员利用深度学习方法从MR影像中模拟CT扫描,并在颅脑PET/MR成像中进行评估,得到了准确的模拟CT扫描数据,实现了很低的PET重建误差。与当前MRAC技术和基于CT的标准算法相比,深度MRAC能够减少颅脑PET的重建误差。由于头部运动是刚性运动,利用图谱配准法对头部显像仅需要刚性模型,而对于全身显像则需要弹性配准,这成为限制其全身应用的主要问题。
3.3 基于PET发射数据重建的衰减校正
受到MR成像条件限制,MRAC面临组织分割不准确、引入伪影及额外硬件的校正等影响。基于PET发射数据重建的衰减校正能够利用PET发射数据,结合TOF技术与其他算法获得较准确的衰减图。其中,交替重建迭代算法[35]不受个体组织结构差异影响,但在肺部与骨骼产生的误差较大。最大似然衰减活度重建(maximum likelihood reconstruction of attenuation and activity,MLAA)算法可对扫描中出现的截断伪影进行有效校正[36]。但由于仅用到发射数据,重建时放射性分布的特征会影响组织衰减系数的估计[37-38]。
以上方法都有各自的优缺点,未来一体化PET/MR衰减校正的最佳方案可能是各方法的结合。
4 结语
一体化PET/MR系统不仅是成像设备间的融合,还包括各成像技术间的强强联合,以及各学科间的融合发展。基于上述设备及成像技术的发展,一体化PET/MR能够以相同成像中心提供不同成像方式的数据,通过一次扫描获得兼备MR成像的形态学、功能信息和PET成像的分子代谢活动信息。然而,该系统尚存在扫描时间长、图像伪影繁杂、扫描视野范围较小等不足,现有成像技术还需要进一步完善,以提高图像的定量精度。随着硬件及软件的进步,未来一体化PET/MR成像系统有望实现更优的融合方式,向更加精准、更加灵活、更多功能、更广应用的方向发展,为临床诊疗提供全方面的影像信息,为更多相关研究领域的发展提供思路和方向,成为集基础研究与临床应用为一体的多模式分子成像系统。

