糖耐量受损患者血清eNOS mRNA和TRB3 mRNA表达与疾病干预的相关性研究*
樊 萍,苟小林,李 娜
(咸阳市第一人民医院a.检验科;b.内分泌科,陕西咸阳 712000)
糖耐量受损(IGT)是2型糖尿病的前期阶段,并具有血糖温和升高和胰岛素抵抗(IR)的特征。IGT患者已被证实存在较高的2型糖尿病风险,过高的IR,血糖以及糖化血红蛋白水平可以通过运动锻炼和饮食调节来降低[1]。目前的研究显示,人类循环内皮一氧化氮合酶(eNOS)和同源蛋白3(TRB3)的表达可能与IR及糖尿病的发生发展有关[2-3]。本研究采用RT-PCR技术分析IGT患者血清eNOSmRNA和TRB3mRNA的表达,旨在评价生活方式干预治疗IGT疾病的效果,并为2型糖尿病的有效预防和控制提供理论依据。
1 材料与方法
1.1 研究对象 选择2016年3月~2018年3月在咸阳市第一人民医院就医的58例IGT患者作为研究对象,均为初诊且未接受治疗。IGT患者均选择运动锻炼、饮食调节等生活方式干预治疗。所有患者均符合1999年世界卫生组织(WHO)的IGT诊断标准:空腹血糖<7.0 mmol/L,负荷后2 h血糖7.8~11.1 mmol/L。男性35例,女性23例,年龄51.20±12.37岁。另选取53例同期体检健康者纳入对照组,其中男性32例,女性21例,年龄50.30±12.97岁,均排除糖尿病家族史。实验组和对照组研究对象的性别和年龄比较差异均无统计学意义(P>0.05)。本研究已获得咸阳市第一人民医院医学伦理委员会批准,并得到所有研究对象的知情同意。
1.2 试剂和仪器 血清葡萄糖和胰岛素水平检测采用罗氏MODULARP800全自动生化分析仪。糖化血红蛋白(HbA1c)采用高效液相色谱仪检测。RNA提取试剂盒(上海久盛医疗用品有限公司)。反转录试剂盒(日本Takara公司),实时荧光定量试剂盒(美国Promega公司),化学发光凝胶成像系统(ChemiDocTM XRS)(美国Bioad公司),PCR扩增仪(美国ABI公司)。
1.3 研究方法
1.3.1 方法:IGT患者于干预治疗前及干预治疗3个月后分别采集静脉血液,HbA1c检测采用全血,其余项目均采用血清进行分析。所有研究对象均接受葡萄糖耐量试验和胰岛素释放试验,胰岛素抵抗指数(HOMA-IR)通过空腹血糖(FPG)及空腹胰岛素(FINS)计算得到,即HOMA-IR=FINS×FPG/22.5[4]。生活方式干预措施按照糖尿病饮食标准制定,每日饮食量包括主量约6两加少量脂肪并同时进行体育锻炼,观察时间为3个月。目标是减轻体重约10%。为了使患者体育锻炼目标能实现,本研究制订了最基本且易实现的运动方式,即饭后快步行走0.5~1 h,行走约1~2千米路程,体质较好的患者在此基础上可适当增加运动量或选择自己喜好的其他锻炼方式,活动量控制以患者在运动中自测心率在100次/min以内为宜,期间经常督促、鼓励患者坚持以达到目标。
1.3.2 PCR扩增:采用Trizol法提取血清RNA。引物设计采用Pfimer5软件,TRB3mRNA的引物序列为:上游5’-CTCTGGTCCTGCGTGATCTCAA-3’,下游5’-GTATGAGGCCCG7rGAGCTC AGTA-3’,扩增产物长度为115bp。eNOSmRNA的上游引物序列为5’-CGAGAGATGTAGTGTGCG-3’,下游为5’-AAGCAGGGCCATGTGCCA-3’,扩增产物长度为255 bp。采用β-actin作为内参照,其引物序列为:上游5’-GCCATCTTGACTGGAT-3’,下游5’-ACCTGGAGCGCGGACAACTA-3’,扩增产物长度为570 bp。cDNA测定采用荧光定量PCR仪。反应条件:95℃20 min,95℃30 s,58℃30 s,72℃45 s,以上反应进行30个循环,然后72℃5 min于4℃保存。将扩增产物进行凝胶电泳,并通过图像处理系统分析得到mRNA的吸光度。以β‐actin的吸光度为参考,求出eNOSmRNA和TRB3mRNA吸光度的变化值(△Ct)。mRNA表达量通过2-△Ct求得。

2 结果
2.1 各组糖尿病影响因素比较 见表1。治疗前组的体重指数(BMI),空腹血糖(FPG),空腹胰岛素(FINs),HbA1c及HOMA-IR分别与治疗后组比较显著增高,治疗后组的各项指标与对照组比较显著增高,差异均有统计学意义(P<0.05或0.01)。

表1 各组糖尿病影响因素比较
2.2 各组血清eNOSmRNA和TRB3mRNA表达比较 见表2和图1,图2。TRB3mRNA在治疗前组的表达显著高于治疗后组,治疗后组的表达与对照组比较显著增高(F=93.27,P<0.01);而eNOSmRNA在治疗前组的表达显著低于治疗后组,治疗后组的表达与对照组比较显著降低(F=89.65,P<0.01),差异均有统计学意义。
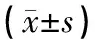
表2 各组血清eNOSmRNA和TRB3mRNA的表达比较

M.Marker(DL2000);a.对照组;b.治疗后组;c.治疗前组。 M.Marker(DL2000);a.对照组;b.治疗前组;c.治疗后组。
图1 eNOSmRNA扩增产物电泳图图2 TRB3mRNA扩增产物电泳图
2.3 相关分析 在治疗前组和治疗后组中,血清eNOSmRNA和TRB3mRNA的表达具有负相关性(r=-0.867,-0.826,均P<0.01)。在治疗前组和治疗后组中eNOSmRNA的表达分别与FPG,FINs,HbA1c水平及HOMA-IR有显著负相关性[(r=-0.779,-0.739,-0.727,-0.755,均P<0.01),(r=-0.726,-0.689,-0.667, -0.696,均P<0.01)],而TRB3mRNA与各指标则具有正相关性[(r=0.823, 0.769, 0.753, 0.797,均P<0.01),(r=0.753, 0.697, 0.685,0.726,均P<0.01)]。
2.4 利用ROC曲线评价两标志物的价值 以治疗前组和治疗后组eNOSmRNA和TRB3mRNA的表达为因变量分析显示,两标志物的AUC分别为[0.858(95%CI:0.756~0.960,P<0.01),0.862(95%CI:0.753~0.970,P<0.01)]。eNOSmRNA和TRB3mRNA在最佳临界值处评价IGT患者治疗效果的敏感度和特异度分别为80.3%和87.5%;81.3%和90.2%。提示血清eNOSmRNA和TRB3mRNA对评价生活方式干预IGT的疗效监测有诊断意义。见图3。

图3 eNOSmRNA和TRB3mRNA的ROC曲线
3 讨论
胰岛素抵抗被定义为外周组织(骨骼肌和脂肪)对胰岛素效应的敏感性降低。最近的研究证明胰岛素抵抗可能参与糖代谢异常的发生和发展过程。在糖代谢异常的早期阶段,胰岛素抵抗促进胰岛素的分泌[5]。这种效应导致胰岛β细胞发生慢性过载并呈现过度增殖,长期的作用会引起β细胞功能减退,导致胰岛素的分泌不足进而出现血糖水平升高。这种状况使IGT或糖尿病的发生最终变为显性[5]。Lutz等[6]认为IGT患者伴随着温和的血浆葡萄糖水平增加,反映了患者糖代谢呈现受损的状态。IGT患者糖代谢异常被认为可能是患者长期暴露于胰岛素抵抗而导致的结果[7]。本研究结果显示IGT患者的BMI,FPG,FINs,HbA1c及HOMA-IR与对照组比较显著增高(P<0.05或0.01)。这些结果印证了上述的IGT患者糖代谢的异常状态。一氧化氮是由一氧化氮合酶(NOS)产生的气体。NOS包括神经型(nNOS)、内皮型(eNOS)和诱导型(iNOS),这三种亚型在骨骼肌组织均有表达,eNOS主要分布在血管内皮细胞中。研究认为NO对骨骼肌胰岛素的敏感度以及葡萄糖的摄取利用具有重要的调节作用[8]。Feng等[9]分析108例IGT患者的研究结果发现胰岛素抵抗主要起始于血管内皮。他们认为eNOS功能障碍引起NO合成减少导致微循环血流量减少,从而降低胰岛素对敏感组织的输送。Hasegawa等[10]研究发现eNOS -//-小鼠(eNOS基因敲除小鼠)组织中胰岛素介导的葡萄糖摄取已被抑制。进一步的研究显示eNOS功能的恢复可以降低胰岛素抵抗,增加组织对葡萄糖的利用。这些过程的作用机制可能与PI3K/AKT信号通路有关,该通路的抑制可能促进胰岛素的发生[3],降低循环eNOS活性,进而影响NO的浓度,抑制胰岛素介导的血管舒张,降低循环血流量,最终导致骨骼肌和脂肪组织对葡萄糖的摄取减少以及血糖浓度升高[11]。另外的研究通过分析糖尿病大鼠模型的结果显示有氧运动与抗阻力运动能刺激PI3K通路的磷酸化导致NO和eNOS浓度的增加,改善血管内皮功能从而促进糖尿病大鼠血管的舒张功能。这些过程最终导致大鼠的血糖和血脂水平降低以及胰岛素抵抗改善[12]。提示血管内皮功能的改善可能增加eNOS的活性,增强组织对胰岛素的敏感度,改善胰岛素抵抗的效应[13]。本研究结果显示IGT患者生活方式干预前循环eNOSmRNA表达显著低于干预后组(P<0.01),推测IGT患者可能存在血管内皮功能的损伤,进而影响组织对胰岛素的敏感度,并且促进胰岛素抵抗的发生。进一步地研究显示治疗后组eNOSmRNA表达仍然低于对照组,提示IGT患者血管内皮的损伤未能完全恢复。尽管如此,治疗前后循环eNOSmRNA的差异表达显示生活方式干预可以有效地改善胰岛素抵抗,修复受损的糖耐量。
Tribbles蛋白是最早在果蝇体内被发现的哺乳动物同源蛋白,其被发现可能参与PKB/AKT信号通路中的AKT磷酸化激活过程。TRB3作为Tribbles蛋白中的一员,通过直接结合AKT,阻碍AKTthr308,ser473位点的磷酸化,干扰PI3K/AKT信号传导通路,引发葡萄糖转运的减弱,增强IR在胰岛素靶器官的发生[4]。曹梅等[14]通过高糖高脂饮食诱导大鼠建立胰岛素抵抗模型。他们的研究发现模型组中TRB3mRNA以及其蛋白质表达显著增加,而治疗后TRB3mRNA表达则呈现下调。提示TRB3的上调可能影响骨骼肌和脂肪组织对葡萄糖的摄取和利用。研究发现TRB3在应激条件下的表达呈现上调并且介导多个糖尿病及其并发症相关的生物学过程。进一步的研究显示禁食状态下肝细胞中的TRB3表达增加抑制蛋白激酶B(参与PKB/AKT通路)ser473及thr308位点的磷酸化,损伤糖耐量导致血糖升高[3]。董静等[15]认为骨骼肌PKB/AKT磷酸化水平的增强可以下调TRB3的表达,这些过程可通过长期耐力运动来实现。耐力运动被证实可能增加肌细胞对葡萄糖的摄取和利用,降低血糖浓度进而改善胰岛素抵抗。本研究通过对58例IGT患者的分析显示血清TRB3mRNA表达在治疗前明显增高(P<0.01),而治疗后TRB3mRNA表达显著下调,从而印证了生活方式干预治疗IGT的有效性。进一步显示治疗后该标志物表达显著高于对照组,提示生活方式干预治疗IGT可能是一个持续的漫长过程。生活方式干预治疗被认为是糖尿病最基础的治疗方法。糖尿病患者的高血糖和HbA1c水平可通过长期耐力运动和合理饮食得到有效控制,这些干预措施能减缓糖尿病相关慢性并发症的发生和发展[16-17]。本研究结果显示治疗前后eNOSmRNA和TRB3mRNA的表达具有负相关性,且两标志物的表达分别与FPG,FINs,HbA1c水平及HOMA-IR也具有显著相关性(P<0.01)。推测两标志物与IGT的发生和发展密切相关,其差异性的表达可以反映IGT治疗后患者糖代谢的改善状况。ROC曲线的分析结果显示,血清eNOSmRNA和TRB3mRNA对IGT患者生活方式干预治疗的疗效监测有诊断意义,并显示出良好的敏感度和特异度。综上所述,血清eNOSmRNA和TRB3mRNA的检测可应用于评价生活方式干预治疗IGT的效果,并可能为IGT及2型糖尿病的治疗提供有效的基因学依据。

