急性髓系白血病患者外周血粒细胞、单核细胞膜GPI锚链和红细胞表面CD59表达水平的研究*
范臻佳,金丽兰,史 册,刘 禹,蔡 刚
(上海交通大学医学院附属瑞金医院检验科,上海 200025)
急性髓系白血病(acute myelocytic leukemia,AML)是克隆性造血干细胞疾病的一类,是髓系造血干/祖细胞的恶性疾病。以骨髓和外周血中原始和幼稚的髓性细胞增生为主要特征,临床表现为贫血、出血、感染、发热、脏器浸润和代谢异常等,发病早期部分症状与阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria,PNH)的部分临床表现较为相似,特别是血管内溶血的相关表现[1]。这可能与AML患者外周和骨髓异常血细胞缺乏相关膜锚链蛋白有关。众所周知,PNH是以膜锚链蛋白CD55和CD59缺乏致血管内溶血为主要病理特征,其本质是造血干细胞的GPI锚链合成障碍,导致包括CD55和CD59在内的多种血细胞膜锚链蛋白缺乏。目前已有一些证据表明AML患者外周异常血细胞也存在CD59等相关膜锚链蛋白缺乏,但其是否也存在GPI链的缺乏,以及其表现是否与典型PNH相同,尚不清楚。嗜水气单胞菌溶素变异体(fluorescent-labeled aerophilic plasminogen,FLAER)是一种可与GPI锚链特异性结合的物质[2],目前,通过流式细胞术采用荧光标记的FLAER及膜锚链蛋白的单克隆抗体检测GPI锚链及其锚定蛋白的缺乏是国际临床流式细胞协会(international clinical cytometry society,ICCS)和欧洲临床细胞分析学会(european society for clinical cell analysis,ESSCA)推荐的对患者粒细胞和单核细胞进行PNH克隆诊断的确诊方法[3]。ICCS/ESSCA也同时推荐检测红细胞表面CD59的表达水平,判断其是否存在CD59部分缺陷(II型细胞)或完全缺陷(III型细胞)的细胞[4,5]。通过有核细胞与红细胞共同确定患者是否存在PNH克隆。
基于ICCS/ESSCA推荐的PNH检测方法,我们拟在本研究中,采用流式细胞术对不同类型的AML患者进行外周血红细胞CD59和有核细胞FLAER检测,同时以确诊的PNH患者作为对照,分析AML患者是否存在FLAER阴性的类PNH克隆及其特点。
1 材料和方法
1.1 研究对象 收集瑞金医院2014年~2018年门诊和住院患者57例,确诊为PNH患者21例(其中伴有再生障碍性贫血的5例,男性8例,女性13例);AML患者36例(其中M2 3例,M3 21例,M4 5例,M5 7例;男性17例,女性19例)。
1.2 仪器和试剂 美国BD公司CantoII流式细胞仪,anti-CD59- FITC,FLAER-ALEXA488,anti-CD33- APC,anti-CD14- Pacific Blue,anti-CD24- PE,anti-CD45-PC5等荧光标记流式抗体及溶血素等均购自BD Pharmingen。
1.3 方法
1.3.1 外周血粒细胞和单核细胞FLAER检测 根据ICCS/ESSCA指南,基于CantoII平台,采用五色流式细胞术检测。避光孵育30 min后加入溶血素裂红,完全溶血后加入PBS洗涤细胞,并上机检测,从而得到目的细胞亚群的百分数。正常参考范围:CD24-FLAER-细胞/CD45+粒细胞<1%,CD14-FLAER-细胞/CD33+单核细胞<1%。
1.3.2 外周血红细胞CD59检测:根据ICCS/ESSCA指南,基于CantoII平台,采用单色流式细胞术检测。将荧光素标记的各种单克隆抗体加入到洗涤红细胞中,与细胞膜上相应的抗原结合,孵育后再次洗涤、重悬等步骤后,在流式细胞仪上进行分析,从而得到表达缺陷细胞的百分数。正常参考范围:II型细胞和III型细胞比率均<1%。

2 结果
2.1 红细胞CD59的表达水平 见图1。AML组患者未检出明显的CD59表达缺陷的细胞,PNH组患者进行检测后CD59抗原表达出现不同程度缺失,AML组患者检测结果与PNH组相比,各型红细胞比例差异均有统计学意义(t=3.41~6.43,均P<0.001)。
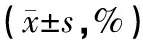
表1 AML组和PNH组外周血细胞抗原缺失率

图1 健康对照、AML及PNH患者红细胞CD59流式比较
2.2 粒系和单核系 见图2。AML组患者和PNH组患者进行检测后粒细胞和单核细胞均出现了GPI双阴性的缺失细胞。但AML组患者的缺失细胞的克隆比例与PNH组患者相比,差异具有统计学意义,结果见表1。同时,可在AML患者中检出不同数量的FLAER单阳性细胞,例如CD24-FLAER+的粒细胞和CD14-FLAER+单核细胞。

图2 健康对照、AML及PNH患者粒细胞、单核细胞FLAER流式比较
3 讨论
由于白血病细胞具有“异质性”和“非同步性”,常伴有抗原表达紊乱现象[6],并且其分化发育各个阶段出现了不规律和调节紊乱,从而导致其膜抗原的表达异常[7]。既往已有研究发现,部分AML患者常伴有粒、单细胞的CD55或CD59缺陷,可能是导致这些患者并发血管内溶血的重要原因。众所周知,CD55和CD59是保护细胞免受异常补体激活杀伤的重要膜锚链蛋白[8]。AML患者这些CD55或CD59缺陷的细胞究竟是仅为膜锚链蛋白缺乏,还是也涉及糖基磷脂酰肌醇(glycosyl-phosphatidyl inositol,GPI)锚链的合成障碍,尚不完全清楚。由于GPI锚链合成障碍会导致包括CD55和CD59在内的多种膜锚链蛋白缺乏,可能对AML患者血细胞的多种生物学功能产生影响。
在本研究中,我们的结果清晰的显示,尽管AML患者粒细胞、单核细胞检出的典型PNH克隆明显小于PNH患者,但勿庸质疑的是多种类型的AML病患都存在GPI膜锚链的合成障碍和/或锚链蛋白的缺失,不仅有典型的粒细胞、单核细胞PNH克隆出现,同时还存在不同数量的FLAER单阳性细胞,表明这些恶性干、祖细胞的相关抗原表达或蛋白合成明显紊乱,这也与既往文献报道AML患者粒细胞表面存在CD59表达异常的发现相一致[9]。值得注意的是,部分M3和M5患者均不仅有恶性细胞系的GPI锚链合成障碍,而且也存在其它有核细胞系的GPI锚链合成障碍,提示这部分患者骨髓的异常改变可能发生在造血细胞更原始的阶段。但是,我们在纳入的AML患者中未检出明显异常的CD59缺陷克隆,一方面间接提示了AML患者粒细胞、单核细胞的恶性改变未在DNA水平明显影响红系细胞的发展;另一方面,这也有助于鉴别诊断AML患者是否伴有PNH,因为典型的PNH患者都有明显的CD59缺陷的II型和/或III型细胞,表现为红系及有核细胞系的多系造血细胞GPI锚链合成障碍[10]。由于本研究中未纳入红白血病患者,因此未能对该类型患者的红系及有核细胞系进行评估,观察这类病人是否会同时出现红系和粒细胞、单核细胞系的GPI锚链合成障碍,这需要在下次研究中予以澄清。
通过本项研究,我们了解到粒细胞、单核细胞等有核细胞系GPI锚链合成障碍在AML患者中是一种常见现象,尽管检测到的锚链缺陷克隆小于典型PNH患者。由于GPI锚链具有重要的生物学意义,因此,其缺陷对AML等疾病的病理生理有何影响值得深入地进行研究;同时也表明,对AML患者检测粒细胞、单核细胞的GPI锚链水平对于判断病情及评估预后可能具有重要的临床意义。

