铁(Ⅲ)席夫碱配合物的合成及其对新型环境污染物酞酸丁酯的降解性能
叶夏珺,翁乐仪,汪雨霏,蒋 琦,沈昊宇,胡美琴
(浙江大学 宁波理工学院,浙江宁波 315100)
新兴污染物(emerging contaminants,ECs)是指由于分析检测技术的提高在近期被检出或者发现新的具有生物毒性的化学污染物[1-3]。ECs在环境中的存在质量浓度通常只有mg/L到ng/L数量级,由于其具有内分泌干扰等特性,会破坏环境并影响人类健康,如:增加抗药微生物种类和数量、干扰生物体的生殖发育和激素分泌与代谢、增加致癌风险等[4]。酞酸酯类化合物(phthalic acid esters,PAEs)是农药、塑化剂等常用的合成原料和溶剂等,是典型的环境激素和ECs[5]。近年来PAEs在环境中残留,甚至在食品中的污染日益严重。样品中检出浓度最高的两种PAEs是酞酸丁酯(DBP)和酞酸二(2-乙基己基)酯(DEHP)[6]。如何高效去除环境中的PAEs是现今环保领域面临的一重大难点。
目前去除PAEs的最有效的方法为化学氧化法和光降解法[7-8],其中Fenton氧化技术由于具有操作方便、成本低廉等优势,具有广泛的应用[9-11]。但此技术存在一定的缺陷,如对双氧水的利用率低下、降解需要在强酸性(pH<3)条件下进行,以及会对环境造成二次污染,因此研究者们一直致力于Fenton体系的改进,如:UV/Fenton法、UV/H2O2法和电/Fenton法等[12-15]。其中以Fe3+过渡金属络合物代替传统Fe2+-H2O2的类Fenton体系较普通Fenton氧化法具有污泥少、H2O2利用率高等优点,在克服溶液pH要求苛刻缺陷的同时,还表现出部分仿生反应的特性[16]。
笔者设计合成并表征了一种新型双核铁(Ⅲ)席夫碱配合物[Fe2(ST)(H2O)4]Cl4[简写为Fe2(ST)],将其用于DBP的催化降解,通过考察溶液pH,体系中H2O2浓度、Fe2(ST)浓度和DBP初始浓度等影响因素,初步研讨了降解机制。
1 实验部分
1.1 试剂与仪器
水杨醛(SA)、四乙烯五胺(TEPA)、甲醇、乙腈、三氯化铁(FeCl3·7H2O)、醋酸钠(NaAc)、酞酸丁酯(DBP)、硝酸银(AgNO3),都是分析纯试剂,均购自国药集团化学试剂有限公司;实验用水为双重去离子水,电阻为16 MΩ;色谱分析用甲醇,购自Merck试剂有限公司,色谱纯;其他试剂和溶剂均为分析纯。
紫外可见分光光度计(UV-Vis,SP752PC型),购自上海光谱仪器厂;傅里叶变换红外光谱仪(NEXUS-470)测定红外光谱,经KBr固体压片,扫描范围:400~4000/cm,购自美国热电尼高力仪器公司;电导率仪(DDS-307型),购自上海精密科学仪器有限公司;NETZSCH,TG209F1热重差热分析仪,升温速率20℃/min,吹扫气为高纯N2,流速为20 mL/min;液相色谱仪(HPLC);P230 II高压恒流泵;P230紫外检测器;购自安捷伦科技(中国)有限公司;C8柱购自大连伊利特公司。
1.2 双核铁(Ⅲ)配合物[Fe2(ST)]的合成
将水杨醛(SA,0.4 mmol,48.8 mg)和四乙烯五胺(TEPA,0.2 mmol,37.9 mg)分别溶于10 mL甲醇中,60℃回流2 h,冷却后即得配体ST,过滤,用少量水和甲醇洗涤,并在真空下干燥,产率为96.5%;称取FeCl3·6H2O(0.2 mmol,54.6 mg)和配体ST(0.1 mmol,35.2 mg),分别溶于10 mL甲醇溶液中,搅拌后滴加0.1 mol/L的NaAc调节pH为8~9,60℃,回流2 h,经冷却,静置于室温下24 h,得褐色微晶状产物,过滤,少量水和乙醇洗涤后,真空干燥,产率为89.6%。具体的合成过程如图1所示。
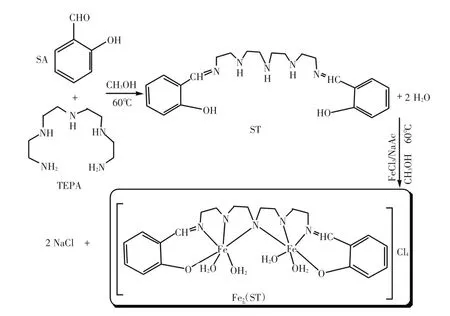
图1 Fe2(ST)的合成示意图Fig.1The synthesis diagram of Fe2(ST)
1.3 Fe2(ST)对DBP催化降解活性评价
量取25 mL浓度为20 mg/L的DBP 5%乙腈水溶液,测得溶液pH为6.0,加入40 mL 4.0 mg/L Fe2(ST)乙腈溶液,20 mL 30%的H2O2溶液,150 r/min,35℃的恒温摇床中振荡加速反应,每隔1 min取样1次,在样品中滴加1滴10%Na2SO3以达到中止自由基(·OH,·OOH)与DBP进一步反应的目的。传统的Fenton体系对照实验条件与之类似,仅将DBP溶液pH调节至3.0,并将4.0 mg/L Fe2(ST)乙腈溶液替换为 4.0 mg/L(NH4)2Fe(SO4)2乙腈溶液,其余条件相同,进行对比。用HPLC测定样品中DBP的剩余浓度,HPLC实验条件:C8柱,流动相为甲醇∶水=70∶30,流速为1 mL/min,波长为230 nm。设定不含DBP样品为空白样品,由公式(1)计算降解率。

式中:A0为时间t0时的初始DBP的HPLC峰面积;At为时间为t时扣去空白组的DBP的HPLC峰面积;D为降解率。
采用单一变量法考察溶液初始pH、H2O2用量、Fe2(ST)初始浓度、DBP初始浓度等对DBP降解的影响。
2 结果与讨论
2.1 Fe2(ST)的表征
Fe2(ST)经元素分析得到实验值(理论计算值),其中C∶36.58%(36.65%),H∶5.25%(5.17%),O∶13.52%(13.31%),N∶9.52%(9.71%),Fe∶15.22%(15.49%)。以乙腈为溶剂测定Fe2(ST)的电导率,发现Fe2(ST)为1∶4型电解质[17]。以AgNO3溶液滴定 Fe2(ST)乙腈溶液测定 Cl-浓度,实验值和理论计算值分别为19.96%和19.67%。TG/DTG表明Fe2(ST)在~120℃有10.2%的失重,相当于4个水分子(理论值:9.99%);结合其电导率的测定以及Cl-含量测定结果,推测Fe2(ST)中4个水分子处于配合物的内界,以配位键与Fe(Ⅲ)相联;4个Cl-均处于配合物的外界。
图2(a)为ST和Fe2(ST)的紫外可见光谱。可知,252 nm处出现了ST中的苯环的π-π*跃迁的特征峰;而315 nm的吸收峰则可归属为亚胺基n-π*跃迁的特征吸收峰;形成Fe2(ST)配合物后,这两个吸收峰分别红移至260 nm和325 nm,并在325 nm处吸收峰有明显展宽,可归属为Fe2(ST)中px(N)→dxz(Fe)的荷移光谱;同时512 nm处观察到Fe(Ⅲ)的d-d跃迁吸收峰;图2(b)所示为ST和Fe2(ST)的红外吸收光谱,其中1 642/cm对应于ST中的亚胺的特征峰;1 585/cm归属为氨基的特征峰;形成Fe2(ST)配合物后,亚胺的吸收峰从1 642/cm红移至1 635/cm;氨基的吸收峰从1 585/cm红移至1 445/cm并伴有展宽;620/cm新的吸收峰可以归属为Fe-N键的特征吸收峰;525/cm新的吸收峰则可以归属Fe-O键的特征吸收峰[18]。
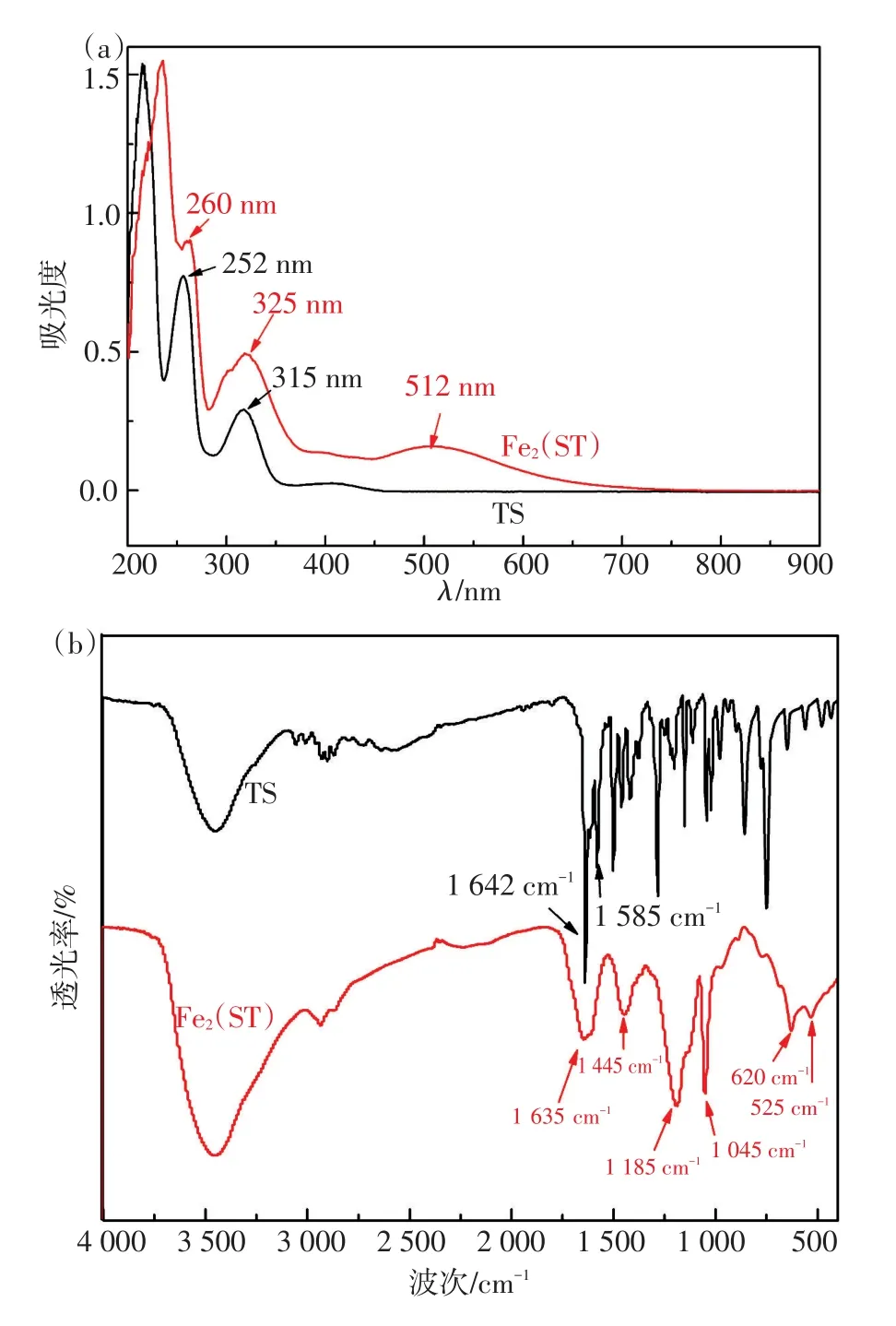
图2 ST(a)和Fe2(ST)(b)的UV和FTIR光谱Fig.2 UV and FTIR spectra of ST(a)and Fe2(ST)(b)
2.2 Fe2(ST)对DBP降解性能
Fe2(ST)在H2O2/可见光体系中对DBP的降解性能如图3(a)所示,随着反应时间的增加,DBP的降解率从刚开始的75.6%在10 min内增加至99.8%。传统的Fenton体系实验结果如图3(b)所示,随着反应时间的增加,DBP的降解率从刚开始的30.2%在8 min内迅速降低到0.5%以下,这是由于传统的Fenton体系双氧水的利用率低,产生的·OH容易失活。可见Fe2(ST)/H2O2/可见光体系对DPB较传统的Fenton体系有更高的催化降解性能。我们推测,可见光条件下高的催化降解效率可能与Fe2(ST)存在μ-N桥联的双核Fe(Ⅲ)中心有关。这与我们之前发现的μ-H2O桥联Fe(Ⅲ)/H2O2/可见光体系对DBP的降解结果[9]相似。
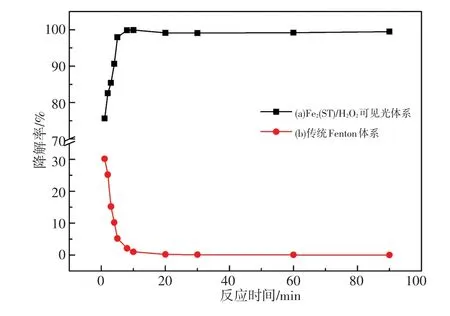
图3 两种体系对DBP的降解性能的比较Fig.3 Comparison of degradation extent of DBP under two systems
DBP溶液在加入Fe2(ST)/H2O2前后的不同时间的电子光谱如图4所示。随着H2O2的加入以及时间推移(c,0 min;d,1 min;e,5 min;f,10 min),Fe2(ST)在~325 nm的氮原子到铁原子轨道[px(N)→dxz(Fe)]的电荷转移光谱特征峰强度逐渐增强,并出现峰的展宽,由此推测催化过程形成了图5所示的μ-N桥联的双核Fe(III)-H2O2过渡态[18-19],该中心的形成有利于H2O2的活化,使得·OH可以在可见光条件下产生;而DBP在230 nm和275 nm处的特征吸收峰均消失,说明该体系对DBP具有显著的降解作用。
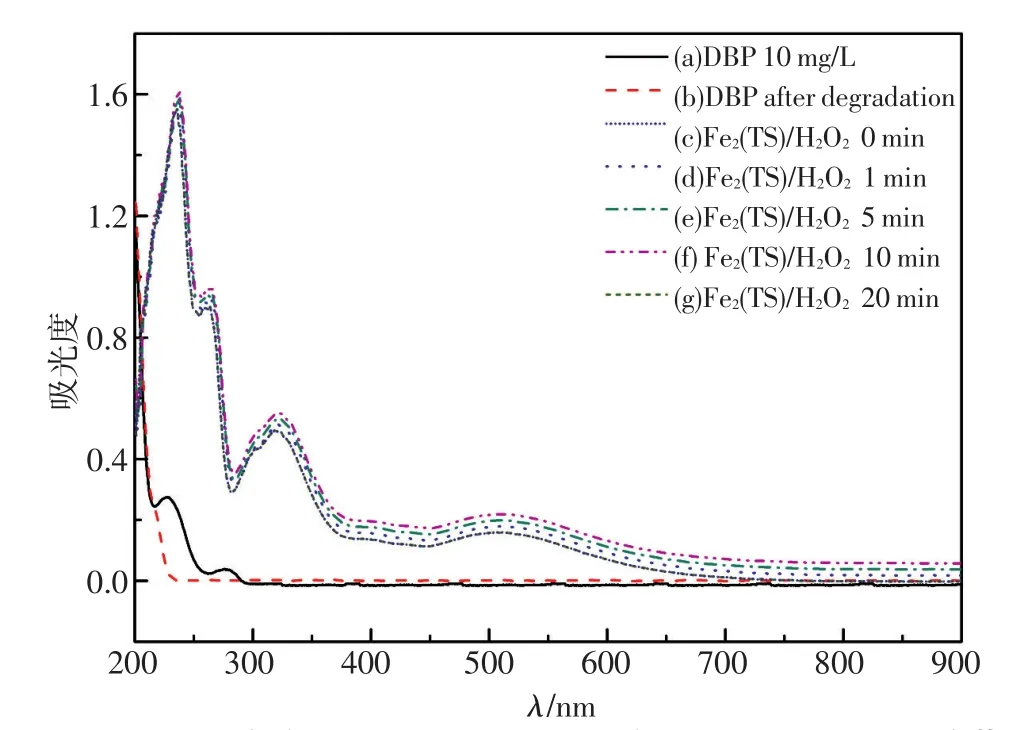
图4 DBP溶液加入Fe2(ST)/H2O2前(a)后(b)不同时间的紫外扫描图谱Fig.4 UV spectra of DBP before(a)and after(b)adding Fe2(ST)/H2O2at different reaction times
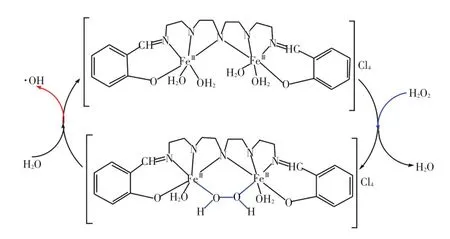
图5 μ-N桥联双核Fe(Ⅲ)-H2O2过渡态与·OH自由基可能的生成机制Fig.5 Presumed mechanism of μ-N bridged binuclear Fe(Ⅲ)-H2O2transition-state and production of· OH
2.3 溶液初始pH对催化降解性能的影响
配制一系列浓度为20 mg/L的DBP溶液,分别用0.1 mol/L的HCl以及NaOH溶液调节pH至3.0~9.0,检测了溶液pH对催化降解效果的影响,结果见图6。在pH为3.5~8.0(插图放大部分)时,DBP在Fe2(ST)/H2O2/可见光催化体系的作用下均能在10 min内近100%降解。PAEs溶液的pH为6.0,故可以无需调节溶液pH对其进行催化降解实验。催化体系较传统Fenton反应体系有更宽的pH适用范围[20]的原因可能在于Fe(Ⅲ)通过μ-N-桥联与ST配体以配位键结合有利于提高Fe(Ⅲ)的化学存在形态对溶液pH的耐受性,从而减弱了溶液pH变化对DBP降解效率的影响。
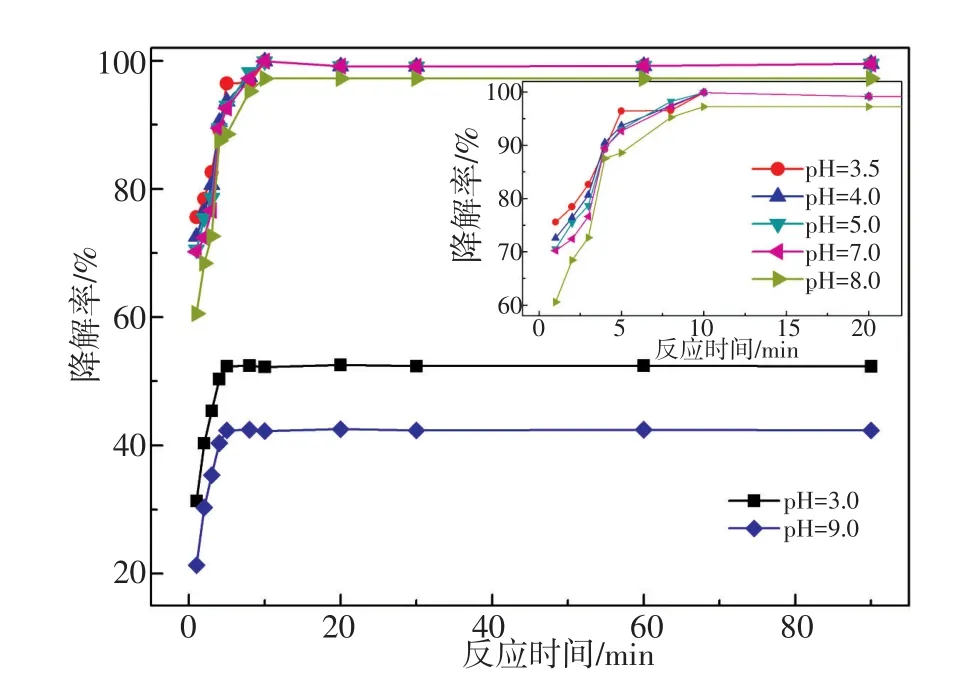
图6 溶液pH对Fe2(ST)/H2O2/DBP催化降解体系的影响(插图:pH=3.5~8.0放大部分)Fig.6Effect of the solution pH on the Fe2(ST)/H2O2/DBP catalytic degradation system(insert:pH=3.5~8.0 enlarged)
2.4 H2O2用量对催化降解性能的影响
配制一系列20 mg/L DBP溶液,分别加入5~100 μL 30%H2O2,使得催化体系中H2O2的浓度为2.0~40.8 mmol/L,得出H2O2用量对催化降解效果的影响如图7所示。当体系中H2O2用量为2.0 mmol/L时,DBP需近45 min才能降解完全;而当H2O2在体系中的浓度达到4.1 mmol/L后,DBP在30 min以内完全降解,说明Fe2(ST)对DBP的催化降解速率会随着H2O2用量的增加而略加快,H2O2在体系的浓度超过8.2 mmol/L可以实现10 min内将DBP降解完全[21-22]。
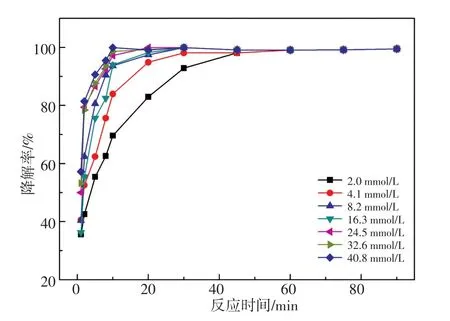
图7 H2O2用量对Fe2(ST)/H2O2/DBP催化降解体系的影响Fig.7 Effect of the usage amount of H2O2on the Fe2(ST)/H2O2/DBP catalytic degradation system
2.5 Fe2(ST)初始浓度对催化降解性能的影响
配制一系列20 mg/L DBP溶液,加入20 mL 30%H2O2,分别加入50~500 mL浓度为400 mg/L的Fe2(ST)乙腈溶液使得Fe2(ST)在催化体系中的浓度为1.1~11.0 mmol/L,考察Fe2(ST)用量对催化降解效果的影响,结果如图8所示。可知,Fe2(ST)是催化H2O2产生自由基的重要条件。当Fe2(ST)的初始浓度过低时,·OH的产生量和产生速率都很低,氧化降解过程进行缓慢;当Fe2(ST)的初始浓度逐渐增大,Fe2(ST)引发反应的速度随之加快,DBP降解率增大。当Fe2(ST)的初始浓度到达5.5 mmol/L后降解速率逐渐趋于稳定。
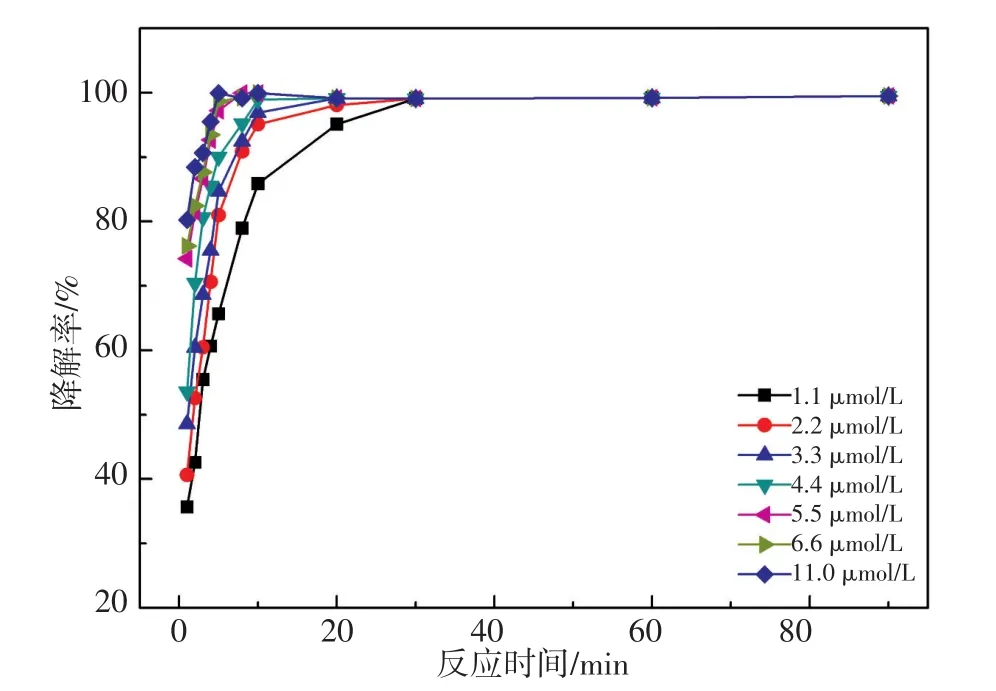
图8 Fe2(ST)用量对Fe2(ST)/H2O2/DBP催化降解体系的影响Fig.8 Effect of the usage amount of Fe2(ST)on the Fe2(ST)/H2O2/DBP catalytic degradation system
2.6 DBP初始浓度对催化降解性能的影响
配制一系列4~80 mg/L的DBP溶液(体系中DBP的浓度为14.4~287.8 mmol/L),加入20 mL 30%H2O2令体系中H2O2浓度为8.2 mmol/L,分别加入250 mL浓度为400 mg/L的Fe2(ST)乙腈溶液,令体系中Fe2(ST)浓度为5.5 mmol/L,考察DBP初始浓度对催化降解效果的影响,结果如图9所示。由此可知当体系中DBP浓度小于71.6 mmol/L(20 mg/L)时,10 min内可完全降解。环境中DBP残留浓度一般为μg/L到mg/L级,该体系可以用于处理环境中的DBP[23]。
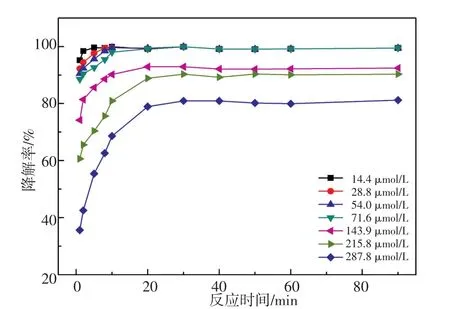
图9 DBP初始浓度对Fe2(ST)/H2O2/DBP催化降解体系的影响Fig.9 Effect of the initial concentration of DBP on the Fe2(ST)/H2O2/DBP catalytic degradation system
2.7 Fe2(ST)的循环使用
采用2种方法分别考察Fe2(ST)的循环使用情况。方法1:收集DBP初始浓度为20 mg/L,体系中 H2O2浓度为 8.2 mmol/L,Fe2(ST)浓度为5.5 mmol/L的经过降解的溶液,旋转蒸发至近干后再次添加初始浓度为20 mg/L的DBP溶液25 mL;方法2:直接在上述收集的经过降解的溶液中补加浓度为1 000 mg/L DBP 500 mL,使之浓度达到20 mg/L,并补充20 mL的30%H2O2。结果分别如图10(a)和(b)所示。结果表明无论采用上述哪种方式,Fe2(ST)在10次循环使用后对DBP的降解率仍可达到95%以上,是一种性能优良的催化剂。
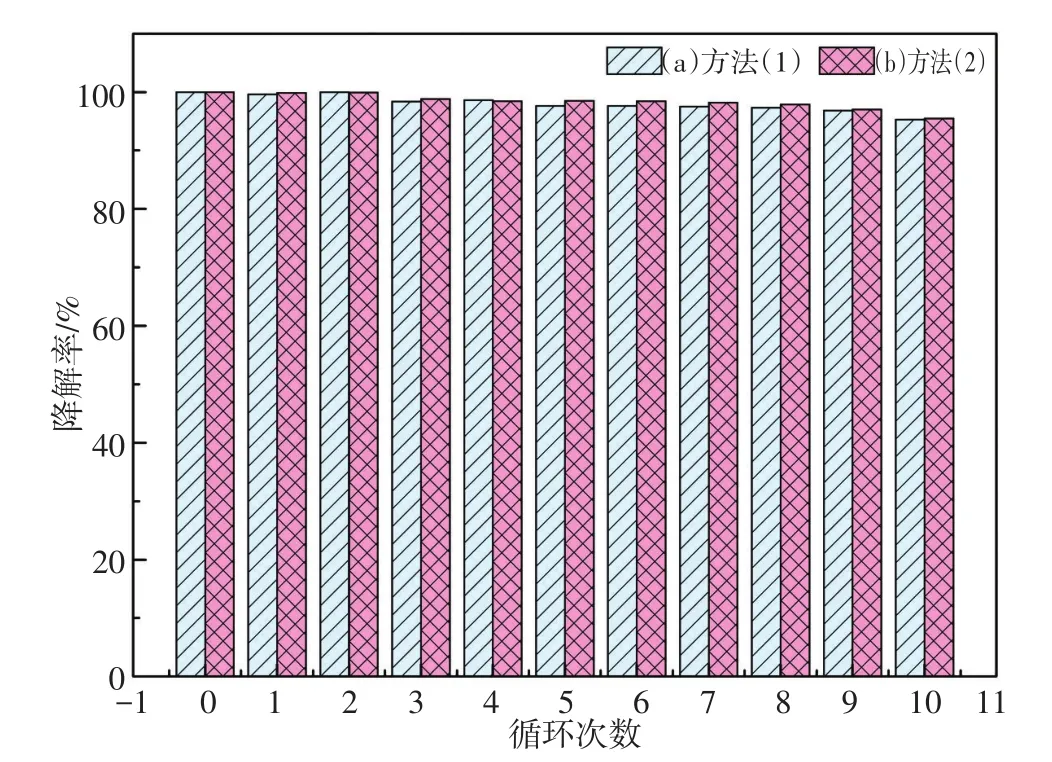
图10 Fe2(ST)催化剂循环利用效果对比Fig.10 Comparison on recycling of the Fe2(ST)catalys
3 结论
笔者合成并采用EA,TG/DTG,电导率,UV/Vis和FTIR等方法表征了双核铁(Ⅲ)配合物[Fe2(Ⅲ)]。以之为催化剂,采用类Fenton反应将其应用于新型污染物DBP的降解。发现在可见光条件下,在pH 3.5~8.0 范围内,Fe2(ST)/H2O2体系便可实现DBP的催化降解。Fe2(ST)的浓度大于5.5 mmol/L,H2O2的浓度小于8.2 mmol/L,DBP的浓度小于20 mg/L降解率可达99%以上;而传统的Fenton反应体系,双氧水的利用率低,降解需要在强酸性(pH<3)条件下进行,相似条件下对DBP降解率仅达30%左右,且10 min内便很快失活。通过电子光谱监测发现其催化过程中可能形成了μ-N双核Fe(Ⅲ)-H2O2过渡态。经10次循环使用后对DBP的降解率仍可保持95%以上,可见,Fe2(ST)是性能优良的催化剂。

