苏木乙酸乙酯对急性冠脉综合征外周血CD4+T淋巴细胞增殖及Th17/Treg平衡的影响*
李鑫峰 周亚滨 王 倩 杨建飞△
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江哈尔滨 150040;3.南京中医药大学附属盐城市中医院,江苏 盐城 224000)
急性冠脉综合征(ACS)是由冠状动脉中不稳定性的斑块破裂、糜烂或出血后诱发冠状动脉内血栓形成,从而引起的一系列急性、重症心肌缺血综合征[1]。根据其临床类型可分为不稳定型心绞痛(UAP)、非ST段抬高型心肌梗死(NSTEMI)和 ST段抬高型心肌梗死(STEMI)。与以往的研究不同,目前认为动脉粥样硬化是一类免疫炎症性疾病,大量的炎性细胞和炎症介质参与从脂质斑块到粥样斑块的整个过程,而且炎症反应是引起斑块不稳定性的重要因素之一[2]。
笔者前期研究发现,苏木乙酸乙酯提取液(SAEE)能够显著降低大鼠血清单核细胞趋化蛋白1、重组人巨噬细胞炎症蛋白-1β及超敏C反应蛋白(hs-CRP)的水平,从而起到抗动脉粥样硬化的作用[3-5]。同时,SAEE还能够调控血清T淋巴细胞亚群及细胞因子的水平,从而发挥免疫调节和抗炎的作用[6-7]。研究发现,CD4+T淋巴细胞亚群的失衡在动脉粥样硬化炎症调控机制方面发挥着重要的作用,同时,CD4+CD25+Fox3p+调节性T细胞能够通过抑制低密度脂蛋白诱导的细胞活化,从而改善动脉粥样硬化[8]。因此,本课题通过检测外周血CD4+T淋巴细胞的增殖,白细胞介素-17A(IL-17A)、叉头翼状螺旋转录因子 3(Foxp3)的表达及Th17/Treg的比值,并以ACS和稳定型心绞痛(SAP)作为对照,进一步探讨SAEE的抗动脉粥样硬化的作用机制。现报告如下。
1 资料与方法
1.1 病例选择 1)诊断标准。ACS诊断参照2014年美国心脏协会和美国心脏病学会发布的《非ST段抬高型急性冠脉综合征患者管理指南》[9]和2012年欧洲心脏病学会发布的 《ST段抬高型心肌梗死管理指南》[10]中相关标准和分型标准。SAP诊断参照2007年中华医学会心血管病分会发布的 《慢性稳定型心绞痛诊断与治疗指南》[11]。2)纳入标准:符合上述标准;经医院医学伦理委员会批准;知情同意并签署知情书。3)排除标准:同时伴有急性期脑卒中的患者;合并严重的肝、肾及恶性肿瘤的患者;妊娠及哺乳期女性患者;近期服用免疫抑制剂或类固醇类药物者。
1.2 临床资料 选取笔者所在医院心内二科2017年1月至2018年3月收治的ACS患者30例 (包括UAP16例,NSTEMI 5例,STEMI 9例),同时选取 10例SAP患者作为阴性对照组。两组患者临床资料比较,差异无统计学意义(P>0.05)。见表1。
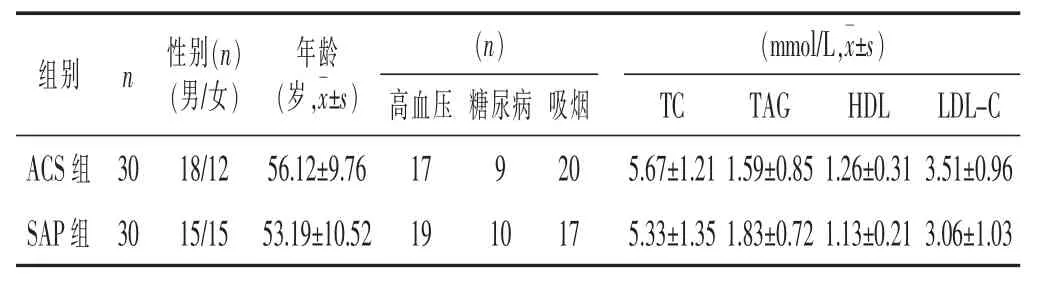
表1 两组临床资料比较
1.3 MTT比色法检测CD4+T淋巴细胞的增殖 两组患者均于禁食12 h后抽取空腹静脉血9 mL,肝素抗凝,以备检测。采用淋巴细胞分离液分离外周血单个核细胞,免疫磁珠法分离CD4+T淋巴细胞,重悬于10%小牛血清的1640培养液中,接种于培养板,设立SAP组、ACS 组、ACS+SAEE 低剂量组(40 mmol/L)和 ACS+SAEE高剂量组(80 mmol/L)。加入CD3单克隆抗体,培养4 d后,酶标仪测定各组在570 nm处的OD值。1.4 流式细胞术检测外周血Th17及Treg的表达采用淋巴细胞分离液分离外周血单个核细胞,用10%小牛血清的1640培养基制备单细胞悬液,接种于培养板,设立SAP组、ACS组、ACS+SAEE低剂量组(40 mmol/L)和 ACS+SAEE 高剂量组(80 mmol/L)共培养1 h。 37℃、5%CO2孵育6 h,PBS洗涤,加入FITCCD4抗体1 μL避光孵育60 min,加入Foxp3检测打孔、固定浓缩液1 mL避光孵育1 h。加入IL-17A抗体和Foxp3抗体,流式细胞仪检测IL-17A和Foxp3的百分比含量。
1.5 RT-PCR检测IL-17A mRNA和Foxp3 mRNA的表达 采用淋巴细胞分离液分离外周血单个核细胞,用10%小牛血清的1640培养基制备单细胞悬液,接种于培养板,设立SAP组、ACS组、ACS+SAEE低剂量组(40 mmol/L)和 ACS+SAEE 高剂量组(80 mmol/L)共培养1 h。Trizol一步法提取总RNA,反转录合成cDNA,IL-17A 上游引物:5′-GCCTTCAAGACTGAACACCG-3′。 下游引物:5′-TGACATGCCATTCCTCAGGG-3′。Foxp3 上 游 引 物 :5′-CAGGAGAAAGCGGATACCA AATG-3′。 下游引物:5′-ATCTGTGAGGACTACCGAG CC-3′。 β-actin 上游引物:5′-TGTGATGGTGGGAATG GGTCAGAA-3′。 下游引物 5′-TGTGGTGCCAGATCTT CTCCATGT-3′。建立qPCR反转录体系,SYBR Green I荧光染料技术检测IL-17A mRNA和Foxp3 mRNA的表达,以 β-actin 为内参,以 2-△△CT计算 IL-17A mRNA和Foxp3 mRNA的相对表达量。
1.6 统计学处理 应用SPSS20.0统计软件。计量资料以(x±s)表示,采用单因素方差分析,计数资料以n表示,采用χ2检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 SAEE对CD4+T淋巴细胞的增殖的影响 见表2。 ACS组外周血 CD4+T淋巴细胞 24、48、72、96 h增殖能力较SAP组显著增高(P<0.01);SAEE能显著抑制ACS外周血CD4+T淋巴细胞体外增殖能力(P<0.05和P<0.01),其中以SAEE高剂量组对ACS外周血CD4+T淋巴细胞体外增殖抑制效果最佳。
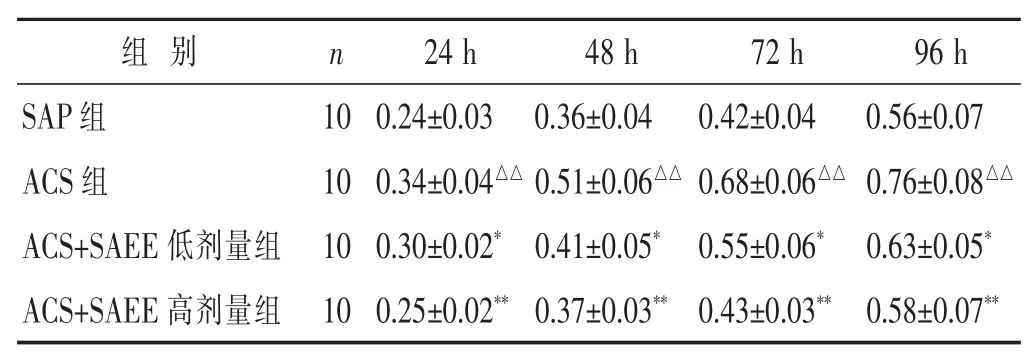
表2 SAEE对CD4+T淋巴细胞的增殖的影响(x±s)
2.2 SAEE对外周血Th17及Treg的表达的影响 见表3。IL-17A是Th17的代表性炎性因子,而Foxp3是Treg细胞因子分泌和细胞分化的关键转录因子,因此本研究中分别以IL-17A和Foxp3代表CD4+T淋巴细胞中Th17和Treg的水平。本研究结果显示,ACS组Th17细胞百分比较SAP组显著增高,Treg细胞百分比显著降低,Th17/Treg比值显著增高(P<0.01);SAEE低剂量和高剂量均能显著降低外周血Th17细胞百分比,升高Treg细胞百分比,降低Th17/Treg的比值,与ACS组比较,差异均具有显著统计学意义(P<0.01)。
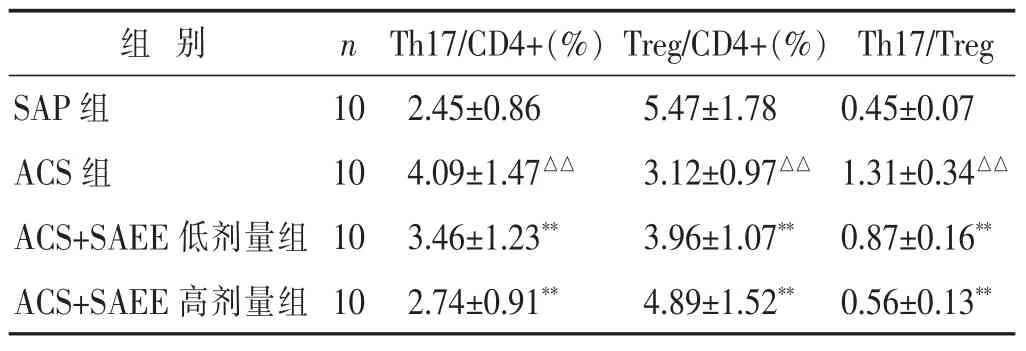
组 别 n Th17/CD4+(%) Treg/CD4+(%) Th17/Treg SAP组 10 ACS组 10 ACS+SAEE低剂量组 10 2.45±0.86 5.47±1.78 0.45±0.07 4.09±1.47△△ 3.12±0.97△△ 1.31±0.34△△3.46±1.23** 3.96±1.07** 0.87±0.16**ACS+SAEE高剂量组 102.74±0.91** 4.89±1.52** 0.56±0.13**
2.3 SAEE对IL-17A mRNA和Foxp3 mRNA表达的影响 见表4。与SAP组比较,ACS组患者IL-17A mRNA表达显著增高,Foxp3 mRNA表达显著降低(P<0.01);SAEE低剂量和高剂量均能显著降低IL-17A mRNA的表达,升高Foxp3 mRNA的表达(P<0.01),其中以SAEE高剂量组效果最佳。

组 别 n IL-17A mRNA Foxp3 mRNA SAP组 10 1.0 1.0 ACS 组 10 2.37±0.89△△ 0.42±0.09△△ACS+SAEE 低剂量组 10 1.76±0.48** 0.69±0.12**ACS+SAEE 高剂量组 10 1.19±0.27** 1.21±0.31**
3 讨 论
心血管疾病已成为当前全球性的公共卫生问题,并且随着生活水平的提高和饮食结构的改变,其发病率呈现逐年增高的趋势。据2014年中国心血管病调查报告显示,我国约有2.9亿心血管疾病的患者,其中心肌梗死患者约为250万,并且每5例死亡的患者中就有1名心血管疾病患者[12]。作为临床上最常见的冠状动脉粥样硬化性心脏病类型之一,ACS是一大类包括不同临床症状、预后和危险因素的临床综合征,具有病死率高和致残率高的特点,严重危害人们的健康和生活质量[13]。据GRACE调查报告显示,ACS患者1年死亡率约为15%,而5年死亡率甚至高达20%[14]。
既往的研究认为,进行性增大的粥样硬化斑块所导致的冠状动脉管腔狭窄、阻塞是心肌缺血的常见原因。但是现在越来越多的证据表明,斑块破裂、氧化应激损伤诱导的内皮细胞功能紊乱、炎症反应、血小板的黏附、聚集和血栓形成是导致ACS的主要病理机制[15]。与稳定斑块不同,不稳定斑块的破裂易发生于富含炎性因子及细胞因子的纤维帽边缘处。在外因的作用下,血流动力学指标发生改变,纤维帽发生破裂,脂核溢出,基质暴露,内皮下黏附分子和血小板发生聚集形成白色血栓,使管腔狭窄或不完全性闭塞,同时激活的血小板释放活性物质,导致血管收缩,最终导致血流减少或中断,造成心脏缺血事件的发生[16]。
近年来研究发现,免疫系统的失调在稳定斑块到不稳定斑块的发生、发展过程中发挥着重要的作用。免疫炎症细胞(尤其是T淋巴细胞和巨噬细胞)的活化,能够加速ACS局部、循环中免疫炎症反应和分泌大量hs-CRP,促使斑块的稳定性的改变甚至破裂[17]。CD4+T淋巴细胞在ACS炎症反应中发挥重要的作用,有动物研究显示CD4+T淋巴细胞能够加速动脉粥样硬化的发生和发展,去除CD4+T淋巴细胞能够有效减轻小鼠动脉硬化损伤[18]。本研究结果显示,ACS组患者CD4+T淋巴细胞增殖能力较SAP组显著增加,而SAEE对ACS患者CD4+T淋巴细胞增殖具有显著的抑制作用,并且以SAEE高剂量抑制作用最佳。Th17作为效应性T淋巴细胞,能够通过分泌IL-17及TNF-α等炎性因子,激活病理性免疫炎症反应,而Treg作为一类负性调控的免疫细胞,具有保持免疫耐受、抑制炎症反应和维持免疫状态平衡的作用,而Th17/Treg比例的失衡能够促进斑块的不稳定性和诱导ACS的发生[19]。本研究结果显示,ACS组Th17细胞百分比较SAP组显著增高,Treg细胞百分比显著降低,Th17/Treg比值显著增高,这与之前的研究结果一致[20]。SAEE能够通过降低外周血Th17细胞百分比,升高Treg细胞百分比,降低Th17/Treg的比值,从而调控ACS患者的免疫炎症反应。IL-17A是新发现的细胞因子,能够加速动脉硬化的发展,Foxp3是Treg最具有特异性的转录因子,对Treg细胞分化、成熟及功能的发挥具有重要的意义[21]。本研究结果发现,SAEE能够降低IL-17A mRNA的表达,升高Foxp3 mRNA的表达,从而拮抗动脉硬化的发展。
综上所述,SAEE能够通过抑制外周血CD4+T淋巴细胞增殖,降低IL-17A的表达,增加Foxp3 mRNA的表达,调控Th17/Treg的平衡,从而达到抑制免疫炎症反应和拮抗动脉硬化的作用。

