曼尼希碱/钨酸钠复配对N80钢缓蚀的协同作用
王 赟,胡 军,王甜甜,郑茂盛
(1 西北大学 化工学院,西安 710069;2 北京科技大学新材料技术研究院,北京 100083;3 陕北能源先进化工利用技术教育部工程研究中心,西安 710069)
在石油工业领域中,钢管的腐蚀是普遍存在的问题,其在酸性生产环境中很容易遭受高活性粒子的侵蚀。盐酸是工业上作为酸洗、化学除垢和油井清洗等常用除去金属表面杂质的溶液[1-2]。由于氯离子的离子半径比较小,活性高,穿透能力强,残留的氯离子会破坏钢材表面形成的钝化膜,增加钢材表面的点蚀坑的数量,造成设备以及管道构件的严重腐蚀,同时可能导致生产受阻或安全事故[3]。在防腐蚀措施中,添加缓蚀剂具有工艺简便、适应性强等特点[4-5],是抑制金属腐蚀最有实用价值的方法之一。通过在腐蚀介质中加入少量缓蚀剂,使其与金属表面发生物理或者化学作用,可以减缓金属在酸性甚至更加恶劣的环境中的腐蚀[6]。目前,对于酸性缓蚀剂已有大量研究,包括无机缓蚀剂和有机缓蚀剂,但是在这些缓蚀剂中会存在一些有毒有害,并且污染环境的物质,例如铬酸盐、砷酸盐、亚硝酸盐等。钨酸盐由于毒性低,可以作为一种绿色无机缓蚀剂替代铬酸盐。有机缓蚀剂可抑制在石油生产和化学加工过程中酸性溶液对金属的腐蚀[7-10],在生产实践中,常常用复配缓蚀剂抑制金属的腐蚀,降低腐蚀速率。由酮、醛、胺缩合成的曼尼希碱作为一种碱型缓蚀剂具有结构稳定、毒性小的特点,已用于石油管道的缓蚀[11]。Ahamad等[12]利用一些新型曼尼希碱作用于酸性介质中碳钢的腐蚀,电化学实验和量子化学计算结果表明该类缓蚀剂能够有效地抑制碳钢的腐蚀,是一种混合型缓蚀剂,并且其在金属表面吸附服从Langmuir吸附模型。任晓光等[13]通过测定N80钢在酸性体系中的腐蚀速率评价曼尼希碱及其复配缓蚀剂的缓蚀性能,结果表明曼尼希碱在金属表面形成一层膜阻碍了N80钢的腐蚀反应,并且将其与钼酸钠、十六烷基三甲基溴化铵复配后缓蚀性能表现出了良好的协同效应,更加有效地降低了N80钢的腐蚀速率。Elewady等[14]利用失重和动电位极化方法探究曼尼希碱对金属铝在HCl溶液中腐蚀的影响,缓蚀剂分子在金属表面结构活化中心吸附,覆盖了电极表面;Al的腐蚀速率与缓蚀剂浓度、介质温度及缓蚀剂的性能有关。将钨酸盐和曼尼希碱复配使用可以在进一步提高缓蚀效率的同时减小对环境的污染。
本工作是在合成曼尼希碱(C15H15ON)的基础上将其与无机钨酸钠复配,采用电化学极化曲线、交流阻抗、扫描电镜形貌分析及腐蚀热力学方法探讨C15H15ON和钨酸钠在0.5mol·L-1HCl溶液中对N80钢的缓蚀行为及复配协同作用,并对其缓蚀机理进行了分析。
1 实验材料与方法
1.1 实验材料及试剂
实验材料为N80钢片,腐蚀体系为用浓盐酸和蒸馏水配制的0.5mol·L-1的盐酸溶液,缓蚀剂选用曼尼希碱(其合成路线如图1所示)和钨酸钠(上海国药集团,分析纯,w(Na2WO4·2H2O)≥99.5%)。

图1 曼尼希碱(C15H15ON)合成路线Fig.1 Synthetic route of Mannich base (C15H15ON)
1.2 实验测试方法
N80钢片化学成分(质量分数/%)为: C 0.42,Si 0.24,Mn 1.55,P 0.012,S 0.004,Cr 0.051,Mo 0.18,Ni 0.005,Ti 0.01,Cu 0.06, 余量为Fe。利用线切割法将N80钢片切割成φ14.5mm×3mm的圆片,把实验样品需要测试的一面依次从50#打磨至1000#,抛光,最后依次用无水乙醇和重蒸水清洗,干燥后备用。
电化学极化和阻抗谱测试在PARSTAT 2273电化学测试系统上测量,电化学工作站采用三电极体系,N80为工作电极,Pt片为辅助电极,饱和甘汞电极(SCE)为参比电极,裸露的工作面积为0.865cm2,等开路电位(OCP)基本保持恒定时,进行电化学测试。极化曲线测定时扫描速率为5mV·s-1,电位扫描的范围为-250~250mV(相对于开路电位),电化学交流阻抗测试在自腐蚀电位下进行,扫描频率范围为10mHz~100kHz,施加的体系扰动电压幅值为10mV,测试电位为开路电位。为了确保实验结果的准确性,每组实验均重复3次。为了减少表面的沉积物对测试结果的影响,对测试样品在乙醇介质中进行超声波振荡清洗15min后,利用扫描电镜对样品表面进行形貌分析。
2 结果与分析
2.1 不同浓度下曼尼希碱和钨酸钠在盐酸介质中对N80钢的极化曲线特征
60℃时,N80钢在不同腐蚀溶液中的极化曲线如图2所示。由图2可知,在HCl体系中加入曼尼希碱和钨酸钠后,阴极和阳极的极化曲线均向低腐蚀电流密度移动,N80钢的自腐蚀电流密度减小,说明缓蚀剂分子在金属表面吸附阻止了盐酸溶液中H+从阳极区得到e-生成H2逸出,同时由于金属表面活化点被覆盖,抑制了阳极金属溶解和阴极析氢过程[15],进而使N80钢在盐酸溶液中腐蚀速率降低。
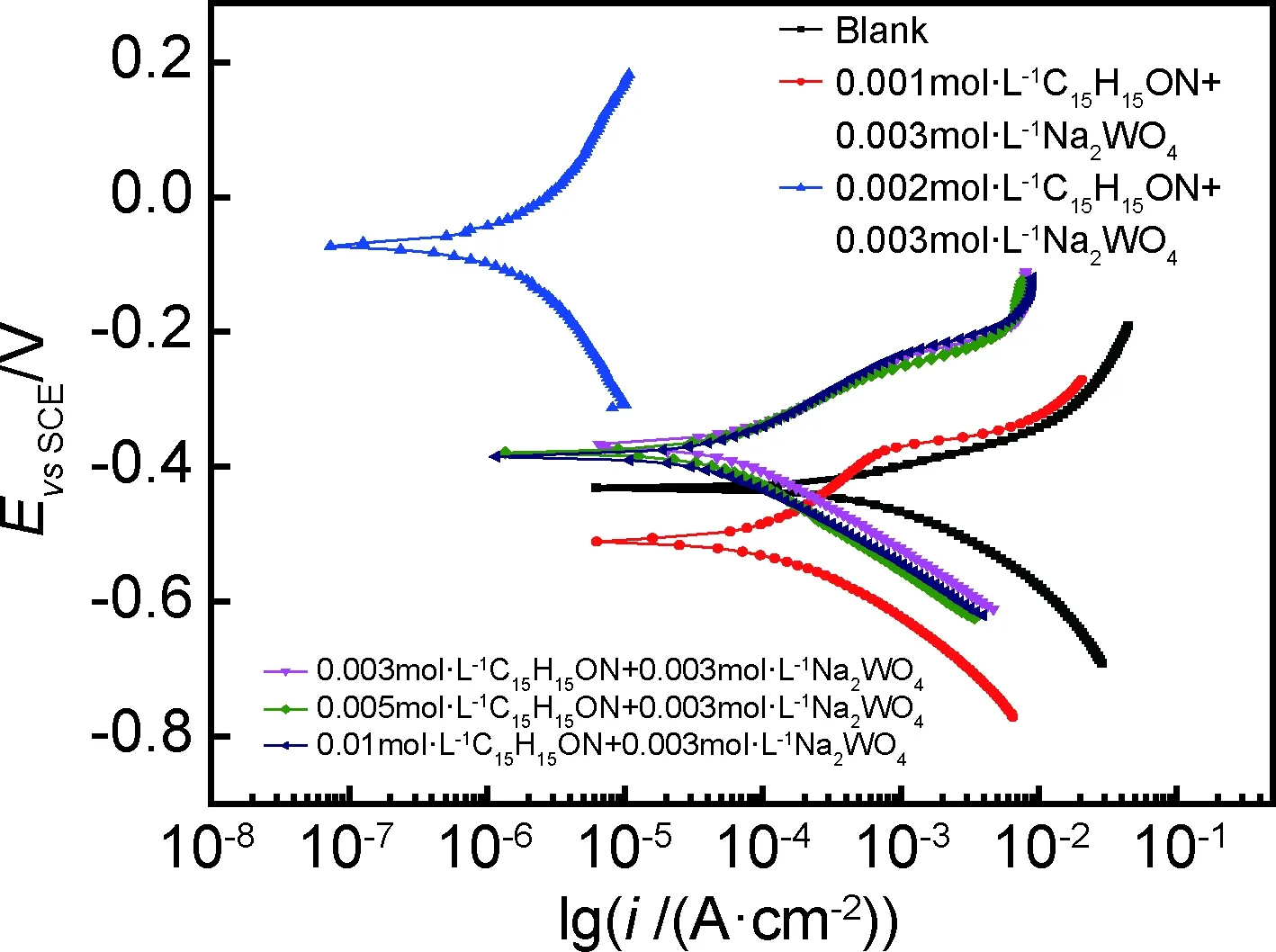
图2 60℃下N80钢在未添加与添加缓蚀剂中的极化曲线Fig.2 Polarization curves of N80 steel in absence and present inhibitor at 60℃
在0.5mol·L-1的HCl溶液中,N80钢遭到Cl-的侵蚀,表面的Fe原子会失去电子变成Fe2+;H+在金属表面获取电子被还原成H2逸出,腐蚀速率加快,反应如式(1),(2)所示。
Fe-2e-→Fe2+
(1)
2H++2e-→H2
(2)
曼尼希碱和Na2WO4以一定比例混合加入后对钢都有一定的缓蚀作用,且浓度的变化也会对缓蚀效率产生影响。曼尼希碱浓度逐渐增大,缓蚀剂分子在金属表面的吸附量也会有所改变。
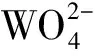
→[WO3(OH)]-
(3)
这将会导致电极表面附近正电荷的浓度减少,改变了N80钢表面的电荷分布和界面的性质;[WO3(OH)]-与表面的腐蚀产物Fe2+,Fe3+形成配位化合物吸附在金属表面,增大了电子转移的能量势垒,从而减缓了N80钢在HCl中的腐蚀。另外,曼尼希碱分子结构中存在的非极性基团,它们的亲水性较差,故表面分子重排形成一层疏水膜,同时也阻碍了溶液和N80钢表面之间电子的转移。曼尼希碱的浓度为0.002mol·L-1时,腐蚀电流密度最小为4.02×10-6A·cm-2,这时曼尼希碱和钨酸钠的缓蚀性能比较好。
2.2 复配曼尼希碱和钨酸钠在盐酸介质中对N80钢的影响
温度为60℃,腐蚀介质为0.5mol·L-1HCl溶液,试样测试面被腐蚀2h后,不同浓度曼尼希碱和钨酸钠对N80钢缓蚀性能的评价结果,如图3所示。
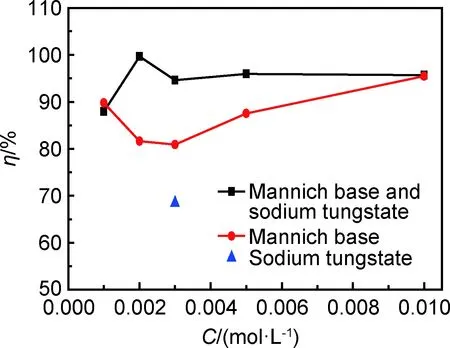
图3 不同浓度曼尼希碱或钨酸钠与缓蚀效率的关系Fig.3 Relationship between Mannich base with different concentrations or sodium tungstate and inhibition efficiency
从图3可以看出,单独曼尼希碱和复配对N80钢在HCl溶液中腐蚀速率都表现出一定的抑制作用,在0.001~0.01mol·L-1浓度范围内,曼尼希碱的缓蚀效率随浓度的增加表现出先减小后增大的趋势。随着曼尼希碱浓度逐渐增大,曼尼希碱单层吸附膜的厚度增加,但是膜层分子之间的空隙较大,吸附膜不稳定容易脱落,缓蚀效率会有所下降;当N80钢表面曼尼希碱分子数量继续增多,分子间距减小,膜的致密度增大,缓蚀效率又会逐步上升。当溶液浓度为0.01mol·L-1时,缓蚀效率达95.48%。在盐酸溶液中单独添加浓度为0.003mol·L-1的钨酸钠时,其对N80钢的缓蚀效率为68.41%。
曼尼希碱和钨酸钠复配后,溶液中离子的浓度会发生变化,复配缓蚀剂对N80钢的缓蚀性能随浓度的增加先增大后减小。这可能是因为曼尼希碱和钨酸钠以1∶1.5加入腐蚀溶液后,会在N80钢表面吸附形成比较致密的膜,而随着浓度配比的变化形成的膜结构不稳定,使得金属暴露在腐蚀溶液中发生点蚀。在曼尼希碱和钨酸钠的摩尔比为1∶1.5时,缓蚀效率为99.65%,此时的缓蚀效率远高于单独使用曼尼希碱的缓蚀效率(约为82.4%)。这说明钨酸钠与曼尼希碱复配后缓蚀效率显著增大,这两种缓蚀剂表现出了较好的协同作用。当曼尼希碱浓度超过0.003mol·L-1后,缓蚀效率的变化趋于缓慢,但此时的缓蚀效率也明显高于单独使用曼尼希碱的缓蚀效率,同时也表现出一定的协同效应。当曼尼希碱浓度为0.01mol·L-1时,复配和单独使用曼尼希碱表现出相同的缓蚀效率,此时协同效应消失,主要是曼尼希碱起缓蚀作用。
2.3 不同浓度下曼尼希碱和钨酸钠对电化学阻抗谱的影响
采用2273电化学工作站分别测定N80钢在未加入与加入缓蚀剂曼尼希碱和钨酸钠的HCl溶液的电化学阻抗谱见图4,其等效电路图可用图5来表示,图5中Rs为腐蚀溶液电阻,Cf为金属表面的膜电容,Rf为膜电阻,Cdl为双电层电容,Rct为电荷转移电阻。

图4 N80钢在添加曼尼希碱和钨酸钠后的Nyquist图Fig.4 Nyquist diagram of N80 steel after adding Mannich base and sodium tungstate
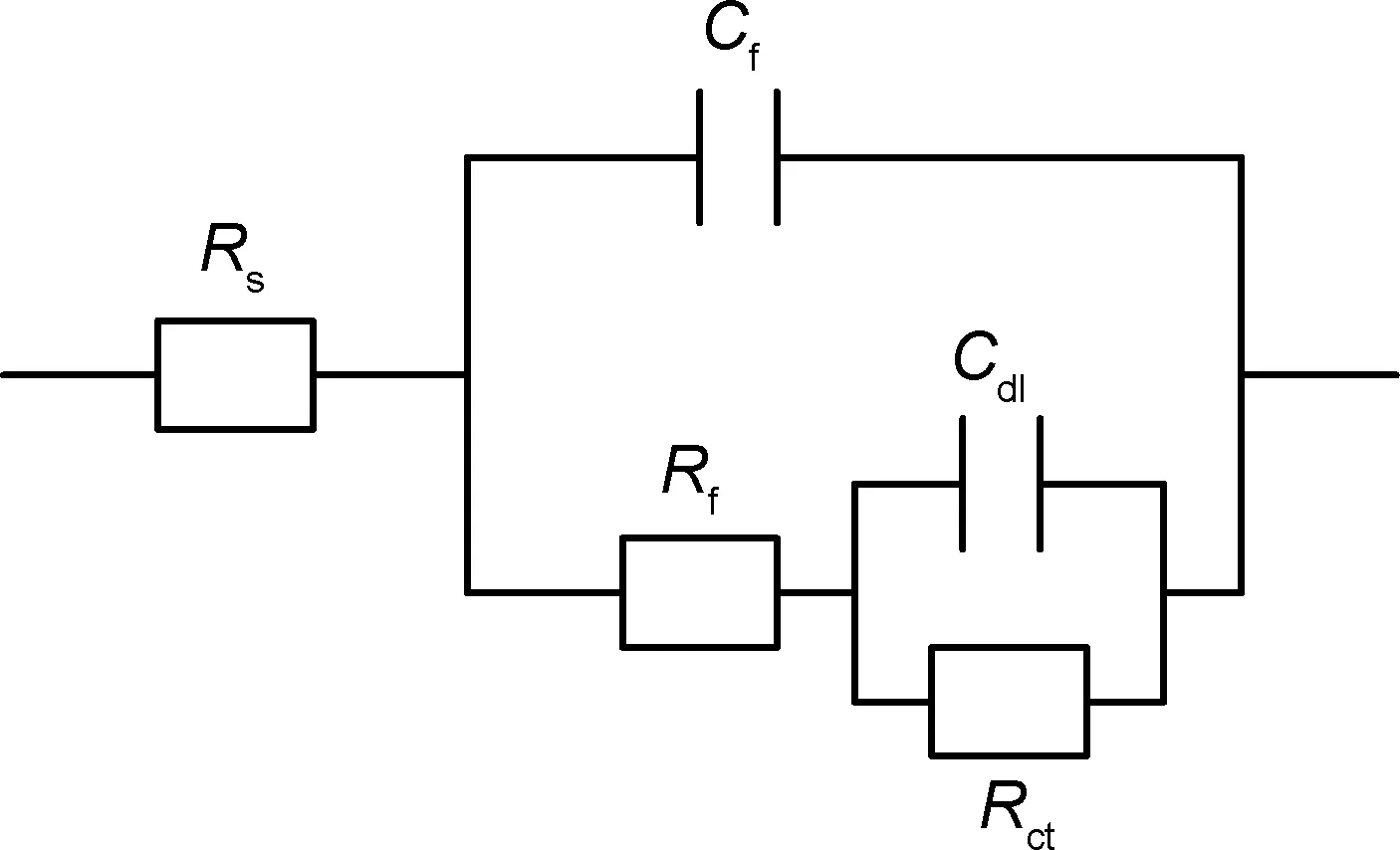
图5 N80钢在腐蚀溶液中的等效电路图Fig.5 Equivalent electrical circuit in corrosive solution for N80 steel
EIS研究表明,Nyquist图中容抗弧与金属腐蚀过程中的电荷转移电阻和双电层电容相关[16],由图4可以看出,未添加和添加缓蚀剂的阻抗谱图都表现出一个容抗弧,并且随着缓蚀剂浓度的改变,容抗弧的半径也随之变化。当钝性金属表面受到Cl-的作用后,电极表面有点蚀核出现,在小孔腐蚀的诱导期,低频部分出现了明显的感抗,感抗响应主要来自于孔蚀诱导期膜厚度的变化或者吸附膜覆盖率的变化[17-18];在形成腐蚀孔,进入小孔腐蚀发展期后,阻抗谱出现了容抗弧。在较高频率下的容抗弧一般是不很完美的半圆弧,这往往是由金属电极测试表面不均匀和粗糙程度引起的[19-20]。在HCl溶液中,Cl-向金属基体不断迁移,破坏了N80钢表面钝化膜的完整性,增加了点蚀发生的概率。随着缓蚀剂的加入,阻抗弧的半径增大,说明N80钢表面在腐蚀溶液中的点蚀速率受到了抑制。
表1列出了等效电路拟合的数据,θ为表面覆盖度,可以利用公式(4)计算:
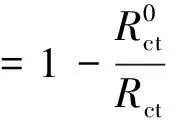
(4)
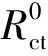
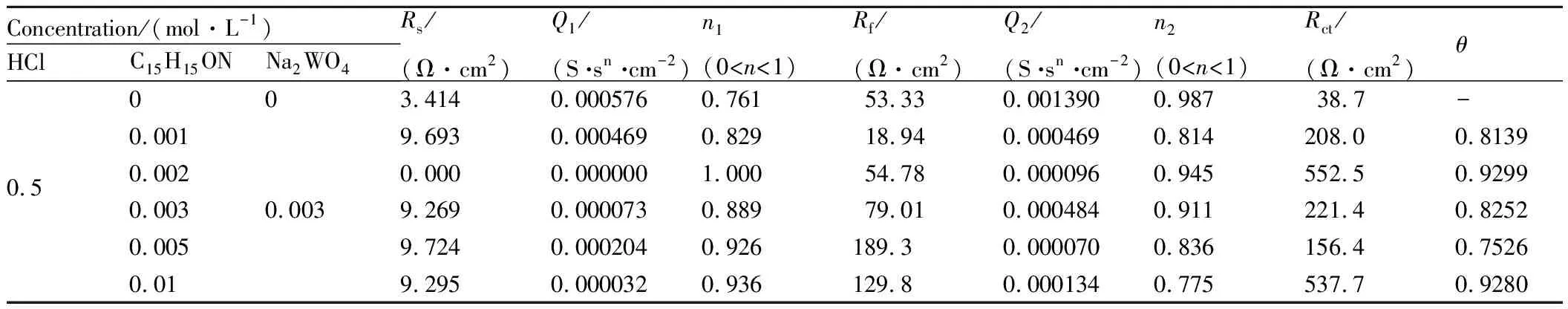
表1 N80钢EIS等效电路拟合的电化学参数Table 1 Electrochemical parameters of N80 steel obtained from EIS equivalent electrical circuit
2.4 曼尼希碱和钨酸钠在N80钢表面的吸附
吸附等温线是分析缓蚀剂分子缓蚀机理的重要参数,为了进一步研究曼尼希碱和钨酸钠在N80钢表面的吸附行为,依次用Langmuir和Frumkin[23-24]吸附模型对实验数据进行拟合,结果显示Langmuir吸附模型与实验数据比较吻合。
(5)
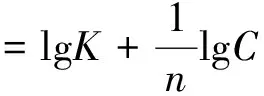
(6)
式中:C为曼尼希碱浓度;K为吸附平衡常数。
图6为60℃下C/θ-C的直线相关图,并且进行直线回归处理后直线相关系数为0.9754,说明C/θ与C具有良好的线性关系,因此曼尼希碱和钨酸钠复配后在N80钢表面的吸附符合Langmuir吸附模型[25]。
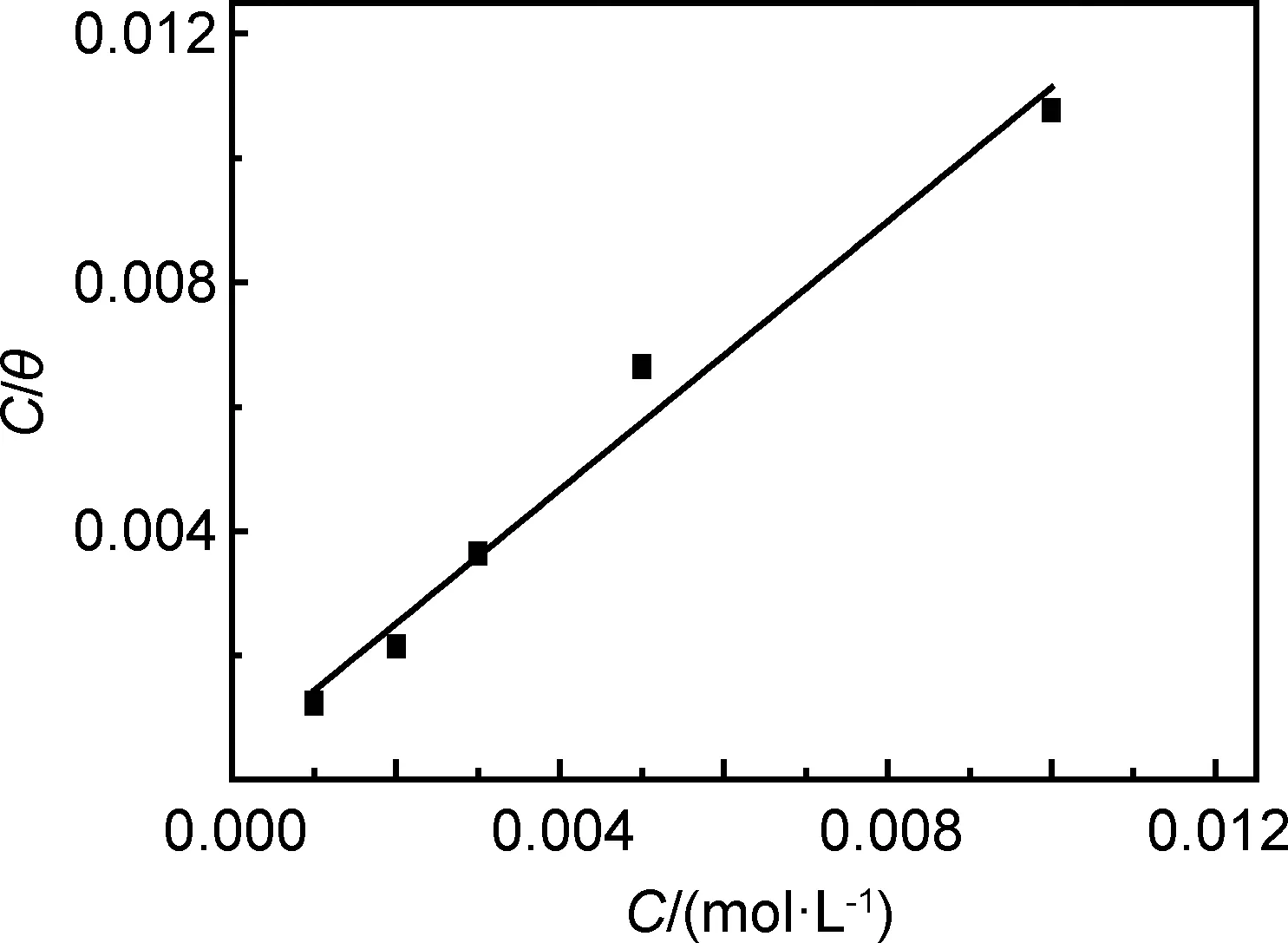
图6 60℃时含不同浓度比例曼尼希碱和钨酸钠的C/θ -C的关系图Fig.6 C/θ -C plots in different ratios of Mannich base to sodium tungstate at 60℃
利用平衡常数K与吸附吉布斯自由能ΔGads的关系式:
(7)
通过计算得到缓蚀剂分子吸附自由能为-33.109kJ·mol-1,ΔGads<0,说明该缓蚀剂在N80钢表面的吸附是自发进行的,并且属于以化学吸附为主的吸附[26-27]。
根据Arrhenius经验方程式:
(8)
式中:ΔH为吸附热;K0为标准吸附平衡常数;R为气体常数,其值为8.314J·K-1;T为绝对温度,K。
由方程(5),(8)联立得到表面覆盖度θ和温度之间的关系式(9)[28]:
(9)
以ln(θ/(1-θ))对1/T作图,见图7。线性拟合ln(θ/(1-θ))-1/T为一条直线,直线的相关系数为0.9804。由ln(θ/(1-θ))-1/T的斜率可求出焓变ΔH=40.783kJ·mol-1,ΔH>0,表明曼尼希碱和钨酸钠在N80钢表面的吸附为吸热过程,即随着温度升高,缓蚀剂分子在N80钢表面的饱和吸附量将会增加,缓蚀性能增强。根据公式(10),利用ΔH和ΔGads的数值可以计算出系统的熵变ΔS为221.8J·mol-1·K-1,说明该吸附过程为自发不可逆的。
ΔGads=ΔH-TΔS
(10)
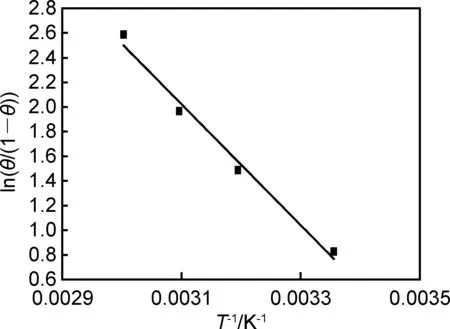
图7 0.002mol·L-1曼尼希碱和0.003mol·L-1钨酸钠的ln(θ/(1-θ))-1/T图Fig.7 ln(θ/(1-θ))-1/T plots in the presence of 0.002mol·L-1 Mannich base and 0.003mol·L-1 sodium tungstate
2.5 腐蚀形貌分析
N80样品在3种不同介质中的SEM形貌见图8。N80钢暴露在空气中(见图8(a)),表面出现了打磨的划痕和微量杂质,没有出现点蚀;与空气介质中N80测试面对比,在HCl溶液中浸泡后,铜表面腐蚀非常严重,出现了明显的腐蚀区域(见图8(b)),这可能是在酸性溶液中高活性的Cl-破坏了N80钢表面的氧化膜而导致的;而在添加曼尼希碱和钨酸钠的酸性溶液中,N80钢表面可以明显地观察到覆盖了一层物质,说明曼尼希碱和钨酸钠复配的缓蚀剂在N80钢表面形成了一层比较致密的膜,减缓了腐蚀速率。
2.6 缓蚀机理

图8 N80钢在空白和添加缓蚀剂腐蚀溶液中的SEM形貌(a)抛光的N80钢;(b)0.5mol·L-1 HCl溶液;(c)0.5mol·L-1 HCl + 0.002mol·L-1 C15H15ON + 0.003mol·L-1 Na2WO4Fig.8 SEM morphologies of N80 steel in absence and presence inhibitors(a)polishing N80 steel surface;(b)0.5mol·L-1 HCl solution;(c)0.5mol·L-1 HCl + 0.002mol·L-1 C15H15ON+0.003mol·L-1 Na2WO4
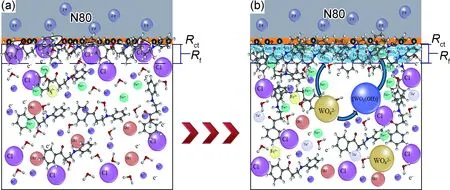
图9 曼尼希碱和钨酸钠在HCl溶液中对N80钢缓蚀作用图(a)曼尼希碱;(b)曼尼希碱+钨酸钠Fig.9 Inhibition effect of Mannich base and sodium tungstate on N80 steel in HCl solution(a)Mannich base;(b)Mannich base and sodium tungstate
3 结论
(1)曼尼希碱作为N80钢在盐酸溶液中的缓蚀剂,同时抑制了阳极金属溶解和阴极析氢反应的发生,即Fe失电子和酸液中H+得到电子的电极反应,进而降低了金属表面的腐蚀速率;并且与钨酸钠复配使用后,对N80钢在酸液中的腐蚀表现出了良好的协同效应。在0.001~0.01mol·L-1浓度范围,曼尼希碱浓度为0.002mol·L-1时,缓蚀效果最好,缓蚀效率可达99.65%。
(2)相同浓度下,腐蚀热力学分析表明曼尼希碱和钨酸钠在N80钢表面的吸附过程是吸热反应(ΔH>0),温度升高,电子转移的能量势垒增大,有利于增加缓蚀剂的缓蚀率;曼尼希碱和钨酸钠复配明显降低了N80钢在酸液中的腐蚀速率,符合Langmuir吸附,并且这种吸附为熵值增加的自发过程。

