肾血管病变的介入治疗现状
冯 骏
(西安交通大学第一附属医院血管外科, 陕西西安 710061)
肾脏是高度血管化的器官,人体心输出量的20%~25%都流向肾脏,因此肾脏良好血供的维持对肾功能的正常运转以及生命活动至关重要。肾动脉供血障碍可引起顽固性的肾血管性高血压,肾静脉回流障碍时可以引起血尿、蛋白尿。长期的动、静脉血流受阻必然会引起肾功能的损害和肾脏的萎缩。因此,防治缺血性肾损伤以及各种原因引起的继发性肾出血对保障肾功能意义重大。自1978年GRUNTZIG首次报道使用球囊导管行经皮肾动脉成形术治疗肾动脉狭窄以来,介入治疗优势逐渐显现,已广泛用于多种肾血管病变的治疗,并成为部分肾血管疾病的首选治疗方法。目前,肾脏疾病介入治疗的主要方式包括肾动脉造影及栓塞术、经皮肾动脉血管成形术和支架植入术等。近十多年来,随着对肾血管疾病研究的深入,临床上对此类疾病介入治疗的适应证和效果的认识也经历着不断的变化。越来越多的临床研究表明,在不同的血管病变病理类型、病变位置和不同的时机对肾病进行血管重建术治疗,对肾脏功能的改善和预后也截然不同。本文就各种血管介入治疗在肾动脉狭窄、肾动脉瘤、胡桃夹综合征、肾错构瘤和顽固性高血压中的疗效、适应证和研究进展等问题进行综述。
1 肾动脉狭窄
肾动脉狭窄(renal-artery stenosis,RAS)是引起高血压和(或)肾功能不全的重要原因之一,多隐匿起病,10%~15%的患者最终会进展为难治性高血压或重度肾功能不全,同时RAS也会对全身循环、内分泌和泌尿系统产生不良影响。据XIONG等[1]统计,在纳入的2 095例RAS患者中,82.4%的RAS由动脉粥样硬化引起,其余则与动脉炎、肌纤维发育不良等有关。粥样硬化性肾动脉狭窄(atherosclerotic renal artery stenosis,ARAS)患者多并发其他系统性疾病,如心脑血管疾病、糖尿病、高血压等。因此,对有临床症状的ARAS患者进行适当治疗对延缓疾病进展十分必要。ARAS的治疗方式主要包括外科血运重建、经皮肾动脉血管成形术(percutaneous renal artery angioplasty,PTRA)、经皮肾动脉支架植入术(percutaneous renal artery stenting,PTRAS)以及药物保守治疗。经皮介入手术因其微创、并发症少、疗效确切等优点一度取代外科手术而成为治疗ARAS的首选治疗方法(图1A~L),介入治疗的受益似乎显而易见。然而,几个大型随机对照试验结果表明,介入联合药物治疗并不优于单纯药物治疗,这引发了广泛争议,使得ARAS患者治疗方案的选择成为困扰临床医生的问题。
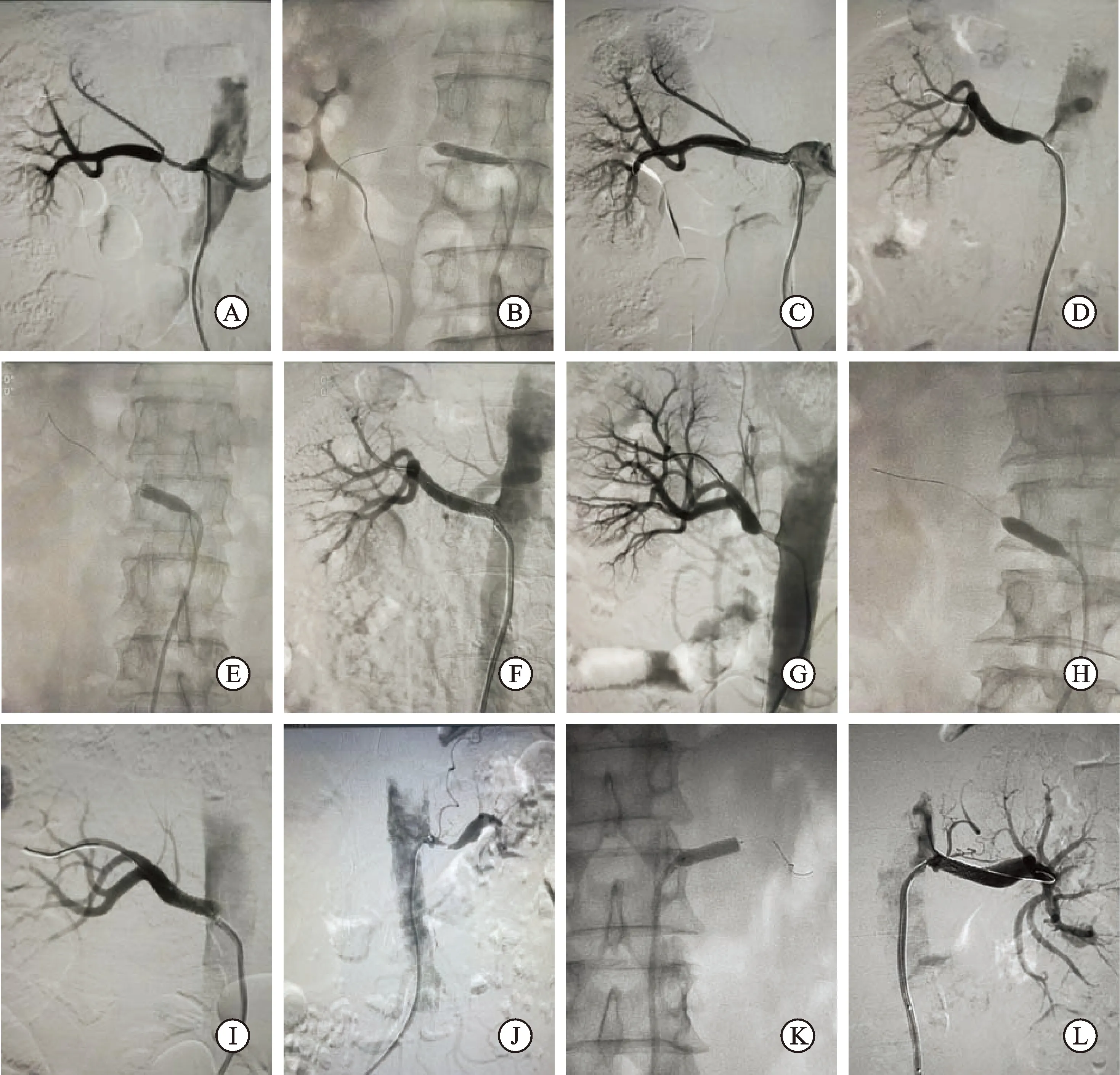
图1DSA造影显示肾动脉狭窄及介入治疗
A、D、G、J:分别为4例患者肾动脉造影结果;B、E、H、K:分别为4例患者对应的球扩支架置入过程;C、F、I、L:分别为4例患者对应的支架术后肾动脉造影结果。
2005年ACC/AHA指南强烈推荐经皮血运重建治疗存在血运障碍的ARAS、再发不明原因充血性心力衰竭、急性肺水肿等。2009年开展的两项前瞻性随机对照临床试验ASTRAL[2]以及STAR[3]比较了保守治疗和介入治疗对ARAS患者肾脏事件终点、心血管事件终点、血压控制水平和死亡率等结局事件的影响,证实了与单纯药物治疗相比,药物治疗基础上的介入治疗并不能改善治疗效果,还会引起相当一部分患者的多种术后并发症。2014年的最新多中心随机对照研究COOPER等[4]纳入了严重肾动脉狭窄合并难治性高血压或肾功能不全的患者,比较了单纯药物治疗以及药物基础上的介入治疗对结局的影响,同样发现两种方案的治疗效果无统计学差异。但此结论引起众多学者的争论和质疑,主要集中在病例选择偏倚,部分介入治疗有潜在获益的患者未入组;纳入患者狭窄率低于70%,COOPER未纳入高危患者(如合并充血性心力衰竭、急性肺水肿或用药后肾功能衰竭仍急性进展);多中心研究中部分资质不足,团队水平参差不齐,质控难保证。RITCHIE等[5]学者的前瞻性队列研究纳入了ARAS伴急性肺水肿和肾功能进行性恶化的高危患者,证实了介入手术在降低患者死亡率和心血管事件发生率方面的潜在保护作用,支持ARAS患者伴急性肺水肿可作为支架治疗的临床指征。国内学者李彬等[6]的研究也显示了介入治疗在血压控制及肾功能改善方面可能获益。有长期随访结果显示:ARAS狭窄率>70%且伴有难治性高血压患者支架治疗4年后,相当一部分患者血压得到控制,肾功能保持良好,左心室结构功能改善。但ZACHRISSON等[7]学者为期10年的随访认为介入治疗ARAS的效果并不乐观。
关于介入治疗效果的争议引发了学者对介入治疗适应证的重新探讨和定义,保证介入治疗疗效的关键也在于预测评估和适应证的把握。2014年SCAI[8]最新的专家共识中给出了相关建议,文章重新定义了RAS血流动力学改变程度分级,指出只有重度血流动力学改变的ARAS才有肾动脉介入治疗的指征,包括肾动脉狭窄>70%的患者,以及肾动脉血流动力学异常且狭窄在50%~70%的患者。肾动脉狭窄<50%的患者则以药物治疗为主。介入治疗临床适应证为:①心功能障碍综合征(急性肺水肿或急性冠脉综合征)伴重度高血压;②顽固性高血压(至少使用包括利尿剂在内的3种降压药的最大耐受剂量但不能控制血压或无法耐受降压药物);③慢性肾脏病伴缺血性肾病,肾小球滤过率<45 mL/min或不明原因的全肾缺血(双侧肾动脉重度狭窄或孤立肾伴单侧肾动脉重度狭窄)。因此,对ARAS的治疗而言,药物治疗是基础,介入治疗疗效的保障在于预测指标的选择及适应证的把握,治疗前除了对解剖学狭窄的检查外,还要进一步完善对血流动力学的评估,以最大程度地保证介入治疗的安全性和效果。
2 肾动脉瘤
肾动脉瘤(renal artery aneurysm,RAA)是由于肾动脉壁局部受损变薄,在血流压力作用下造成管壁向外异常凸起而形成的一种临床上少见的动脉瘤,在普通人群中发病率仅为0.01%~0.09%,多见于女性,绝大多数为囊状,少数为梭型,多发于肾动脉主干分叉处。RAA主要病因有动脉粥样硬化、动脉管壁中膜变性、感染、先天病变、外伤、门脉高压、妊娠所致血流动力学改变等。约75%患者伴发并常年保持高血压状态,还表现为肾功能减退、血尿、腰腹痛和肾盂积水等,但RAA因破裂出血引起发病或死亡的案例较少。所以有学者认为对于RAA直径小于20 mm的患者无需进行治疗,但对于合并危险因素如妊娠、结节性多动脉炎、瘤体较大等的患者,应该考虑选择性修复。RAA有多种分型方法,现在RUNDBACK提出的分型更受推崇:Ⅰ型起源于肾动脉或其分支的囊状动脉瘤;Ⅱ型为肾动脉主干的梭形动脉瘤;Ⅲ型是肾实质型动脉瘤,此分型对治疗方案的选择也具有指导意义。目前,RAA的治疗手段主要有3种:腔内介入、开放手术和腹腔镜手术。GONZALEZ等[9]认为Ⅰ型RAA可以选择腔内介入和外科手术,Ⅱ型RAA建议选择外科手术治疗,Ⅲ型RAA最好选择超选择性肾动脉分支栓塞。近年来,腔内介入以其微创、安全可靠等优势在RAA的临床治疗中更受欢迎,且有望成为治疗RAA的首选。
TSILIMPARIS等[10]比较了开放手术与介入手术治疗RAA的近期和远期疗效,结果显示,二者在围手术期并发症发生率、肾小球滤过率下降比例以及2年后二次介入比例方面均无统计学差异,介入治疗和手术治疗同样安全有效。目前,肾动脉瘤介入治疗的方法主要包括弹簧圈栓塞法、支架植入术以及弹簧圈辅助的支架置入等。弹簧圈栓塞法是血管腔内介入治疗RAA的常用方法,它可以通过改变动脉瘤内部血流动力学,造成动脉瘤内血栓进而使动脉瘤壁受压减少,停止长大,降低破裂风险,但因RAA多发生于血管分叉处,同时累及多条分枝,侧枝循环条件差,因此可能不适于复杂RAA的治疗(图2A~F)。刘德瀚等[11]学者回顾分析了17例RAA患者的临床资料,其中13例采用栓塞法治疗,包括瘤腔栓塞4例,载瘤动脉栓塞3例以及两种栓塞合用6例,术后无严重并发症,载瘤动脉通畅,无RAA复发。作者认为瘤腔栓塞适用于颈/宽<2/3,形态规则的囊状RAA,载瘤动脉栓塞适用于分支血管小动脉瘤、多瘤共干、合并血管畸形患者,而二者合用适用于RAA靠近血管分叉,载瘤动脉近端无法栓塞、破裂风险高以及急性出血患者。而对于宽颈RAA,多采用支架辅助弹簧圈栓塞。WEI等[12]报道了应用裸支架辅助线圈栓塞治疗34例RAA患者术后1年载瘤动脉通畅,无复发,效果良好。裸支架能够减缓动脉瘤腔内血流速度,必要时还可采取支架嵌套的方法,增加支架网眼的密度而进一步减缓RAA的血流。此外也有覆膜支架置入治疗RAA的报道,但是该技术难度大,对血管条件要求高,不易通过且在置入过程中可能引起血栓,限制了其在小管径和迂曲血管中的应用[13]。

图2DSA造影显示肾动脉瘤介入栓塞治疗
A:腹主动脉CTA;B:左肾动脉DSA造影结果;C~E:左肾动脉瘤弹簧圈栓塞过程;F:左肾动脉瘤栓塞术后DSA造影结果。
3 胡桃夹综合征
胡桃夹综合征(nutcracker syndrome,NCS)又称左肾静脉受压综合征[left renal vein (LRV) entrapment syndrome],于1972年被DE SCHEPPER首次报道和命名,是左肾静脉在穿过腹主动脉和肠系膜上动脉形成的夹角时受到机械性挤压而导致血液回流受阻,引起左肾静脉高压的现象,临床上以无症状性蛋白尿或血尿、左腰腹痛和精索静脉曲张等为主要表现,常见于青年及中年低BMI女性(图3)。熟知的前路NCS最为常见,是腹主动脉和肠系膜上动脉压迫LRV所致,而少见的后路NCS则是腹主动脉与椎体压迫LRV所致。据推测,管壁较薄的静脉破裂导致血液渗入集合系统而使肉眼和镜下可见的血尿是NCS最常见和直观的表现。由于目前大多数的报道都是病例报道和回顾性研究,所以NCS的发生率和流行病学特点不明确。关于NCS的合适治疗方案也存在很多争议,许多专家认为开放手术干预是标准治疗方法。近年来发展起来的有腹腔镜技术以及血管内支架治疗。所有的技术都取得了满意的效果,但是由于缺乏大量的试验数据和长期随访研究,很难确定哪一种才是治疗NCS的最佳选择。
A:右肾;B:右肾静脉;C:下腔静脉;D:左肾静脉;E:左肾动脉;F:左肾[14]。
随着血管内介入治疗时代的到来,介入治疗也应用于NCS的治疗中。WU等[15]学者的最大型系列研究报道了75例NCS患者的血管内治疗,68例SMART控制支架,7例Wallstent支架,其中5例(6.6%)出现术后支架移位。CHEN等[16]报道了61例血管内支架治疗NCS的研究,包括45例SMART控制支架和15例Wallstent支架以及1例Palmaz支架,2例术中并发症需要开放手术,术后6个月96.7%的患者症状改善。随访过程中2例患者尽管支架在位但是仍发生了LRV再次被压迫。WANG等[17]评估了30例CNS患者的支架治疗效果,技术成功率达到100%且无任何并发症,随访中患者症状改善,超声检查证实无狭窄,血流通畅。因此,血管内介入治疗在治疗NCS中效果良好,具有临床应用价值,但其有效性和安全性仍需更多的研究予以证实。
4 肾错构瘤
肾错构瘤(renal angiomyolipoma,RAML),又称肾血管平滑肌脂肪瘤,是最常见的肾脏良性肿瘤,患病率约为0.2%~0.6%。80%的RAML为孤立单发型,好发于中年女性,瘤体较小且极少发展而致死;而其余20%则与结节性硬化症或肺淋巴管平滑肌瘤有关,发病无性别差异,双侧多发,瘤体较大,易生长且恶变风险高。典型的RAML是由异常血管、平滑肌和脂肪组织3种基本成分构成的异质性肿瘤。由于肿瘤内异常血管往往管壁脆弱,易出血,故瘤内或肾周出血是较为常见和严重的并发症。有学者认为瘤体大小和动脉瘤形成是预测肿瘤破裂的可靠因素,即瘤体>4 cm,且与之相关的动脉瘤>5 mm则认为RAML存在较高的破裂风险,应行手术或选择性肾动脉造影及栓塞术,但目前RAML治疗的适应证尚无统一标准。
过去几十年,临床上更倾向于手术治疗RAML,因不能排除这些瘤体恶变的可能性而被切除。随着影像学诊断技术的发展,基于B超和CT的有效诊断使得选择性经动脉栓塞成为目前治疗RAML的一线治疗方案,特别是对于急性出血或血流动力学不稳定的患者。对于症状难以控制、血管畸形和少见的诊断不确定RAML患者,许多临床医生更偏向于选择栓塞和保守治疗。对于需要进行瘤体切除或肾组织切除术的患者,术前介入栓塞也可起到降低手术并发症和手术时间、难度的效果。选择性肾动脉造影及栓塞术已在肾肿瘤和手术后肾出血的治疗中广泛应用并取得可靠的效果,在RAML的干预和出血治疗中也有诸多应用,并显现出有效控制肿瘤生长、迅速控制出血和尽可能保留肾单位等优势,但栓塞后也存在并发症和复发等风险(图4)。据报道,栓塞后3天副作用发生率高达42.8%,如低烧、腰痛、白细胞降低、恶心和呕吐,但常规对症治疗可有效缓解这些症状。栓塞后因复发、再出血及脓肿形成等原因需要行再次栓塞治疗的比例为17%~37%。KUUSK等[18]总结分析了既往治疗RAML的多项研究,发现128例RAML患者栓塞后3年无需二次治疗者达到63.5%,明显低于手术治疗和保守治疗。同时,作者认为瘤体直径<6 cm可考虑保守治疗。
郑汉雄等[19]学者进行了介入栓塞术和手术切除治疗RAML出血的随机对照研究,随访3个月时介入栓塞治疗在控制复发和相关症状方面的临床有效率达到88.9%,手术治疗为86.7%,无统计学差异,但介入治疗并发症发生率更低。同时,作者认为,对于瘤体直径在4 cm以下的无症状患者,RAML自发性破裂的风险不大,但须密切监测;直径4 cm以上怀疑恶变可能,则建议尽早治疗。杨兴国等[20]比较了急诊手术、保守治疗和介入治疗对RAML的治疗效果的差异,认为对于瘤体较小者,或单侧多发肿瘤者,或双侧肿瘤者可考虑介入治疗。由于各种栓塞剂作用机制不同,根据病变血管结构不同选择合适的栓塞剂类型才能取得良好效果。因此整体上说,栓塞介入是RAML耐受性良好的治疗手段。
图4DSA造影显示肾错构瘤介入栓塞治疗
A:腹部增强CT横断面结果;B:腹部增强CT冠状位结果;C:右肾动脉DSA造影结果;D:右肾错构瘤栓塞过程;E:右肾错构瘤栓塞术后DSA造影结果。
5 顽固性高血压
顽固性高血压是指高血压患者即使同时服用包括利尿剂在内的3种不同类型的足量降压药物血压仍不能控制在正常水平的患者。在中国,高血压的发病率高达27.9%,而其中顽固性高血压约占高血压人群的5%~10%,同时2%的高血压还会发展为顽固性高血压。顽固性高血压对靶器官的损害长期而持续,可引起一系列严重并发症,心脑血管疾病、肾功能不全和总死亡风险增加。因此,探索有效控制血压的新措施成为临床研究的重点。肾动脉交感神经活性异常增高是顽固性高血压的最重要的病理生理机制之一,其过度活跃一方面导致肾素分泌过多而引起水钠潴留、肾动脉收缩;另一方面肾传入神经通过神经激肽受体途径发出的信号传到中枢神经系统,产生血管紧张性调节作用,最终导致顽固性高血压。肾动脉交感神经消融术(renal denervation,RDN)通过消融肾动脉血管壁中分布的交感神经纤维来降低全身交感神经系统过度兴奋而起到调控血压的作用(图5)。该技术最早于2009年由KRUM等应用于顽固高血压的治疗中,效果良好,而后被逐渐推广和应用。
2009年开展的前瞻性队列研究Symplicity HTN-1中45例顽固性高血压患者RDN术后1个月至术后3年收缩压和舒张压均发生明显的降低[22]。2014年关于106例顽固高血压患者RDN和药物治疗的随机对照试验HTN-2结果也证实了RDN在持续控制血压方面效果优于药物治疗[23]。但是更大样本量的多中心对照试验Symplicity HTN-3对比了非手术组与RDN治疗组降压效果的差异,结果显示:术后6个月两组患者血压下降差异无统计学意义[24],表明RDN对顽固性高血压的降压效果并不优于药物治疗。但是仍有不少学者对RDN的治疗前景充满信心。WARCHOL-CELINSKA等[25]的研究认为RDN可降低顽固性高血压合并阻塞性睡眠呼吸暂停综合征患者的动态血压和诊断血压,同时还可以缓解睡眠呼吸暂停综合征严重程度。此外,RND还可以改善主动脉扩张,降低主动脉僵化程度,减少室性心律失常的发生频率,降低心衰和心房颤动风险等。因此,RDN在顽固性高血压治疗中的效果还有待进一步验证,其在改善心肺功能方面的潜在价值也需更多研究的支持。
6 结论及展望
目前,血管内介入在多种肾血管病变治疗中的优势不言而喻,介入治疗的方法和理念也随着技术的进步和临床研究的深入在争议和共识中不断进步和被重新定义。我们有理由相信,介入技术的发展会进一步降低患者死亡率和并发症发生率并改善患者预后。更多高质量的随机对照研究及长期随访结果将会更精确细致地明确血管介入治疗的适用指征,更好地预测和评估介入治疗的临床效果。

