向尿路上皮细胞定向诱导分化的脂肪干细胞与小肠黏膜下层支架的生物相容性研究
王神香,高吴阳,熊少兵,熊云鹤,汪前亮
(1.三峡大学附属仁和医院泌尿外科,湖北宜昌 443000;2.武汉大学人民医院泌尿外科,湖北武汉 430060)
先天性膀胱异常、感染、浸润性膀胱肿瘤、膀胱外伤等上述疾病往往需要进行膀胱扩大成形手术或者膀胱替代治疗。目前临床上进行膀胱扩大成形手术或者膀胱替代的金标准为使用肠道进行膀胱扩大或尿流改道术[1]。但是,由于胃肠道组织与膀胱组织在结构和功能上存在明显差异,用胃肠道组织修复膀胱并不是理想的方法,多数文献报道了肠管代膀胱常常伴随各种并发症的发生[2],如慢性反复的尿路感染、水电解质失衡、代膀胱吻合口狭窄、继发恶性肿瘤、肠道黏液分泌以及结石形成等[3-4]。组织工程学的发展为膀胱组织的修复或重建带来了希望,通过组织工程的方法构建具有类似膀胱组织结构的组织工程复合物进行膀胱修补,则可能避免上述问题。
尿路上皮层是被覆在膀胱腔内的具有防止尿液渗漏以及执行黏膜免疫功能的重要屏障[5],是尿路结构与其他组织最重要的区别所在。但是尿路上皮细胞作为一种分化成熟的细胞,在体外培养环境下难以大量扩增[6]。目前已有多项研究证明脂肪干细胞在体外环境下可以向尿路上皮细胞诱导分化[7]。本研究拟诱导脂肪干细胞向尿路上皮细胞分化,并将诱导后细胞与小肠黏膜下层(small intestinal submucosa,SIS)复合,评价细胞与支架材料的生物相容性,为进一步构建组织工程化组织提供实验基础。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级雄性新西兰大白兔6只,兔龄8周,体质量2.0~2.5 kg,购自湖北省预防疾控中心。所有动物处置均严格按照伦理审查标准执行,符合动物伦理学要求。
1.1.2主要试剂 Ⅰ型胶原酶、胰酶、小牛血清、DMEM、双抗、Percoll、KSFM培养基(Gibco公司),抗UP1a抗体、抗CK-18抗体(Santa cruz公司),FITC标记CD31、 FITC标记CD45、FITC标记CD29、FITC标记CD44(英国Abcam公司),山羊抗小鼠荧光二抗(武汉谷歌生物科技有限公司)。其中尿路上皮细胞购自中国科学院细胞库。
1.2方法
1.2.1兔脂肪干细胞的分离与培养 新西兰兔进行耳缘静脉麻醉。组织剪剪去腹股沟兔毛,用1%的消毒碘消毒腹股沟区皮肤,取无血管的脂肪组织20 g立即放置于含青霉素—链霉素的磷酸盐缓冲液中。在层流超净工作台用无菌的眼科剪将上述脂肪组织完全剪成碎末状。移至无菌离心管,加入浓度为0.1%的I型胶原酶进行消化,50 min后加入配置好的含胎牛血清的相同体积的L-DMEM培养基终止消化过程;通过目网(100和200)过滤后,将得到的滤过液移至无菌离心管中,以1 500 r/min 离心5 min,去掉上清液,PBS重悬,离心5 min,重复上述操作2次,最后用DMEM重悬制作细胞悬液。转入10 cm培养皿内,置入37 ℃,饱和湿度的体积分数为5%的 CO2培养箱内静置培养。随后间隔2 d换液,7~10 d细胞80%左右融合即可常规胰酶消化传代。
1.2.2兔ADSCs的流式鉴定方法 选取第3代ADSCs,并在倒置显微镜下观察细胞融合达到90%时,弃掉培养液,并向培养瓶内加入0.25%的胰酶消化液(含有0.04% EDTA),消化时间1~2 min,待细胞完全脱离瓶壁后,用等体积DMEM终止消化,1 500 r/min,离心5 min,弃上清,加入流式缓冲液离心后再次重悬,并用细胞计数板对细胞计数。取3×104细胞/mL,用4%的多聚甲醛固定30 min,使用流式缓冲液冲洗细胞2遍,每次1 min,离心后加入含有CD29、CD31、CD45、CD44一抗的流式缓冲液,在4 ℃条件下孵育1 h后用流式细胞仪检测细胞表面标志物。
1.2.3脂肪干细胞的诱导分化 研究中选择Transwell共培养小室模型,Transwell共培养系统由corning公司生产,分为上、下两室,两室之间由膜虑器隔开,膜虑器主要由一种聚碳酸酯膜构成,有不同孔径类型,3 μm以下的孔径细胞无法自由通过,而细胞因子等小分子物质可以自由通过。脂肪干细胞传代到第3代,实验过程中,将脂肪干细胞悬液以1×105/cm2密度种植于Transwell 共培养系统的下层,所用的培养基为DMEM培养基[含1%双抗,10%(V/V)胎牛血清,低糖DMEM培养基]。同时将尿路上皮细胞以2×105/cm2种植于小室的上层,加入KSFM培养基,并设置下层种植脂肪干细胞,上层不种任何细胞作为实验对照组。完成细胞分层种植后,将Transwell小室系统放置于37 ℃、CO2浓度为5%的细胞培养箱,间接共培养2周时间。
1.2.4小肠黏膜下层的制备方法 用手术方法取出兔的小肠,置于10 mmol/L PBS和0.1%叠氮钠的混合溶液中浸泡,搅拌过夜,并用薄玻片刮去小肠黏膜层。然后将包有纱布的血管钳揉搓的方式去除肌层及浆膜层组织,剩下小肠黏膜下层组织,PBS洗涤后继续用0.5 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)和0.4%胰蛋白酶混合溶液在 37 ℃条件下浸泡搅拌5~10 h。用保护液(1%甲醛+ 0.2% 戊二醛保护液)交联保护10 min。PBS漂洗后,用 1 mol/L NaCl加40 U/mL DNase溶液于37 ℃搅拌6~ 8 h。最后用4%脱氧胆酸钠和0.1%叠氮钠溶液浸泡和搅拌5~6 h,此过程必要时需重复1次。取少量制备的小肠黏膜下层组织进行苏木精-伊红染色及扫描电镜观察脱细胞效果,其余置于体积分数75%乙醇中消毒30 min, 冷冻干燥后密封,环氧乙烷消毒以用于后续实验。
1.2.5诱导后脂肪干细胞种植于SIS复合培养及细胞相容性评估 取在Transwell共培养系统诱导分化14 d后的诱导后细胞,利用胰酶消化贴壁细胞,10%的胎牛血清中和后进行离心5 min,再用DMEM重悬,并通过细胞计数板计数,将细胞密度调到4×106/mL,在超净工作台上将上述密度的细胞悬液缓慢滴加于SF/CS支架一面,逐滴加入盖满整个支架材料,然后置于37 ℃、5% CO2培养箱培养4 h,促使诱导后细胞的贴壁生长,取出上述培养皿,在超净工作台中向培养皿继续加入DMEM培养基,培养基加到以刚好浸没支架材料,立即停止滴注,小心将培养皿转移至37 ℃、5% CO2培养箱培养,每2 d换液一次。
将兔SIS剪成直径约1 cm的圆形小块12 块,PBS清洗2次后置入24孔板的其中12孔内,加 DMEM/F12完全培养基孵育48 h。将诱导后细胞以1.0×109/L的浓度接种到置有SIS的12孔内,其余12孔加等量同期培养的诱导后细胞作为对照,置于培养箱中培养。从培养第2 d起每天各取每组的1孔消化离心进行细胞计数,连续12 d。据两组所得细胞数绘制细胞生长曲线,对比两组细胞生长曲线。
1.2.6主要观察指标 ①倒置显微镜下观察第3代脂肪干细胞形态,流式检测第3代脂肪干细胞的表面标记物;②细胞免疫荧光和Western blot 对细胞诱导后效果进行检测;③检测小肠黏膜下层脱细胞情况;④扫描电镜和组织学检测诱导后细胞和SIS复合培养状况;⑤观察分析诱导后细胞和SIS复合培养后的生长曲线图。
2 结 果
2.1脂肪干细胞形态学观察及流式细胞鉴定本实验通过胶原酶消化法成功分离出ADSCs,6 h出现细胞贴壁生长,24 h后细胞贴壁数目明显增多;2 d后细胞形态多样,表现为圆形、多角形、长梭形等不一;3 d后以长梭状细胞形态为主,可见少量不规则细胞(图1A),每2 d换液一次,原代细胞生长速度较缓慢,一般需要培养7 d,细胞的相互融合度才能达到80%,而到第10 d,细胞融合度可达到90%,倒置镜下观察可见细胞呈典型的纺锤样形态,形成多个细胞集落并相互融合,细胞形态均一(图1B)。经初次按1∶2比例传代后,传代后细胞增殖速度较原代细胞明显加快,传代细胞培养4~5 d即可达到80%细胞融合度,传代过程有纯化细胞能力,经传代后脂肪干细胞的纯度提高,传至第3代细胞获得了较高的纯化,脂肪干细胞连续传代至第10代仍然保持较好的增殖状态。
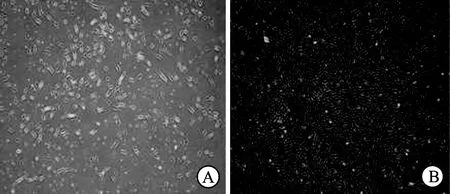
图1 ADCSs原代培养
经传代培养,获取P3代纯化的细胞,用于流式术检测表面抗原CD分子,结果显示,细胞高表达CD29 (99.6%)、CD44 (98.2%);低表达CD31 (1.9%)、CD45(1.6%)(图2)。上述流式结果与间充质干细胞的表型相符合,证明我们成功获取的是ADSCs细胞,排除了造血干细胞或者成纤维细胞。

图2 ADCSs流式细胞术鉴定直方图
A:ADCSs 细胞表面标志CD29 99.6%;B:ADCSs 细胞表面标志CD44 98.2%;C:ADCSs 细胞表面标志CD31 1.9%;D:ADCSs 细胞表面标志CD45 1.6%。
2.2诱导分化后细胞的特征及表型鉴定为进一步确认ADSCs诱导后分化的效果,本实验中通过免疫荧光检测诱导后细胞尿路上皮细胞特异性蛋白UPIa的表达,将诱导后细胞爬片行免疫荧光检测,结果提示:未诱导分化的ADSCs不表达特异性UPIa蛋白(图3A、B),而进行共培养诱导后细胞可出现UPIa的表达(图3C、D)。通过Western Blot检测尿路细胞特异性蛋白UPIa的表达水平,经诱导培养后,诱导后细胞的尿路上皮细胞特异性蛋白UPIa表达上调,而未诱导的ADSCs这两种特异性蛋白呈低表达状态(图4),结果与免疫荧光的结果相符。上述这些结果表明,脂肪干细胞在共培养体系的诱导下,诱导后的细胞已向尿路上皮细胞分化,具有尿路上皮的表型。
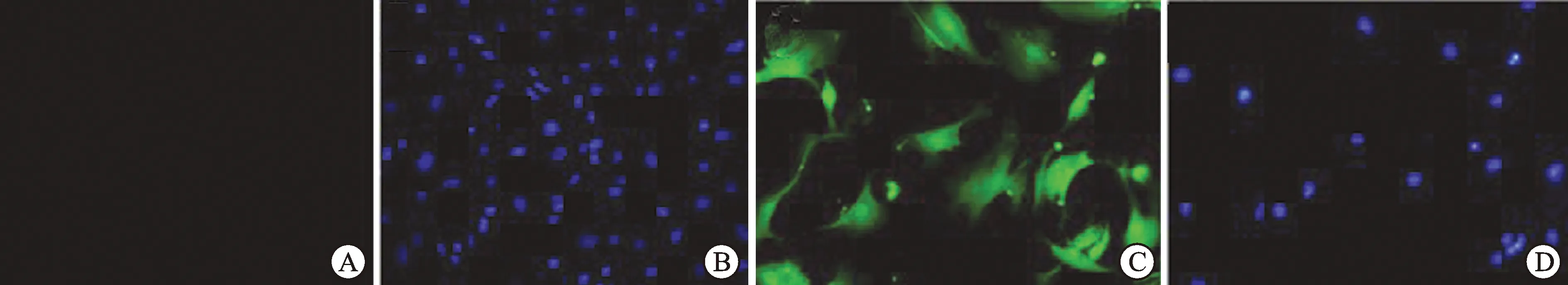
图3未诱导的ADSCs和诱导后细胞(ISCs)UPIa蛋白表达情况(×200)
A:未诱导分化的ADSCs胞质不表达特异性UPIa蛋白;B:DAPI显示未诱导分化的ADSCs胞核;C:诱导后细胞胞质可出现UPIa的表达;D:DAPI显示诱导分化的ADSCs胞核。

图4Westernblot显示诱导后细胞(ISCs)表达UPIa
2.3兔小肠黏膜下层(SIS)的组织学观测结果SIS呈白色半透明状,苏木精-伊红染色显示未见细胞核的残留,细胞外基质依然保持波浪状的纤维形态,且能继续维持相互交联的状态(图5A)。Masson染色未见明显的细胞核结构,蓝染的纤维样结构同HE染色相似,亦呈现出波浪分布、纵横交错的现象(图5B)。电镜下观察SIS,SIS表面未见明显的细胞残留,而可见大量的纤维样组织交错分布,形成一种三维立体的网状结构。纤维样基质相互交织成孔隙样结构(图5C)。

图5肠管脱细胞处理后无细胞残留
A:SIS苏木精-伊红染色呈红色细丝状,内无细胞残余(×100);B:Masson染色(×200);C:扫描电镜下观,可见交错排列成网状的白色胶原纤维,未见细胞碎裂残片。
2.4扫描电镜和组织学检测诱导后细胞和SIS复合培养情况兔诱导后脂肪干细胞可成功种植于SIS上,倒置显微镜下可见SIS边缘有细胞爬出,SIS周边有大量细胞生长。行苏木精-伊红染色可见细胞散在分布于SIS表面,细胞核染色呈蓝色(图6A)。扫描电镜观察发现,诱导后细胞能够均匀地平铺于SIS上,细胞在支架表面融合良好,能够较好地黏附于支架材料上(图6B)。
2.5诱导后细胞与SIS的生物相容性实验结果实验组与对照组细胞的生长曲线基本相似,种植后3 d内细胞生长曲线相对平缓,可能为细胞的适应期,而4~10 d生长曲线变陡峭,细胞呈倍数分裂生长,11~12 d曲线又趋于平缓,可能为细胞生长达到饱和状态,互相之间产生生长抑制。从绘制的生长曲线可推断诱导后细胞在SIS表面能够很好地粘附、增殖及分裂生长,说明诱导后细胞在SIS表面生长良好,两者相容性较好(图7)。
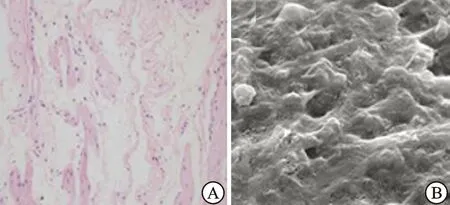
图6 SIS负载诱导后细胞
A:SIS负载诱导后细胞的HE染色(×200);B:SIS负载诱导后细胞的扫描电镜观察(×1 000)。
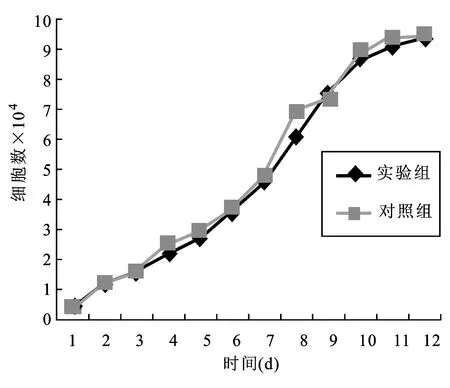
图7 实验组和对照组诱导后细胞的生长曲线图
3 讨 论
构建组织工程化组织主要涉及到两个核心问题:种子细胞和支架材料。目前应用于泌尿系组织工程的细胞主要是来自自体器官的特异性细胞:尿路上皮细胞和平滑肌细胞。自体尿路上皮细胞和SMCs细胞用于泌尿系组织工程的相关研究较多,包括基础研究和临床研究[8],有研究者用胰酶消化的方法获得尿路上皮细胞[9],经体外培养、扩增,然后与SIS支架复合制成细胞-支架复合移植物,再植入兔皮下观察复合物生物相容性,术后取组织标本观察组织再生情况,同时行免疫组化了解尿路上皮的增殖情况,研究表明尿路上皮构建组织工程可以获得较好的效果。在临床应用方面取得了一定成果,在2006年,ATALA[10]用膀胱穿刺活检方法从7例脊髓脊膜突出患儿(4~19岁)膀胱组织获取尿路上皮细胞和平滑肌细胞,并将细胞体外培养扩增后种植于胶原支架或胶原-PGA复合支架构建了组织工程化复合移植物,最后将复合移植物行膀胱扩大成形术,研究结果显示平均膀胱漏尿点压明显下降,而膀胱容量及顺应性增加,术后无尿结石形成,穿刺活检显示修复的膀胱结构与正常膀胱组织相似。以上两种自体种子细胞避免了与宿主发生排斥反应。采用自体种子细胞在客观上是理想的选择,可以达到组织再生的要求。但自体细胞存在以下问题:①成体细胞在体外培养过程中增殖能力及功能逐渐减弱,出现细胞老化现象;②对于膀胱肿瘤的患者,无法获得高纯度的正常膀胱细胞;③一些先天性泌尿系疾病也可导致无法获取大量的UCs或SMCs细胞。因此,找到一种合适的种子细胞,并能够适用于组织工程大规模应用的需求是问题的关键。
ADSCs获取于脂肪组织,同其他众多的干细胞不同的是,ADSCs适应性强,来源极为丰富,获取简单,增值能力佳。本实验即采用了胶原酶消化法进行了ADSCs的原代培养,也证实了这种方法的有效性和高效性。通过流式术检测表面抗原CD分子,细胞高表达CD29 (99.6%)、CD44 (98.2%),低表达CD31 (1.9%)、CD45(1.6%)。上述流式结果与间充质干细胞的表型相符合,证明我们成功获取的是ADSCs细胞,排除了造血干细胞或者成纤维细胞。与其他干细胞相似的是,ADSCs分化能力强,可分化为多种细胞系。有多项研究发现ADSCs可诱导分化为多种类型的体细胞,如心肌细胞[11]、平滑肌细胞[12]、脂肪细胞[13]、软骨细胞[14]。另外,有学者发现,ADSCs可诱导向上皮细胞方向分化。LI等[15]利用体外3D培养系统,通过添加表皮生长因子、角质细胞生长因子等诱导ADSCs向上皮细胞方向分化,诱导实验后,可以发现诱导的细胞展现出分层上皮状形态,同时可以检测到上皮细胞特异性标志物的表达,从而证实了在特定微环境中ADSCs可被诱导向上皮细胞方向分化。ZHANG等[16]将ADSCs置入培养过永生化尿路上皮细胞的条件培养基中进行诱导培养和通过Transwell共培养系统将ADSCs与永生化尿路上皮细胞共培养,两种方法诱导ADSCs分化21 d,可以检测到相关尿路上皮细胞蛋白的表达,因此作者认为ADSCs有诱导分化为成熟尿路上皮细胞的潜力。然而,精确的分子调控ADSCs向尿路上皮细胞分化的机制还处于探索阶段。本实验诱导培养ADSCs后通过免疫荧光和Western blot检测发现,诱导后的细胞在形态上向尿路上皮细胞靠近,并且能够表达尿路上皮细胞特异性蛋白,这不仅证实了上述ADSCs具有向尿路上皮细胞方向分化的潜能,也为下一步种子细胞的种植奠定了基础。
理想的支架材料应该具有生物兼容性,支持细胞生长,拥有三维结构,无毒性,可降解,降解产物可吸收,易塑形,有一定的强度,能调节细胞粘附、迁移、增殖和分化,同时不会诱导严重的炎性反应。SIS是一种天然的、以胶原蛋白为主要成分的细胞外基质,是将小肠组织的黏膜、浆膜及肌层通过机械作用进行脱离后剩下的黏膜下层组织。HURST等[17]通过免疫组化的方法分析SIS支架材料,检测出多种生长因子的存在,包括硫酸类肝素蛋白多糖、成纤维细胞生长因子、血管内皮生长因子,但转化生长因子并没有被检测出。多项研究显示SIS能够较好地支持细胞增殖,迁移和分化。SHUKLA等[18]分离培养猪骨髓间充质干细胞,并诱导其向尿路SMCs方向分化。其后将分化的细胞和未进行诱导的骨髓间充质干细胞接种到SIS,将复合物进行自体膀胱扩大术。实验结果显示SIS可较好地支持细胞的生长和分化,进一步有助于膀胱扩大术中膀胱组织的再生。YANG等[19]研究发现SIS内成分有促进人膀胱SMCs和人脐静脉内皮细胞粘附、增殖、迁移的作用。
在本实验中将诱导后的脂肪干细胞种植于SIS上,通过苏木精-伊红染色发现SIS表面有细胞生长,说明细胞可种植于SIS上。扫描电镜观察发现,诱导后细胞能够均匀地平铺于SIS上,细胞在支架表面融合良好,能够较好地粘附于支架材料上。进一步将SIS剪成小块置入24孔板的其中12孔内,接种诱导后细胞到24孔板内,通过绘制两组细胞生长曲线图,测得实验组与对照组细胞的生长曲线相似,进一步说明诱导后细胞在SIS表面能够很好地贴附、分裂生长,二者的组织相容性较好。
总之,本研究探讨了脂肪干细胞向尿路上皮细胞分化的可行性,诱导后细胞表达尿路上皮细胞特有标记物,具有尿路上皮细胞表型,可作为构建泌尿系组织工程组织的种子细胞。在实验过程中进一步探讨了诱导后细胞与SIS的生物相容性,通过组织学检查和扫描电镜证实了细胞可以在SIS材料上粘附和生长,且实验组与对照组具有相似的生长曲线,说明SIS有利于促进细胞增殖,无细胞毒性作用,该项研究为进一步构建泌尿系组织工程组织奠定了试验基础。

