海南岛附近海域肉芝软珊瑚的鉴定
周 洋 , 杨超杰 ,王沛政 ,王海山 ,徐云升, ,李卫东
(1. 海南热带海洋学院, 海南 三亚 572022; 2. 海南省海洋食品工程技术研究中心, 海南 三亚 572022; 3. 海南大学海洋学院, 海南 海口 570228)
肉芝软珊瑚属(Sarcophyton)属于刺胞动物门、珊瑚纲、八放珊瑚亚纲、软珊瑚目、软珊瑚科,生长于3~15 m水深处,广泛分布在我国南海海域.它外形如同蘑菇状,由冠部和茎部组成,冠部表面平滑,呈杯口、花环和喇叭口等形状,分布着水螅体和管状体,水螅体的功能主要是捕食和繁殖[1],管状体是一类触手退化的水螅体,用于进行体内外水体交换[2];茎部底部附着在基座上,表面如皮革材质.
肉芝软珊瑚研究主要集中在活性物质的提取和分离方面,分类学的研究相对较少.目前从肉芝软珊瑚分泌物种发现并分离了具有抗炎、抗菌、抗肿瘤等化合物[3-5].自19世纪以来国外学者主要是通过珊瑚外部形态和体内含有CaCO3成分的骨针展开肉芝软珊瑚属不同种之间的鉴定[2-7];随着分子系统学的快速发展, France 等(2002)发现许多线粒体基因在八放珊瑚中具有很高的保守性[8],还有学者对肉芝软珊瑚的系统发育学做了大量的工作[9-12].Mcfadden等(2010)利用COI+igr1+msh1条形码对软珊瑚进行种类鉴定,她认为虽然此条形码不够完美,但是对软珊瑚分类学的研究是非常有价值的补充[9].
我国南海地区肉芝软珊瑚资源丰富,药用价值极大,国内关于此种软珊瑚的分类学研究也较少.我国关于此种珊瑚的分类研究始于20世纪80年代,李楚璞(1982、1984)对我国南海地区肉芝软珊瑚进行调查,并在西沙中建岛发现1个新种即分叉肉芝软珊瑚(Sarcophytonfurcatum)[13-14],至今我国共报道肉芝软珊瑚约10种(表1).目前国内对此种珊瑚的分类研究处于停滞状态.分类学家近年来对部分种类的修订并将DNA条形码技术应用于物种鉴定,我国肉芝软珊瑚的资源调查和系统发育学研究尤为迫切.
1 材料与方法
1.1 样品的采集
本研究所用的26个肉芝软珊瑚样品分别采自我国海南省万宁市甘蔗岛(18°45′N, 110°30′E)、大洲岛(18°40′N,110°28′E)和三亚市西瑁岛(18°15′N,109°22′E)3个地区的珊瑚礁区.潜水拍照取样后,将采集的样品保存于70%乙醇溶液中并编号(甘蔗岛:GZ1~8;大洲岛:DZ1~6;西瑁岛:XM1~12)后带回实验室,用于后续的骨针分离和DNA提取.
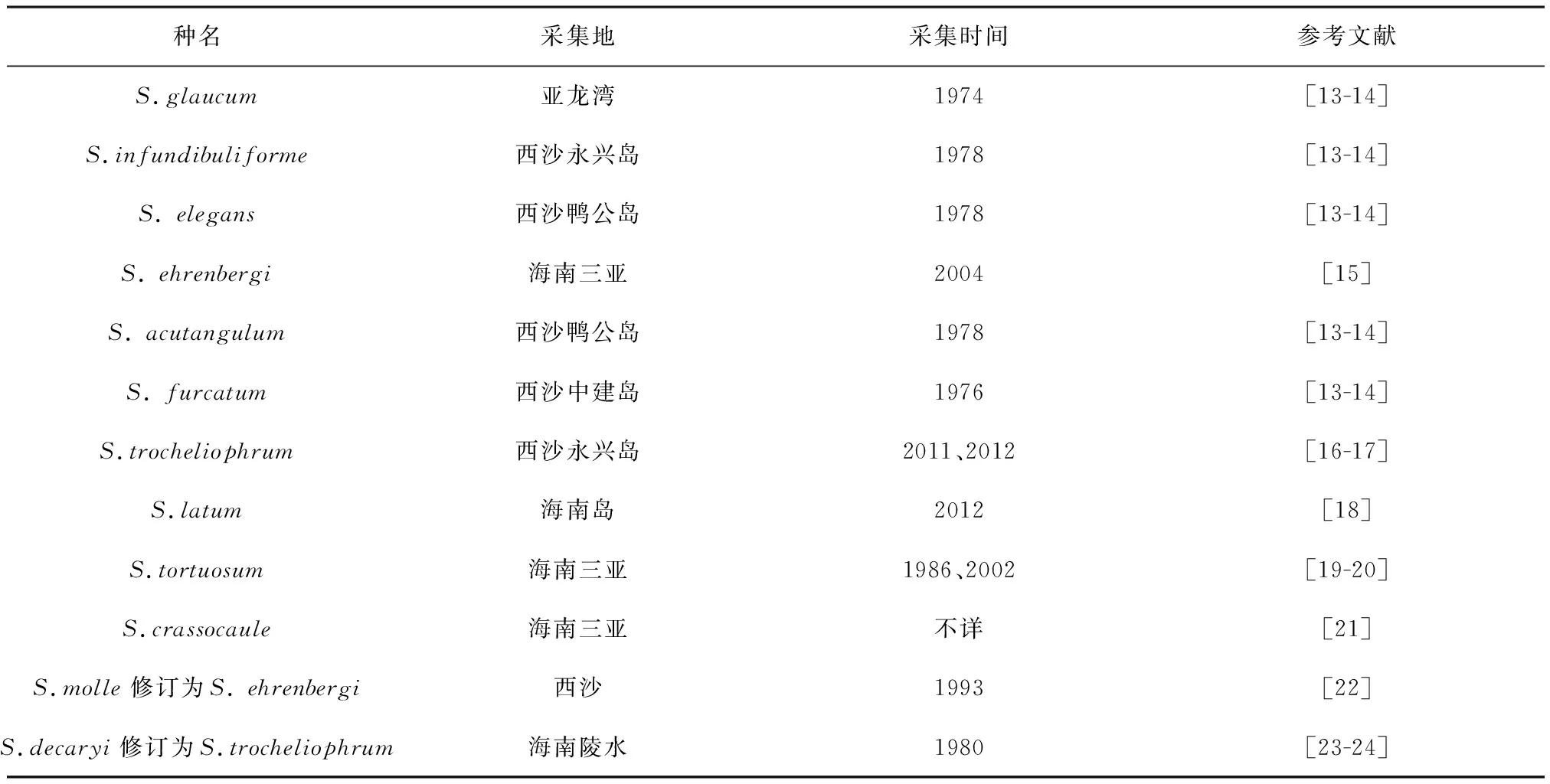
表1 我国南海地区已报道的肉芝软珊瑚种类Tab.1 Recorded Sarcophyton species in the South China Sea
1.2 骨针的提取和扫描电镜拍摄
取肉芝软珊瑚的4个部位(冠部表皮、冠部内组织、茎部表皮、茎部内组织)的小块组织(约1 mm3),放于10%的次氯酸钠(NaClO)溶液中分离骨针[6],然后用超纯水清洗几次,置于1% 的氢氧化钾(KOH)中去除多余的珊瑚组织;利用光学显微镜观察骨针表面无组织的残留后,放置于载玻片上常温干燥,最后用扫描电子显微镜拍照.获得的照片使用Adobe Illustrator CS6和Photoshop CC 2种图片处理软件对样品骨针照片进行处理和组合.本研究中的骨针鉴定参考Verseveldt(1982)、Samimi-Namin等(2009)、Benayahu等(2004、2009、2012)、Verseveldt等(1983)的资料[25-30]进行比对分析.
1.3 DNA提取及PCR扩增
剪取不同样品组织约10 mg,用超纯水反复清洗几次,使用海洋动物组织基因组DNA提取试剂盒(广州,东盛生物科技有限公司)进行样品DNA提取,然后在Micro-volume Spectrophotometer MN-913A(美国,Maestrogen)上测定DNA浓度,然后用于PCR扩增.
PCR扩增msh1基因的引物为:ND42599F(5′-GCCATTATGGTTAACTATTAC-3′)[8], Mut-3458R(5′-TSGAGCAAAAGCCACTCC-3′)[31];扩增COI基因的引物为:COIOCTR(5′-ATCATAGCATAGACCATACC-3′)[8],COII8068F(5′-CCATAACAGGACTAGCAGCATC-3′)[32].反应总体积为25 mm3,扩增的条件为:95℃预变性10 min,运行35个以下循环:95℃变性30 s,50℃退火30 s,72℃延伸50 s,最后72℃延伸10 min.PCR扩增产物送至上海生工生物工程公司广州测序部进行测序.
1.4 序列分析
利用MEGA 7软件中Clustal W对所有序列进行比对和人工编辑,并计算各序列的碱基组成.然后用邻接法(NJ)构建系统发育树,并用Bootstrap工具1 000次循环检验系统发育树.
2 结果与讨论
2.1 骨针分析
结果显示所采集的26个样品分属于5个种,便于种间的区分,将其分别标注为:Sarcophytonsp.1~5 (图1).
2.1.1Sarcophytonsp.1 本研究采集此种个体10个,编号分别为:GZ-1、4、7、8; DZ-2、5;XM-8、10、11、12.外部形态学特征为:呈扁平状,冠部直径为12.0~15.5 cm,高度为8~15 cm,水螅体之间距离为0.5~0.9 mm,水螅体之间有1~3个管状体.如图1所示,Sarcophytonsp.1冠部表层多为棍棒状骨针(图2a—d),头部较宽,长度为0.12~0.23 mm,头部表面有较大的疣状突起,尾部有矮的、刺状突起;冠部内组织有细长的木棍状和棒状骨针(图2e—f),长度为0.16~0.19 mm,表面分布着鹿角状突起.茎部表面骨针多为棒状(图2g—i),头部较宽,长度为0.09~0.15 mm,整个骨针表面都有疣状的突起;茎部内组织骨针为纺锤状(图2j—l),长度为0.30~0.40 mm,表面有圆形、疣状和锥形突起.骨针比对结果显示:Sarcophytonsp.1与Sarcophytonehrenbergi(RMNH Coel. no. 6641)的描述基本一致,但本研究中各个体的茎内部骨针形态变化较大[25].

图1 海南岛附近海域5种肉芝软珊瑚的水下形态照片Fig.1 Underwater photographs for growth morphologies of five Sarcophyton colonies in the coastal waters of Hainan Island a—e:Sarcophyton sp.1~5
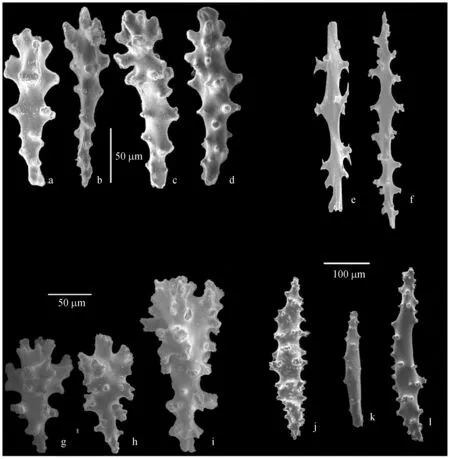
图2 Sarcophyton sp.1骨针形态Fig.2 Sclerites from Sarcophyton sp.1 a—d:冠部表面骨针(左上50 μm标尺);e—f:冠的内部骨针(100 μm标尺);g—i:茎的表面骨针(左下50 μm标尺); j—l:茎的内部骨针(100 μm标尺)
2.1.2Sarcophytonsp.2 本研究采集此种个体8个,编号分别为:GZ-3、6;DZ5、6;XM-2、4、6、9.外部形态学特征为:冠部直径为7~17 cm,高度为5.5~11.5 cm,水螅体之间距离为0.20~0.50 mm,水螅体之间有2~9个管状体.如图3所示,Sarcophytonsp.2冠部表层多为棍棒状骨针(图3a—d),长度为0.11~0.20 mm,头部和尾部都具有疣状突起,头部的突起更明显;冠的内部组织为纺锤状骨针(图3e—f),长度为0.45~0.53 mm,表面分布着不规则的、矮小的锥形和疣状突起.茎部表层的骨针(图3g—j)和冠部表层的骨针外形相似,长度为0.17~0.21 mm;茎的内部组织骨针为较长的(图3k)纺锤形,长达0.70 mm,表面零散的布满了非常小的刺状和疣状的突起.骨针比对结果显示Sarcophytonsp.2与Sarcophytonglaucum(RMNH Coel. no. 13975)的描述基本一致,本研究中各个样品的冠部表层骨针的表面突起较明显,茎的内部骨针突起较少[25].
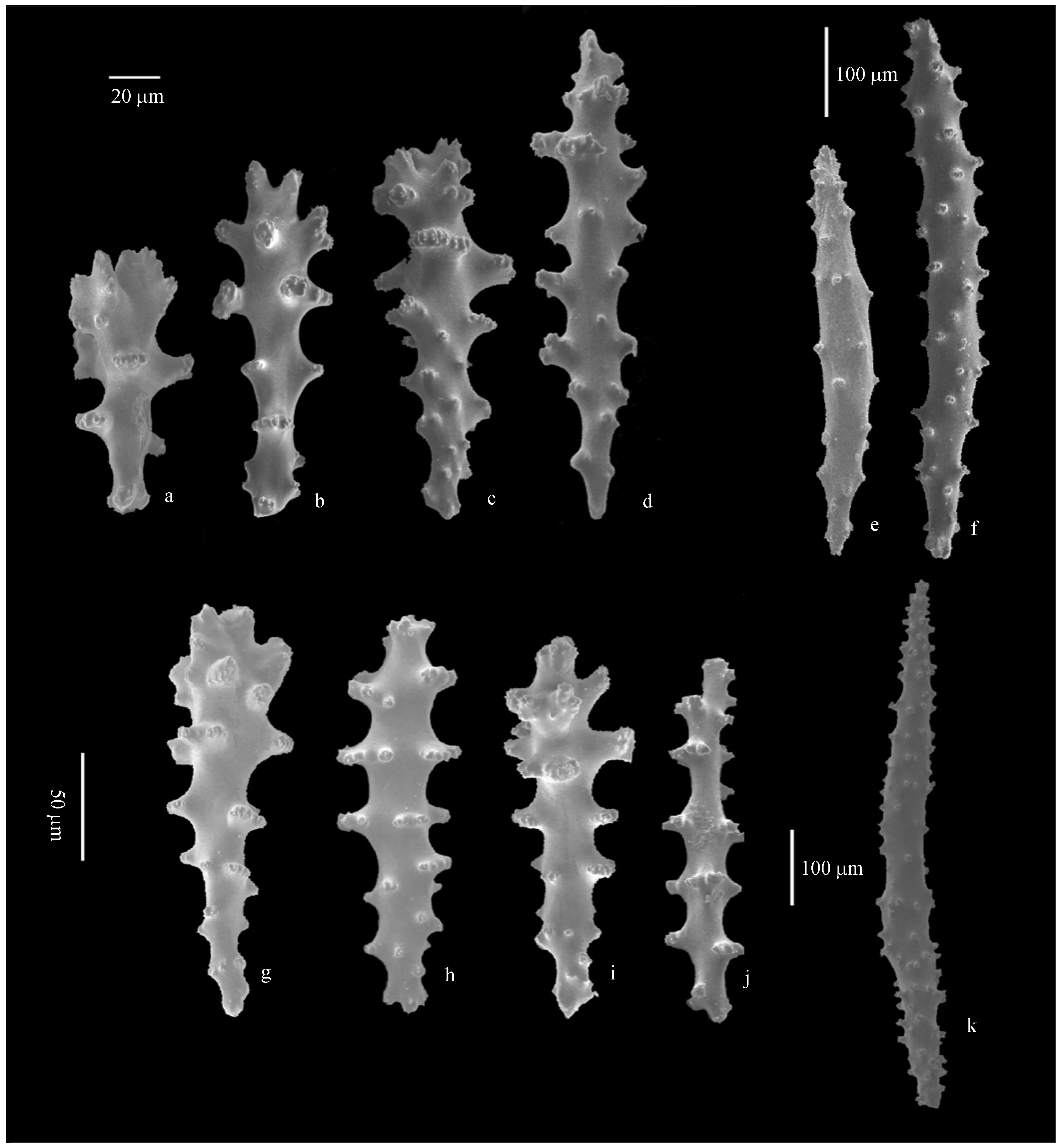
图3 Sarcophyton sp.2骨针形态Fig.3 Sclerites from Sarcophyton sp.2 a—d:冠部表面骨针(20 μm标尺);e—f:冠的内部骨针(右上100 μm标尺);g—j:茎的表面骨针(50 μm标尺); k:茎的内部骨针(右下100 μm标尺)
2.1.3Sarcophytonsp.3 本研究采集此种共3个,编号分别为:DZ-3、 XM5、 XM7.外部形态学特征为:所有个体高度为14~18 cm,冠部直径为14~16 cm;两个水螅体之间的距离为0.3~0.5 mm,且有5~13个管状体.如图4所示,Sarcophytonsp.3冠部表层多为棍棒状骨针(图4a—c),长度为0.20~0.29 mm,头部具有疣状和锥形突起,尾部也有较矮的疣状突起;冠的内部组织为纺锤状骨针(图4e—f),长度为0.51~0.62 mm,其表面具有较小的锥形和疣状突起;茎部表层的骨针(图4g—j)和冠部表层的骨针外形相似,长度为0.15~0.20 mm,头部和尾部都具有疣状和锥形突起,而且比冠部表层的骨针更明显;茎的内部组织骨针为粗的(图4d、k)和细长的(图4l—n)纺锤形,长达1.03 mm,较粗的骨针表面布满了疣状的突起,而细长的骨针表面零散的分布着矮小的刺状突起.骨针比对结果显示Sarcophytonsp.3与Sarcophytoncrassum(MNHN)的描述基本一致[25].

图4 Sarcophyton sp.3骨针形态Fig.4 Sclerites from Sarcophyton sp.3 a—c:冠部表面骨针(中间50 μm标尺);e—f:冠的内部骨针(右上50 μm标尺);g—j:茎的表面骨针 (左下50 μm标尺);d(中间100 μm标尺),k—n:茎的内部骨针(右下100 μm标尺)
2. 1.4Sarcophytonsp.4 本研究采集此种3个,编号分别为:DZ-1、GZ-2、XM-1.外部形态学特征为:所有个体高度为7~19 cm,冠部直径为13.0~18.5 cm;两个水螅体之间的距离为0.4~1.3 mm,并间有1~6个管状体.如图5所示,Sarcophytonsp.4冠部表层骨针为棍棒状和哑铃状,哑铃状在中间的位置有1个明显的无突起区域;骨针长约为0.10~0.24 mm,表面不规则的分布着刺状突起,(图5a—c);冠的内部组织同样为棍棒状骨针,长度为0.20~0.25 mm,表面的圆锥形或者疣状突起更加明显(图5f—g).茎部的表层骨针多为哑铃状,长度约为0.10~0.15 mm,表面有刺状、疣状和叶状突起(图5d—e);茎的内部组织具有特殊的骨针,多为椭圆形或十字形,长度为0.27~0.34 mm,中间收缩,两端分布着多刺的、不规则的疣状突起(图5h—j).骨针比对结果显示Sarcophytonsp.4与Sarcophytontrocheliophorum(ZMH no.C2442)的描述基本一致[25],但两个水螅体之间的距离比Verseveldt(1982)所描述的个体长[25].
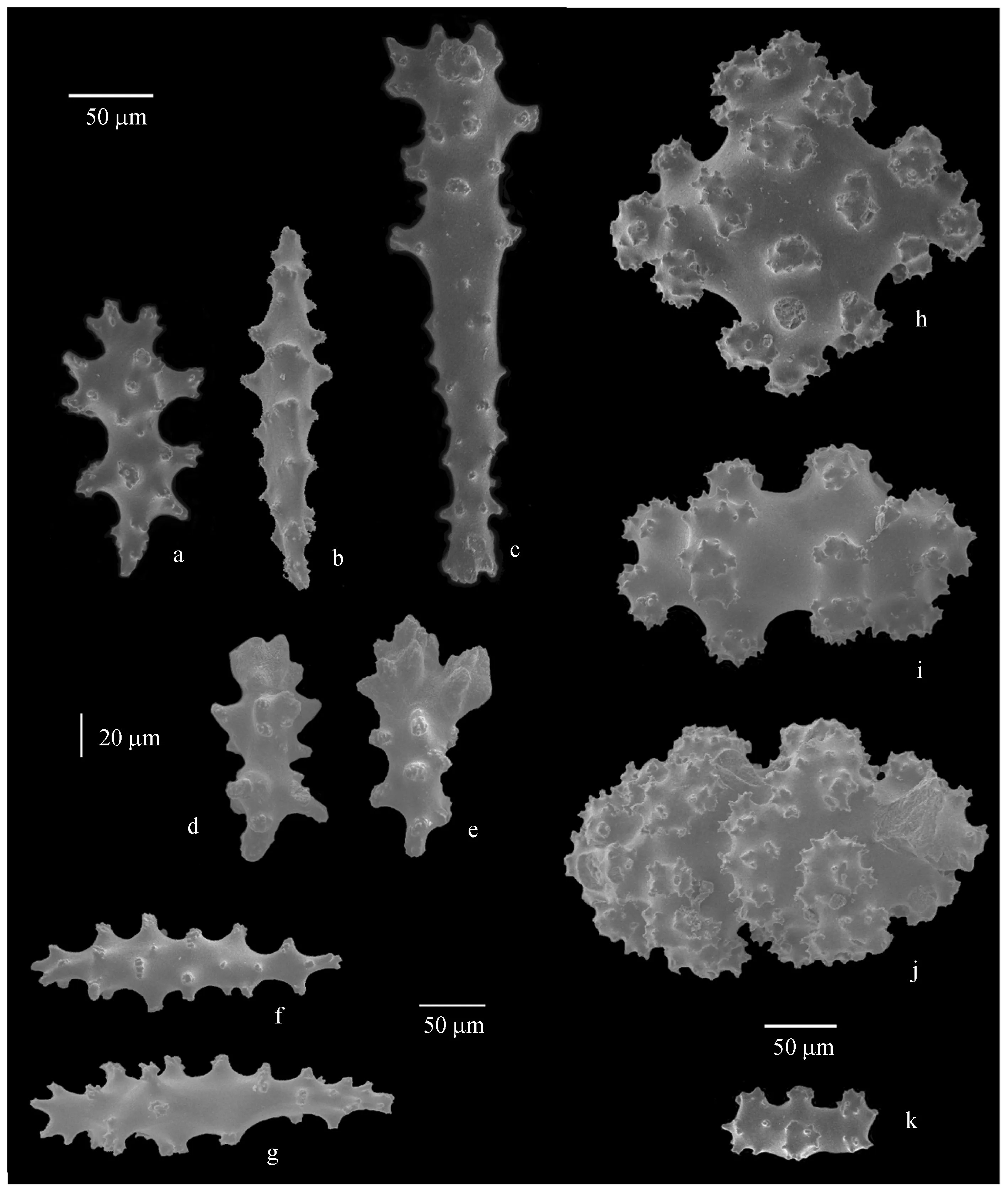
图5 Sarcophyton sp.4骨针形态Fig.5 Sclerites from Sarcophyton sp.4 a—c:冠部表面骨针(左上50 μm标尺);d—e:茎的表面骨针(20 μm标尺); f—g:冠的内部骨针(左下50 μm标尺);h—j:茎的内部骨针(右下50 μm标尺);k:表面疣状突起(右下50 μm标尺)
2. 1.5Sarcophytonsp.5 本研究采集此种2个,编号分别为:GZ5、XM3.外部形态学特征为:所有个体的高度为5~9 cm,冠部直径为9~12 cm,水螅体中心之间的距离为0.1 mm~3.0 mm,两个水螅体之间有4~8个管状体.如图6所示,Sarcophytonsp.5冠部表层骨针为棍棒状,柄部比头部更细,长度为0.15~0.20 mm,表面都有矮的、圆形突起(图6a—d);冠的内部组织骨针形似纺锤状,长度为0.02~0.20 mm,两头有大量的小的圆形突起(图6e).茎部表面的骨片形似冠部表层骨针,长度为0.05 mm~0.20 mm(图6f—g);茎的内部骨针为棍棒状或纺锤状,表面具有非常明显尖的、钝的和疣状的突起,长度可达1.15 mm(图6h—i).骨针比对结果显示Sarcophytonsp.5与Sarcophytoncherbonnieri(MNHN)的描述基本一致,本研究中各样本的冠内部骨针和茎的内部骨针较长[25].
2.2 序列分析
2.2.1 肉芝软珊瑚msh1和COI基因序列组成分析 本研究共获取26条肉芝软珊瑚样品的msh1基因部分片断,将得到的序列提交至GenBank数据库,获得GenBank登录号为MH040740—MH040765,结合19条GenBank下载的肉芝软珊瑚msh1基因序列和1条外群序列Dampiapocilloporaeformis(表2);通过比对和人工编辑,保留共有序列长度为735 bp,所用序列均无碱基插入或缺失.通过对45条肉芝软珊瑚msh1基因序列进行同源性比较分析,发现变异位点165个,简约信息位点115个.所有msh1平均碱基频率为T:34.2%、C:16.1%、A:31.1%、G:18.6%,A+T(65.3%)含量明显高于G+C(34.7%)含量,符合肉芝软珊瑚msh1基因碱基组成特点[33].

图6 Sarcophyton sp.5骨针形态Fig.6 Sclerites from Sarcophyton sp.5 a—d:冠部表面骨针(50 μm标尺);e:冠的内部骨针(50 μm标尺);f—g:茎的表面骨针 (50 μm标尺);h—i:茎的内部骨针(100 μm标尺)
研究共获取26条肉芝软珊瑚样品的COI基因部分片断,将得到的序列提交至GenBank数据库,获得GenBank登录号为:MH152692—MH152717,结合11条GenBank下载的肉芝软珊瑚COI基因序列和1条外群序列Cladiellapachyclados(表2);通过比对和人工编辑,保留共有序列长度约为869 bp,所用序列均无碱基插入或缺失.通过对37条肉芝软珊瑚COI基因序列进行同源性比较分析,发现变异位点92个,简约信息位点80个.所有COI平均碱基频率为T:36.9%、C:17.1%、A:27.4%、G:18.5%,A+T(64.3%)含量明显高于G+C(35.6%)的含量.
表2 海南岛附近海域及Genbank下载肉芝软珊瑚msh1和COI基因序列信息Tab.2 msh1 and COI gene sequence information of Sarcophyton in the coastal waters of Hainan Island and downloaded from Genbank

续表2
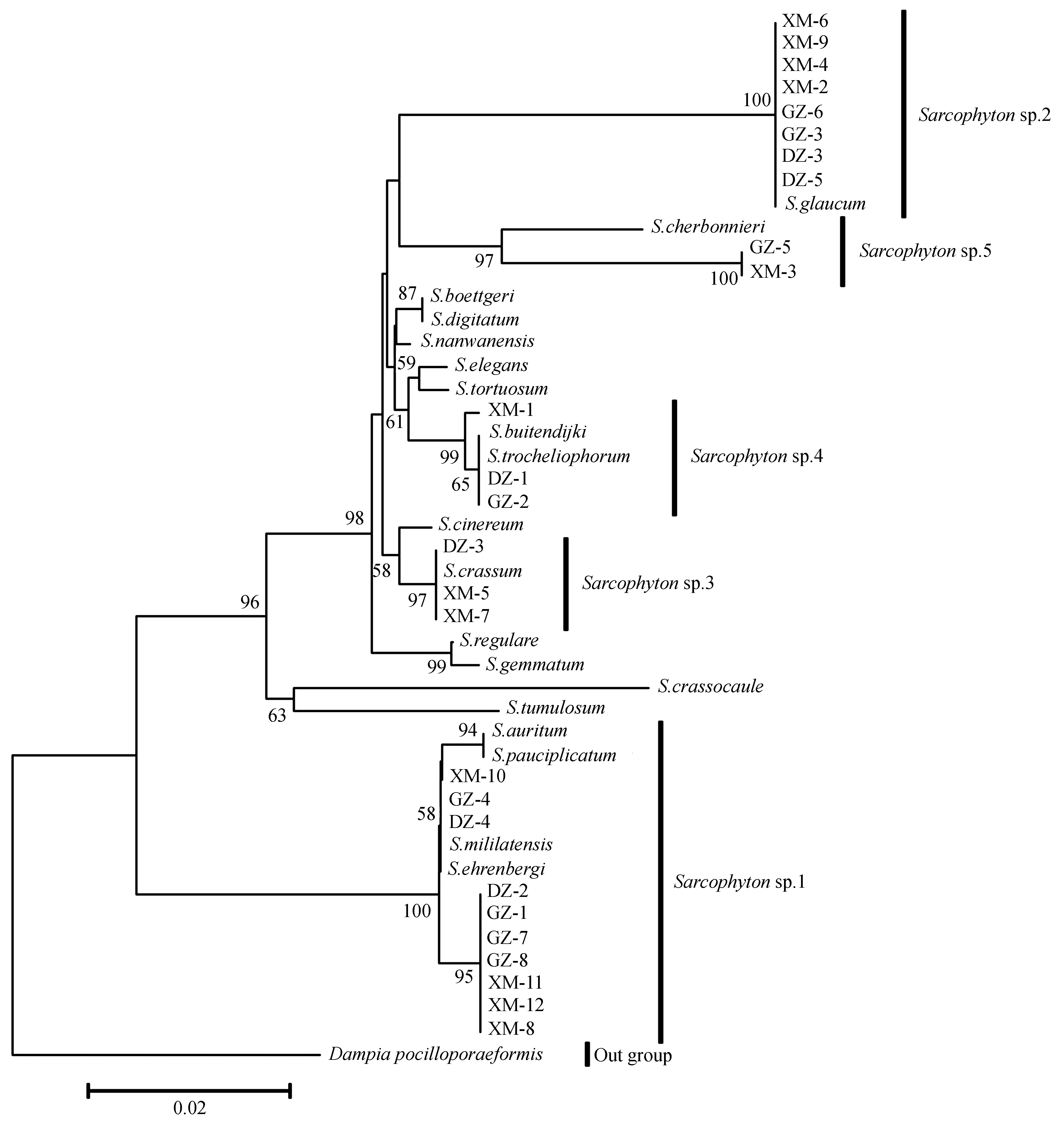
图7 基于msh1基因序列片段的5种肉芝软珊瑚系统进化树(邻接法)Fig.7 Phylogenetic tree based on msh1 gene sequences of five Sarcophyton species(Neighbor-joining)
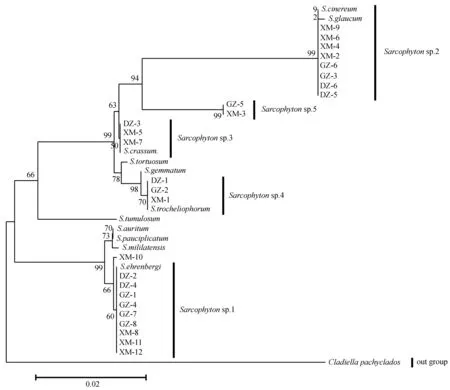
图8 基于COI基因序列片段的5种肉芝软珊瑚系统进化树(邻接法)Fig.8 Phylogenetic tree based on COI gene sequences of five Sarcophyton species (Neighbor-joining)
2.2.2 基于msh1和COI基因序列的肉芝软珊瑚系统学关系 以Dampiapocilloporaeformis为外群,结合本研究获得序列和Genebank下载同属的msh1基因序列; 以Cladiellapachyclados为外群,结合本研究获得序列和Genebank下载同属的COI基因序列.采用邻接法(NJ)分别构建系统进化树(图7、8).2种基因构建的进化树结果基本一致,并能将本研究中所有获得样品区分开来.
基于msh1基因构建的进化树显示,Sarcophytonsp.1中DZ-2、GZ-1、GZ-7、GZ-8、XM-8、XM-11和XM-12聚为一支系,而DZ-4、GZ-4和XM-10与S.ehrenbergi和S.mililatensis聚为一支,其他种都非常明显的可以看出:Sarcophytonsp.2与S.glaucum明显聚为一支;Sarcophytonsp.3和S.crassum聚为一支;Sarcophytonsp.4与S.trocheliophorum和S.buitendijki聚为一支;Sarcophytonsp.5与S.cherbonnieri聚为一支.基于COI基因构建的进化树显示,Sarcophytonsp.1除了XM-10,其他个体都与S.ehrenbergi聚在一起,Sarcophytonsp.2与S.glaucum和S.cinereum聚为一支;Sarcophytonsp.3和S.crassum聚为一支;Sarcophytonsp.4与S.trocheliophorum聚为一支;而Sarcophytonsp.5单独聚为一支.根据进化树分析,基本支持形态学鉴定结果.因此将Sarcophytonsp.1~5分别鉴定为:S.cherbonnieri、S.crassum、S.trocheliophorum、S.glaucum和S.ehrenbergi.
2.3 讨论
肉芝软珊瑚外部形态差异较小,但不同种类软珊瑚的不同部位骨针之间形态差异显著,通过对比分析不同部位的骨针形态来进行种类的鉴定是目前一种常用的软珊瑚鉴定方法.Verseveldt等(1982)通过比对分析肉芝软珊瑚属的骨针形态进行较完整的整理修订,共总结了35个种[25],最近Feussner(2013)从斐济发现了5个新种[1], 至今世界范围内所报道的肉芝软珊瑚属共有51个种[1,25-30].Mcfadden等(2006)认为软珊瑚体内骨针形态丰富、多变,目前根据骨针形态分类存在一定的困难,需要积累大量的经验;对于不同的分类学家骨针形态分析时具有强烈的主观性[6],如Feussner等(2013)和Verseveldt(1982)对部分同一标本的骨针进行了提取分析,结果发现两者的骨针图片不相同[ 1, 25].而在本研究中,通过提取和分析所有个体的骨针后也发现:在一个取样部位,骨针数量多,多数呈现同一种形状,但也会出现少数不同形状对分析产生干扰.因此,软珊瑚骨针的研究还需要更多的工作,或者发现新的方法作为形态学鉴定依据.
随着分子生物学的高速发展,线粒体DNA作为分子标记,已经成为近缘种间群体遗传分化的有力工具[34-36].线粒体DNA也作为分子标记进行软珊瑚科的分类学研究,Pontkingdon等(1997)在Sarcophytonglaucum发现了一种DNA 错配修复蛋白的基因msh1后[33],研究者发现八放珊瑚线粒体DNA在种间差异较小,不太适合系统发育学研究[37].Mcfadden等(2010)后来发现虽然线粒体DNA在八放珊瑚中作为DNA条形码具有一定的局限性,但是目前针对肉芝软珊瑚,COI+igr1+msh1是较好的用于种类区分的DNA条形码[9].本研究通过msh1基因和COI基因进行分析发现发现msh1基因和COI基因对部分种任然难以区分,可能存在同种异名的可能[6],因此还需要发现具有较高区分度的DNA条形码对肉芝软珊瑚进行较全面的系统分类学研究.
本研究首先进行的骨针形态学的比对,将采集的样品归为5种,然后采用分子标记对上述结果进行验证.Sarcophytonsp.3和Sarcophytonsp.5通过形态学能够清楚的鉴定其种类,并且分子进化树分析也支持了此结果.Sarcophytonsp.1的外部形态及骨针形态的比对分析表明,它与S.ehrenbergi的骨针形态一致,而基于msh1基因进化树分析发现,它与S.ehrenbergi和S.mililatensis2个种聚为一支,但是基于COI基因进化树能够明显将这2种区分开,除了XM-10外,其他种都与S.ehrenbergi聚为一支.McFadden(2006)通过分子系统学发现以上2种是Sarcophyton和Lobophytum的混合系群,在分子进化的角度任然较难区分[6],最终通过形态学结果,将Sarcophytonsp.1初步鉴定为S.ehrenbergi.在对Sarcophytonsp.2骨针形态进行分析时,发现其冠部表面骨针和茎的内部骨针形态与Verseveldt报道的有偏差, Verseveldt也曾发现以前报道的S.glaucum茎的内部的骨针形状和尺寸变化很大,导致很多研究者命名为新种[25],而这些新种其实同属于S.glaucum.但是通过2个基因进化树分析可以发现Sarcophytonsp.2与S.glaucum聚为一支,最终我们将此种鉴定为S.glaucum.Sarcophytonsp.4的骨针形态与S.trocheliophorum种的骨针形态基本一致,但是在msh1进化树分析时却与S.trocheliophorum和S.buitendijki聚为一支,在COI基因进化树中Sarcophytonsp.4也与S.trocheliophorum明显聚为一支,由于在Genebank中并没有S.buitendijki的COI序列数据,不能确定与S.buitendijki的进化关系,最终将Sarcophytonsp.4鉴定为S.trocheliophorum.根据鉴定结果可以发现,很多形态学结果能够清晰的将不同种类鉴定,可是还存在很多种类不能够准确的区分,导致比较多的新种的发现[25],而通过DNA条形码技术却能够将某些容易混淆的种类做出明显的区分,所以在肉芝软珊瑚的鉴定工作中,应该以形态学为主,分子系统学为辅助的方法来进行肉芝软珊瑚多样性的研究.
3 结论
本研究首次通过形态学结合msh1基因和COI基因序列分析,对采集于海南省三亚市西瑁岛、万宁市甘蔗岛和大洲岛珊瑚礁区的26个肉芝软珊瑚样品进行种类鉴定,最终将采集到的26个肉芝软珊瑚样品初步鉴定为5个种,这些种与我国南海地区已报道的肉芝软珊瑚种类部分吻合(表1),发现2个在我国南海的新记录种SarcophytoncherbonnieriTixier-Durivault, 1958和SarcophytoncrassumTixier-Durivault,丰富了我国肉芝软珊瑚的种类.但由于采样不全面,本研究不能得出这3个地区软珊瑚的完整的分布情况.我国南海地区软珊瑚种类丰富,国内只有在上个世纪通过形态学开展过软珊瑚的资源调查[13-14],而随着分子生物学在生物学各个方面的应用,利用DNA条形码技术进行分子系统学研究越来越广泛[35],因此急需进一步展开南海其他海区软珊瑚种类的鉴定和资源调查工作,本研究为今后的肉芝软珊瑚鉴定和生物多样性研究提供基础数据.

