基于网络药理学预测黄芪抗肝癌的有效成分及其潜在靶点Δ
王 丹,王 建,高思佳,2,徐 卓,2,王莹莹,2,王 涛,2,魏士长,2,赵艳玲
(1.成都中医药大学药学院,四川 成都 611137; 2.解放军总医院第五医学中心药学部,北京 100039)
肝癌是世界范围内死亡率最高的恶性肿瘤之一,近20年来其死亡率呈逐年升高趋势[1]。据统计,2015年我国恶性肿瘤中,肝癌患病率居第4位,死亡率居第3位[2]。中医辨证发现,肝癌的证型多为气滞血瘀证,其次为肝郁脾虚证;有学者从中医单一证型的角度,将临床常用的肝癌证型拆开,对单证进行统计分析,发现气滞证出现频率最高,其次为血瘀证、脾气虚证等[3]。黄芪为传统中药,始载于《神农本草经》,其味甘、性温,归肺、脾经,具有补气升阳、固表止汗、脱毒生肌和利水消肿等功效,与肝癌的治则相符;同时,大量研究结果表明,黄芪所含的黄芪多糖、黄酮类及皂苷类等成分具有抗肿瘤作用[4-7]。但目前对于黄芪治疗肝癌的作用及机制研究较为缺乏,故本研究拟应用网络药理学方法,分析及预测黄芪抗肝癌的有效成分及潜在靶点,以期为后续实验研究及临床用药提供参考。
1 资料与方法
1.1 黄芪药物靶点筛选
通过中草药综合数据库(traditional Chinese medicine database @Taiwan,TDT)(http://tcm.cmu.edu.tw/)获得黄芪所含的活性成分化学结构,再通过中草药活性成分数据库(herbal ingredients’ targets database,HIT)(http://lifecenter.sgst.cn/hit/)和治疗靶点数据库(therapeutic target database,TTD)(http://bidd.nus.edu.sg/group/cjttd/)进行靶点筛选,建立中药黄芪的药物靶点数据集[8]。
1.2 肝癌疾病靶点筛选
通过人类孟德尔遗传综合数据库(online mendelian inheritance in man,OMIM)(http://www.omim.org/)筛选肝癌相关基因和蛋白靶点,建立肝癌靶点数据集,其中靶点连接蛋白通过交互蛋白数据库(database of interacting protein,DIP)(http://dip.doe-mbi.ucla.edu)获得[8]。为便于分析,均将上述所有靶点转化为Uniprot数据库识别码格式。
1.3 “成分-靶点-疾病“交互网络的构建与分析
为进一步探索中药黄芪的活性成分与肝癌靶点之间的相互关系,将搜集到的上述黄芪化合物成分、药物作用靶点和疾病作用靶点通过“蛋白-蛋白”交互信息数据库(protein-protein interaction,PPI)进行分析,将分析结果导入Cytoscape 3.6.1软件进行可视化分析,并对各靶点的相关参数进行分析。
1.4 京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路注释分析
将“1.3”项下所得的直接作用靶点的UniProt数据库识别码导入功能注释工具DAVID中进行KEGG通路注释分析,得出交互网络中的直接作用靶点相关通路。
2 结果
2.1 黄芪和肝癌的靶点筛选
基于数据库构建方法,本研究共筛选出44个黄芪化学成分和271个直接作用靶点,10个肝癌直接作用靶点和553个交互蛋白靶点,以上获得的药物靶点被用来进一步构建“成分-靶点-疾病”网络。
2.2 网络构建和通路分析
为全面客观地揭示黄芪抗肝癌的可能有效成分及潜在的作用靶点,对上述数据进行网络药理学分析,构建“成分-靶点-疾病”交互网络并进行可视化分析,使黄芪抗肝癌的复杂网络呈现出来,并对各靶点的相关参数进一步分析,见图1—2(图1中,三角形代表黄芪中可能的有效活性成分,圆形代表药物与疾病的作用靶点,方形为药物和疾病共同直接作用的靶点)。经分析,共筛出13个黄芪抗肝癌的主要活性成分和6个直接作用靶点,见表1—2。表2中所列的直接作用靶点白细胞介素6、细胞肿瘤抗原p53、肝药酶CYP3A4、丝裂原活化蛋白激酶14、细胞周期素A2和肝药酶CYP2A6均满足筛选调节,故认为这6个蛋白是黄芪抗肝癌的重要蛋白。

图1 黄芪治疗肝癌的“成分-靶点-疾病”交互网络Fig 1 Interactive network of “compound-target-disease” of Astragalus in treatment of liver cancer
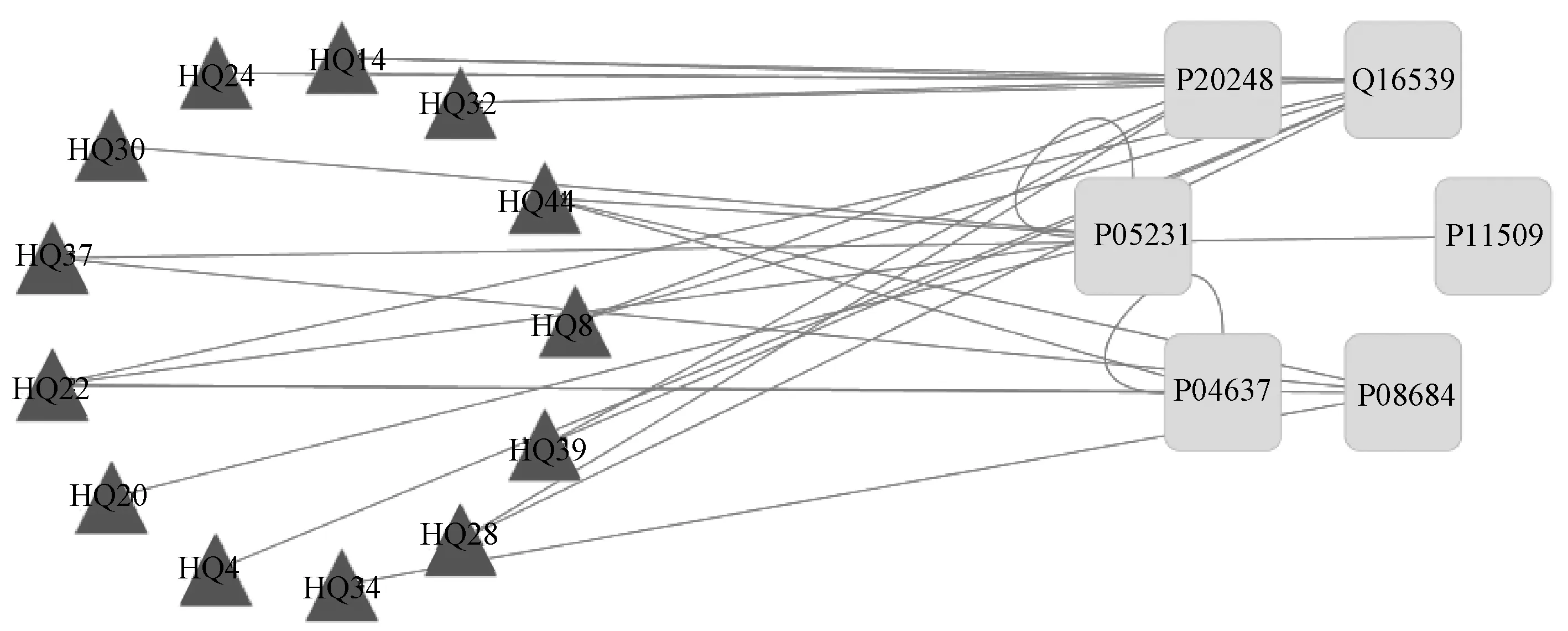
图2 黄芪治疗肝癌的直接作用靶点一级“成分-靶点-疾病”交互网络Fig 2 Direct targets of the first class interactive network of “compound-target-disease” of Astragalus in treatment of liver cancer
2.3 KEGG通路分析
采用KEGG通路注释分析,得出黄芪抗肝癌直接作用靶点相关通路共14条,分别为“Hepatitis B”(乙型肝炎)、“Epstein-Barr virus infection”(Epstein-Barr病毒感染)、“Drug metabolism-other enzymes”(药物代谢-其他酶)、“NOD-like receptor signaling pathway”(核苷酸结合寡聚化结构域样受体信号通路)、“Retinol metabolism”(视黄醇代谢)、“Drug metabolism- cytochrome P450”(肝药酶CYP)、“Metabolism of xenobiotics by cytochrome P450”(肝药酶CYP代谢外源性物质)、“Chemical carcinogenesis”(化学致癌作用)、“TNF signaling pathway”(肿瘤坏死因子信号通路)、“Toll-like receptor signaling pathway”(Toll样受体信号通路)、“Sphingolipid signaling pathway”(鞘脂信号通路)、“Neurotrophin signaling pathway”(神经营养因子信号通路)、“Cell cycle”(细胞周期)、和“Hepatitis C”(丙型肝炎),均表现为直接或间接的肝癌相关,见图3。

表1 黄芪治疗肝癌的主要活性成分Tab 1 The main active components of Astragalus in treatment of liver cancer
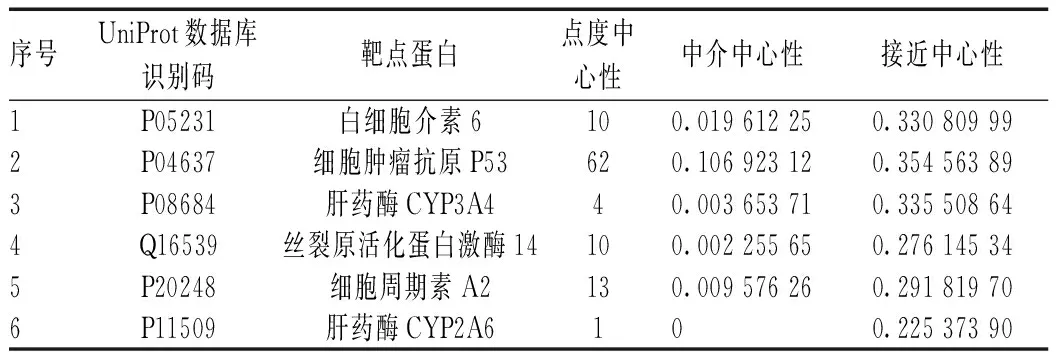
表2 黄芪治疗肝癌的“成分-靶点-疾病”交互网络中直接作用靶点的拓扑参数分析Tab 2 Topological parameter analysis of direct targets of the first class interactive network of “compound-target-disease” of Astragalus in treatment of liver cancer
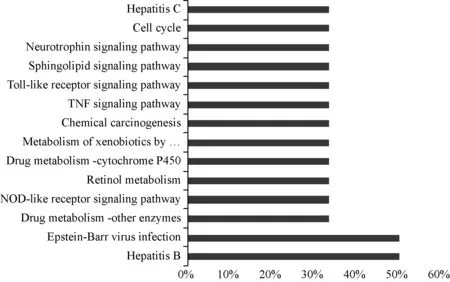
图3 黄芪治疗肝癌直接作用靶点的通路分析Fig 3 Pathway analysis of direct target of Astragalus in treatment of liver cancer
3 讨论
肝癌的发病原因及确切分子机制尚不完全清楚,目前认为其发病是多因素、多步骤的复杂过程,对该疾病的治疗以西医手段为主,但存在诸多局限性,如目前治疗原发性肝癌最有效、临床应用最广泛的根治性措施肝切除术,术后恢复期长且复发率较高,术后3年复发率为50%,术后5年复发率为70%;同时,治疗常用的放化疗手段具有较大的不良反应,且长期应用化疗药易产生耐药性[9]。中医药具有多靶点、多环节和多效应的作用特点,大量实验研究结果和临床实践表明,中医药是调动机体免疫功能和整体抗病能力的全身性治疗方法,越来越多中药的天然有效成分及其提取物被发现有助于治疗肿瘤等疾病[9]。黄芪为临床常用的补益类中药,其有补脾益气、利水退肿、固表止汗及脱毒生肌的功效,与中医治疗肝癌的治则“益气健脾活血”相符;且在临床常用的治疗肝癌的中药方剂中,黄芪的出现频率排序居前10位。但目前对于黄芪抗肝癌的研究较少,对于其作用的主要活性成分及作用机制研究则更为缺乏。
网络药理学整体性、系统性的特点与中医药整体观、辨证论治及组方配伍的原则一致[10]。故本研究采用网络药理学方法,初步探索了黄芪抗肝癌的可能有效成分及潜在作用机制。结果显示,白细胞介素6、细胞肿瘤抗原p53、肝药酶CYP3A4、丝裂原活化蛋白激酶14、细胞周期素A2和肝药酶CYP2A6为黄芪治疗肝癌的直接作用靶点。其中,细胞肿瘤抗原p53是一种重要的抑癌基因,其编码的p53蛋白能够调节细胞周期、DNA修复、凋亡和信号转导;研究结果表明,p53基因的变异和乙型肝炎病毒基因组中的X基因及其表达产物(HBxAg)-p53的相互作用均与乙型肝炎相关性肝细胞癌的发病机制密切相关[11-12]。肝药酶CYP在肝脏代谢中起着重要作用,相关基因表达下降可能导致致癌物的活性增加,其涉及原发性肝癌的发生发展过程[13]。丝裂原活化蛋白激酶信号传导通路存在于大多数细胞内,该通路能将胞外刺激信号转导至胞内,并引起细胞生物学反应如生长、分化、转化及凋亡,在肝脏肿瘤的发生发展中起着举足轻重的作用[14]。
本研究基于网络药理学,预测出黄芪治疗肝癌13个可能的活性成分及6个抗肝癌的潜在作用靶点,初步揭示了黄芪抗肝癌可能的作用网络,为黄芪抗肝癌的进一步实验研究及临床应用提供了参考。

