2型糖尿病患者25-羟维生素D水平与糖尿病肾病关系的研究
毛盛程 丁丽青 吴翔 陈丽莉


[摘要] 目的 探討2型糖尿病患者(T2DM)中25-羟维生素 D[25(OH)D]水平与糖尿病肾病(DKD)的相关性。 方法 选取 2017年1月~2018年12月于我院内分泌科住院T2DM患者432例,根据尿白蛋白/尿肌酐比值(UACR)定义蛋白尿水平,分为正常蛋白尿组(UACR<30 mg/g)、微量蛋白尿组(30 mg/g≤UACR<300 mg/g)和大量蛋白尿组(UACR≥300 mg/g),分析25(OH)D与 UACR 的关系。 结果 正常蛋白尿组、微量蛋白尿组和大量蛋白尿组的25(OH)D水平存在显著性差异,呈下降趋势。Pearson相关性研究性显示25(OH)D水平与患者UACR、年龄、收缩压(SBP)呈显著负相关,与高密度脂蛋白(HDL-C)、血钙(SCa)呈显著正相关。Logistic 回归分析显示,25(OH)D不足组的蛋白尿发生风险较25(OH)D正常组增加57%[OR值1.57,95%CI(1.29~2.11),P=0.002],25(OH)D缺乏组的蛋白尿发生风险较25(OH)D正常组增加99%[OR值1.99,95%CI(1.18~2.32),P=0.004];同时,糖尿病病程、糖化血红蛋白(HbA1c)、收缩压(SBP)、血尿酸(SUA)是T2DM患者蛋白尿发生的影响因素。 结论 血清25(OH)D与T2DM患者的蛋白尿发生相关,可能是其保护因素。
[关键词] 2型糖尿病;25-羟维生素D;糖尿病肾病;蛋白尿
[中图分类号] R587.1 [文献标识码] B [文章编号] 1673-9701(2019)34-0046-05
Relationship between 25-hydroxyvitamin D levels and diabetic nephropathy in patients with type 2 diabetes
MAO Shengcheng DING Liqing WU Xiang CHEN Lili
Department of Endocrinology, Zhejiang Provincial Tongde Hospital, Hangzhou 310012, China
[Abstract] Objective To investigate the relationship between 25-hydroxyvitamin D[25(OH)D] levels and diabetic nephropathy (DKD) in patients with type 2 diabetes mellitus (T2DM). Methods A total of 432 patients with T2DM hospitalized in the Department of Endocrinology of our hospital from January 2017 to December 2018 were enrolled and divided into the normal proteinuria group(UACR<30 mg/g), micro-proteinuria group(30≤UACR <300 mg/g) and massive proteinuria group (UACR≥300 mg/g) according to the proteinuria level defined by urinary albumin/creatinine ratio (UACR). The relationship between 25(OH) D and UACR was analyzed. Results There were significant differences in the 25(OH)D levels among the normal proteinuria group, the micro-albuminuria group and the massive proteinuria group, presenting a downward trend. It was found by Pearson correlation studies that 25(OH)D levels were significantly and negatively correlated with UACR, age and systolic blood pressure (SBP) of patients, and were significantly and positively correlated with high-density lipoprotein (HDL-C) and serum calcium (SCa).It was found by Logistic regression analysis that the risk of having proteinuria in the 25(OH)D-deficient group was 57% higher than that in the 25(OH)D normal group [OR=1.57, 95%CI (1.29-2.11), P=0.002]. The risk of having proteinuria in the 25 (OH)D-lack group was 99% higher than that in the 25 (OH)D normal group [OR=1.99, 95%CI (1.18-2.32), P=0.004]. At the same time, duration of diabetes, glycosylated hemoglobin (HbA1c), systolic blood pressure (SBP) and serum uric acid (SUA) were factors influencing the occurrence of proteinuria in patients with T2DM. Conclusion Serum 25(OH)D is associated with occurrence of proteinuria in patients with T2DM, which may be a protective factor.
[Key words] Type 2 diabetes; 25-hydroxyvitamin D; Diabetic nephropathy; Proteinuria
随着经济发展、社会老龄化加速、生活方式改变,2型糖尿病(T2DM)的患病率呈上升趋势,最新国际糖尿病联盟(IDF)调查发现,截止至2017年,全球约4.25亿成人患糖尿病,占总人口的8.8%,预计到2045年,糖尿病患者可能达到6.29亿,其中我国2017约有1.144亿糖尿病患者,位居全球首位[1]。糖尿病肾病(DKD)是T2DM最常见的微血管并发症之一,是导致慢性肾脏病(CKD)和终末期肾病(ESRD)的主要原因[2]。维生素D及其代谢产物25-羟维生素D(25(OH)D)不仅调节钙磷代谢,在骨骼代谢方面起重要作用,还可通过调节内分泌激素、免疫系统、细胞增殖、细胞分化等方面,在糖尿病、肥胖、肿瘤、心血管疾病、自身免疫相关疾病等的发生发展中起重要作用[3]。
近年来维生素D和糖尿病及其并发症的关系日益受到关注。国外流行病学研究显示T2DM患者中25(OH)D的缺乏发生率显著高于非糖尿病患者,且在伴有DKD的T2DM患者中,血清25(OH)D水平进一步下降[4-5]。另有临床研究显示,在伴DKD的T2DM患者中,25(OH)D缺乏与其复合终点风险增高独立相关[6]。Mehrotra Rajnish等[7]报道,在非透析慢性肾脏病患者中,血清25(OH)D浓度小于15 ng/mL的患者的全因死亡率显著高于血清25(OH)D浓度大于30 ng/mL的患者。然而,日本的一项临床研究显示T2DM患者的慢性肾脏病发生风险与血清1,25-二羟维生素D3(1,25(OH)2D)显著相关,而非25(OH)D[8]。美国的一项临床研究也得出类似结果,糖尿病患者肾小球滤过率(eGFR)水平与25(OH)D无关,而与1,25(OH)2D水平显著相关[9]。
25(OH)D对T2DM患者蛋白尿的影响可能与地理、种族、肤色差异有关。中国作为糖尿病人数最多的国家,糖尿病肾病发病率极高,本研究通过回顾性分析T2DM患者25(OH)D水平与蛋白尿的关系,为DKD的临床防治工作提供依据。
1 资料与方法
1.1 一般资料
选取2017年1月~2018年12月于我院住院的432例T2DM患者作为研究对象。入选标准:(1)研究对象均符合《中国2型糖尿病防治指南(2017年版)》[10]中2型糖尿病患者诊断标准。(2)研究对象均签署知情同意书,并自愿加入本次研究中。排除标准:1型糖尿病、3个月内发生糖尿病急性代谢并发症、严重肝脏疾病、其他类型肾脏疾病、急慢性感染、骨质疏松、长期服用影响骨代谢药物者。蛋白尿分组标准:根据UACR为蛋白尿分组诊断标准。(1)正常蛋白尿组:UACR<30 mg/g;(2)微量蛋白尿组(MAU):30 mg/g≤UACR<300 mg/g;(3)临床蛋白尿组(CAU):UACR≥300 mg/g[11]。25(OH)D水平分组标准:(1)25(OH)D正常组:25(OH)D水平>30 ng/mL;(2)25(OH)D不足组:25(OH)D为20~30 ng/mL;(3)25(OH)D缺乏组:25(OH)D<20 ng/mL[12]。
1.2 方法
查询所有患者的病史,详细记录患者的性别、年龄、糖尿病病程、吸烟情况、ACEI或者ARB类药物使用情况等。测量身高、体重、收缩压(SBP)、舒张压(DBP)、腰围等,计算体重指数(BMI)。研究对象禁食8 h后于次日清晨采静脉血。采用罗氏8000全自动生化仪测定血糖、SCa、尿素氮(BUN)、血肌酐(Scr)、总胆固醇(TC)、甘油三酯(TG)、HDL-C和低密度脂蛋白胆固醇(LDL-C)等。采用MQ-2000PT全自动分析仪测定糖化血红蛋白(HbA1c)。留取患者晨尿,采用免疫散色比浊法测定尿微量白蛋白。患者清晨空腹采取静脉血5 mL,离心取血清,采用德国罗氏2010型全自动电化学发光免疫分析仪测定25(OH)D。
1.3 统计学方法
采用SPSS 22.0统计软件进行统计学分析。正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用方差分析;非正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用秩和检验;计数资料以[n(%)]表示,组间比较采用χ2检验。25(OH)D与各指标相关性分析采用Pearson相关分析。以蛋白尿发生可能相关因素作自变量,包括25(OH)D水平、性别、年龄、糖尿病病程、吸烟史、ACEI或ARB类药物服用情况、HbA1c、SBP、腰围、BMI、TG、HDL-c、LDL-c、SUA、SCa、PTH等,单因素二元Logistic回归分析蛋白尿发生影响因素;以单因素Logistic回归分析有意义的变量作自变量,作多因素二元Logistic回归分析蛋白尿发生影响因素。以P<0.05或P<0.01为差异有统计学意义。
2 结果
2.1 不同蛋白尿组临床资料比较
纳入本研究的人群共432例,其中正常蛋白尿组181例(占48.90%),微量蛋白尿组194例(占44.90%),大量蛋白尿组57例(占13.20%)。随着蛋白尿水平升高,患者年龄、糖尿病病程、BMI、SBP、ACEI或ARBs使用率、HbA1c、SUA等顯著性升高(P<0.01)。见表1。
2.2 不同蛋白尿组的25(OH)D水平比较
将本研究的432例T2DM患者根据蛋白尿水平分为三组,其正常蛋白尿组、微量蛋白尿组和大量蛋白尿组的25(OH)D水平分别为(34.12±4.32)ng/mL、(28.16±3.21)ng/mL、(18.42±4.61)ng/mL,三组间比较存在显著性差异,呈下降趋势(F=13.56,P<0.01)。
2.3 T2DM患者25(OH)D水平与各指标的相关性分析
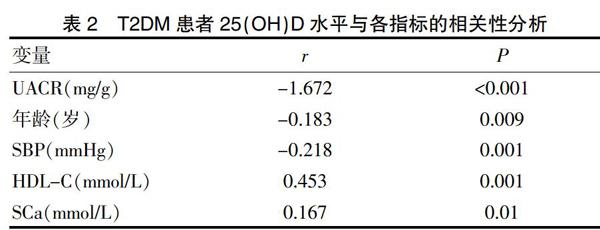
Pearson相关性研究性显示,25(OH)D水平与患者UACR、年龄、SBP呈显著负相关,与HDL-C、SCa呈现显著正相关性。见表2。
2.4 T2DM患者蛋白尿发生的影响因素分析
2.4.1 2型糖尿病患者蛋白尿发生的单因素Logistic回归分析 分析T2DM患者蛋白尿发生的影响因素,以是否发生蛋白尿为因变量,分别将25(OH)D水平、性别、年龄、糖尿病病程、吸烟史、ACEI或ARB类药物服用情况、HbA1c、SBP、腰围、BMI、TG、HDL-C、LDL-C、SUA、SCa、PTH等作自变量,行单因素二元Logistic回归分析,结果显示:25(OH)D水平、年龄、糖尿病病程、吸烟、HbA1c、SBP、腰围、BMI、SUA是T2DM患者蛋白尿发生的影响因素。见表3。
2.4.2 2型糖尿病患者蛋白尿发生的多因素Logistic回归分析 以单因素Logistic回归分析有意义的变量作自变量,以是否发生蛋白尿为因变量,作多因素二元Logistic回归分析,结果显示:25(OH)D不足组的蛋白尿发生风险较25(OH)D正常组增加57%[OR值1.57,95%CI(1.29~2.11),P=0.002],25(OH)D缺乏组的蛋白尿发生风险较25(OH)D正常组增加99%[OR值1.99,95%CI(1.18~2.32),P=0.004];同时,性别、糖尿病病程、HbA1c、SBP、HDL-C、SUA是T2DM患者蛋白尿发生的影响因素。见表4。
3 讨论
糖尿病及其并发症发病率、致死率极高,已成为全球人口面临的共同难题。而DKD作为最常见的糖尿病慢性微血管并发症之一,在发达国家已成为ESRD患者透析和肾移植的主要原因[1-2]。维生素D是一类脂溶性维生素,属类固醇化合物,目前全球维生素D不足和缺乏呈高发病趋势,约10亿人口存在维生素D不足[13]。
本研究结果显示正常蛋白尿组、微量蛋白尿组和大量蛋白尿组的25(OH)D水平存在显著性差异,呈下降趋势;同时,二元Logistic回归分析显示,25(OH)D不足和缺乏是T2DM患者蛋白尿发生的独立危险因素。此结果与以往的许多研究结果相一致。Cigolini M等[14]研究发现:非糖尿病患者的1,25(OH)2D缺乏和不足的发生率明显低于糖尿病肾病患者,提示1,25(OH)2D的缺乏与不足与DKD的发生发展相关。第三次国家健康和营养调查报告(NHANES Ⅲ调查)显示,维生素D缺乏和不足与肾病发病独立相关[15]。另外,Diaz VA等[16]对1216例T2DM患者进行横断面研究,结果显示伴DKD的T2DM患者具有较高比例的25(OH)D缺乏发生率,在调整年龄、性别、种族、高血压等影响因素后,25(OH)D缺乏和不足是糖尿病肾病的独立危险因素。
Pearson相关性研究显示,25(OH)D水平与患者UACR呈显著负相关,提示25(OH)D可能与蛋白尿的发生发展相关。Huang Y等[17]研究发现在T2DM患者中,伴有蛋白尿的患者25(OH)D水平下降,且每日补充常规剂量维生素D可减少蛋白尿的产生。国外一项随机对照临床试验显示,口服骨化三醇可减少尿蛋白患者的蛋白尿水平[18]。同时,动物试验也显示,外源性补充25(OH)D能减缓肾小球硬化,延缓蛋白尿进展,减少足细胞丢失和肥厚[19]。
维生素D对肾脏的保护作用机制尚未明确,可能与以下因素相关:首先,维生素D可抑制肾素血管紧张素系统(RAS系统),多项动物实验研究[20-21]表明活性维生素D可抑制肾素基因转录过程,使细胞内肾素mRNA水平下降,从而减少肾素合成;另外,活性维生素D可使维生素D核受体介导的核因子κB途径激活,抑制RAS系统。其次,维生素D还可避免损害肾脏足细胞,研究发现维生素D治疗可减少足细胞早期损伤标志物的表达,减轻肾小球肥大,增加肾小球足细胞的数量[22]。再次,维生素D可减少慢性炎症损害:活性维生素D可减少TNF-α、单核细胞IL-6、IL-12等炎性细胞因子的产生,降低炎症反应[23]。再次,维生素D可抑制细胞因子途径,25-羟维生素D可通过调节结缔组织生长因子及转化生长因子β基因转录过程起到肾脏保护作用[24]。
虽有大量研究显示维生素D水平与DKD的发生发展密切相关,但两者的因果关系尚无定论。维生素D可通过上述多种机制影响肾脏疾病的发生发展,然而慢性肾脏疾病也可增加维生素D缺乏和不足的发生风险。肾脏1α-羟化酶是25(OH)D转化为1,25(OH)2D,即维生素D的活化过程的关键酶,研究显示CKD患者肾脏1α-羟化酶的储备减少[25]。另外,血液中维生素D的主要载体蛋白是维生素D结合蛋白,DKD患者尿中丢失该结合蛋白,从而导致维生素D储备功能不足[26]。维生素D与DKD的因果关系尚需更多的基础和临床研究进一步阐明。
本研究存在以下局限性:首先,本研究人群存在季节分布及气候变化的差异,并未排除户外运动、太阳暴露等与维生素D缺乏相关的其他混杂因素的影响。其次,本研究人群存在一定的局限性,是杭州某医院的糖尿病人群而非全国多中心的糖尿病人群。再次,本研究是横断面研究,需要进一步的前瞻性研究,探讨维生素D制剂补充治疗对糖尿病肾病、ESRD的影响,为DKD的预防及治疗提供依据。
[參考文献]
[1] Cho NH,Shaw JE,Karuranga S,et al. IDF diabetes atlas:Global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Research and Clinical Practice,2018,138:271-281.
[2] American Diabetes Association.Summary of revisions for the 2010 Clinical Practice Recommendations[J]. Diabetes Care,2010,33(1):S3.
[3] Jodar-Gimeno E,Munoz-Torres M. Vitamin D hormone system and diabetes mellitus:Lessons from selective activators of vitamin D receptor and diabetes mellitus[J]. Endocrinol Nutr,2013,60(2):87-95.
[4] Yoho RM,Frerichs J,Dodson NB,et al. A comparison of vitamin D levels in nondiabetic and diabetic patient populations[J]. J Am Podiatr Med Assoc,2009,99(1):35-41.
[5] Chung S,Kim M,Koh ES,et al. Serum 1,25-dihydroxyvitamin D better reflects renal parameters than 25-hydoxyvitamin D in patients with glomerular diseases[J]. Int J Med Sci,2017,14(11):1080-1087.
[6] Fernandez-Juarez G,Luno J,Barrio V,et al. 25(OH) Vitamin D levels and renal disease progression in patients with type 2 diabetic nephropathy and blockade of the renin-angiotensin system[J].Clinical Journal of the American Society of Nephrology,2013,8(11):1870-1876.
[7] Mehrotra R,Kermah DA,Salusky IB,et al.Chronic kidney disease,hypovitaminosis D,and mortality in the United States[J]. Kidney Int,2009,76(9):977-983.
[8] Kondo M,Toyoda M,Miyatake H,et al.The prevalence of 25-hydroxyvitamin D deficiency in Japanese patients with diabetic nephropathy[J]. Intern Med,2016,55(18):2555-2562.
[9] Levin A,Bakris GL,Molitch M,et al.Prevalence of abnormal serum vitamin D,PTH,calcium,and phosphorus in patients with chronic kidney disease:Results of the study to evaluate early kidney disease[J]. Kidney International,2007,71(1):31-38.
[10] 中華医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版)[J].中华糖尿病杂志,2018,10(1):4-67.
[11] 中华医学会内分泌学分会.中国成人糖尿病肾脏病临床诊断的专家共识[J].中华内分泌代谢杂志,2015,31:379-385.
[12] 廖祥鹏,张增利,张红红,等.维生素D与成年人骨骼健康应用指南[J].中国骨质疏松杂志,2014,20:1011-1030.
[13] Bikle DD.Vitamin D metabolism,mechanism of action,and clinical applications[J].Chem Biol,2014,21(3):319-329.
[14] Cigolini M,Iagulli MP,Miconi V,et al. Serum 25-hydroxyvitamin D3 concentrations and prevalence of cardiovascular disease among type 2 diabetic patients[J]. Diabetes Care,2006,29(3):722-724.
[15] de Boer IH,Ioannou GN,Kestenbaum B,et al.25-Hydroxyvitamin D levels and albuminuria in the third national health and nutrition examination survey(NHANES III)[J].Am J Kidney Dis,2007,50(1):69-77.
[16] Diaz VA,Mainous AG,Carek PJ,et al.The association of Vitamin D deficiency and insufficiency with diabetic nephropathy:Implications for health disparities[J]. The Jour-nal of the American Board of Family Medicine,2009,22(5):521-527.
[17] Huang Y, Yu H, Lu J, et al. Oral supplementation with cholecalciferol 800 IU ameliorates albuminuria in Chinese type 2 diabetic patients with nephropathy[J]. PLo S One, 2012, 7(11):e50510.
[18] Alborzi P,Patel NA,Peterson C,et al. Paricalcitol reduces albuminuria and inflammation in chronic kidney disease:A randomized doubleblind pilot trial[J].Hypertension,2008,52(2):249-255.
[19] Yang M,Yang BO,Gan H,et al. Anti-inflammatory effect of 1,25-dihydroxyitaminD(3)is associated with crosstalk between signal transducer and activator of transcription5 and the vitamin receptor in human monocytes[J].Exp TherMed,2015,9(5):1739-1744.
[20] Li YC,Kong J,Wei M,et al. 1,25-Dihydroxyvitamin D3 is a negative endocrine regulator of the renin-angiotensin system[J]. J Clin Invest,2002,110(2): 229-238.
[21] Deb DK,Chen Y,Zhang Z,et al.1,25-Dihydroxyvitamin D3 suppresses high glucose-induced angiotensinogen expression in kidney cells by blocking the NF-κB pathway[J].Am J Physiol Renal Physiol,2009,296(5):F1212-F1218.
[22] Kuhlmann A,Haas CS,Gross M,et al. 1,25-Dihydroxyvitamin D3 decreases podocyte loss and podocyte hypertrophy in the subtotally nephrectomized rat[J]. American Journal of Physiology-Renal Physiology,2004,286(3):F526-F533.
[23] van Halteren AG,Tysma OM,van Etten E,et al.1α,25-Dihydroxyvitamin D3 or analogue treated dendritic cells modulate human autoreactive T cells via the selective induction of apoptosis[J]. J Autoimmun,2004,23(3):233-239.
[24] 田燕燕,楊烨,张园园,等.维生素D对2型糖尿病肾病大鼠肾脏中转化生长因子-β1、重组人胶原蛋白-1和结缔组织生长因子表达的影响[J].中国医药导报,2014,11(17):8-12.
[25] Anker SD,von Haehling S.Vitamin D in chronic kidney disease:more questions than answers[J].JAMA,2012,307(7):722-723.
[26] Bonakdaran S,Shoeibi N.Is there any correlation between vitamin D insufficiency and diabetic retinopathy?[J].Int J Ophthalmol,2015,8(2):326-331.
(收稿日期:2019-05-12)

