康莱特注射液对人下咽鳞状癌细胞裸鼠移植瘤放疗敏感性影响及其机制研究
王钇力 黄莉 许明君 衷敬华 廖家华 袁军
[摘要] 目的 研究康萊特注射液对人下咽鳞状癌细胞(FADU)裸鼠移植瘤的放射增敏作用,并探讨其对肿瘤微血管生成的影响及机制。 方法 采用皮下注射法对裸鼠建立鳞状癌细胞荷瘤模型,并根据实验目的的不同随机分为对照组、单纯放射治疗组、单纯药物(康莱特注射液)治疗组及联合(放射+康莱特注射液药物治疗)组。通过测量各组裸鼠肿瘤的体积并绘制生长曲线,计算抑瘤率;采用免疫荧光检测移植瘤中CD31的表达情况并进行计数微血管密度(NVD);提取肿瘤组织总蛋白,实时定量PCR和Western blot分别检测移植瘤组织中Periostin和VEGF-C的mRNA和蛋白表达。 结果 与单独药物治疗及单纯放疗相比,联合治疗组肿瘤体积显著减少(P<0.05),此时其联合指数(CI=0.83)。免疫荧光结果显示联合治疗组也能显著减少微血管密度,与对照组、单纯药物组和放疗组比较,差异具有统计学意义(P<0.05)。此外,虽然放疗和康莱特注射液单独处理也能降低移植瘤组织中Periostin和VEGF-C的mRNA和蛋白表达,但两者联合后其mRNA和蛋白表达水平进一步减少。 结论 康莱特注射液可增强FADU细胞裸鼠移植瘤对放疗的敏感性,其机制可能与影响Periostin和VEGF-C的表达有关。
[关键词] 喉咽肿瘤;康莱特注射液;放射增敏;人下咽鳞状癌细胞
[中图分类号] R739.6 [文献标识码] A [文章编号] 1673-9701(2019)34-0035-04
Effect of Kanglaite injection on radiosensitivity of human hypopharyngeal squamous cell carcinoma xenografts in nude mice and its mechanism study
WANG Yili HUANG Li XU Mingjun ZHONG Jinghua LIAO Jiahua YUAN Jun
Department of Oncology, the First Affiliated Hospital of Gannan Medical College, Ganzhou 341000, China
[Abstract] Objective To investigate the radiosensitivity effect of Kanglaite injection on human hypopharyngeal squamous cell carcinoma(FADU) xenografts in nude mice, and to explore its effect on tumor microangiogenesis and its mechanism. Methods Nude mice were established into a squamous cell carcinoma tumor-bearing model by subcutaneous injection. They were randomly divided into control group, radiotherapy group, drug (Kanglaite injection) treatment group and combination (radiation+ Kanglaite injection drug treatment) group. The tumor inhibition rate was calculated by measuring the volume of tumor in each group and drawing the growth curve. The expression of CD31 in the xenografts was detected by immunofluorescence and the microvessel density (NVD) was counted. Then the total protein of the tumor tissue was extracted. The mRNA and protein expression of Periostin and VEGF-C in transplanted tumor tissues was detected by real-time quantitative PCR and Western blot respectively. Results Compared with that of radiotherapy group and drug treatment group, tumor volume was significantly reduced in the combination group(P<0.05), and at the same time the combined index (CI) was 0.83. Immunofluorescence results showed that the combined treatment group also significantly reduced microvessel density, and the difference was statistically significant compared with that of the control group, the drug group and the radiotherapy group (P<0.05). In addition, although radiotherapy and Kanglaite injection alone could reduce the mRNA and protein expression of Periostin and VEGF-C in xenografts, the combination of the two further reduced the mRNA and protein expression levels. Conclusion Kanglaite injection can enhance the sensitivity of FADU cell carcinoma xenografts in nude mice to radiotherapy, and its mechanism may be related to the influence of Periostin and VEGF-C expression.
[Key words] Laryngeal neoplasms; Kanglaite injection; Radiosensitization; Human hypopharyngeal squamous cell carcinoma
近年来下咽癌的治疗尽管使用了综合治疗模式,但总体5年生存率并没有得到提高,难以预测和控制的复发及转移是导致下咽癌患者死亡率居高不下的主要原因。因此,探索有效的治疗方法成为下咽癌治疗的主要研究课题。对于晚期下咽癌患者,手术切除肿瘤的同时,能否保留喉功能成为提高患者生活质量的重要决定因素[1,2]。术前放疗或者诱导化疗,使肿瘤的原发面积减小,从而为喉功能的保留提供可能。我国传统中医药在抗肿瘤方面有其特殊功效,康莱特注射液是从薏苡仁中提取的一种抗肿瘤制剂,具有诱导细胞凋亡、阻滞肿瘤细胞有丝分裂及提高免疫功能的作用,同时可减轻放、化疗的毒副作用[3,4]。但其在联合放疗治疗下咽癌中的作用目前尚不完全明确,本研究拟建立人下鳞状癌细胞裸鼠移植瘤模型,观察康莱特注射液对放疗是否具有协同效应,并初步探讨其作用机制,从而为临床应用提供实验依据。
1 资料与方法
1.1 一般资料
人下咽癌细胞株FADU(美国ATCC)。康莱特注射液(浙江康莱特药业有限公司,规格:100 mL:10 g,国药准字Z10970091))。DMEM培养基、胰蛋白酶及胎牛血清(美国Invitrogen)。CD31抗体(Santa Cruz),AlexaFluor 594抗体(Life),P-ERK1/2、total ERK1/2、P-Akt和total Akt单克隆抗体(Cell Signaling),β-actin、Periostin Periostin和VEGF-C多克隆抗體(Santa Cruz)。
1.2 细胞培养与移植瘤模型的建立
人下咽癌细胞株FADU用含有10%胎牛血清和抗生素的DMEM培养基(Gibco)培养于37℃、5% CO2培养箱中。FADU细胞每24~48 h传代1次,获取生长旺盛的细胞充分吹打至单细胞悬液,调整其密度为2×107/mL后,获取0.2 mL细胞注射于BALC/c裸鼠皮下建立裸鼠移植瘤模型。
1.3 实验分组与处理
60只裸鼠根据实验目的不同,随机分为空白对照组(6只,等体积生理盐水注射)、单纯放射治疗组18只、单纯康莱特注射液组(12.5 mL/kg)18只及放射+康莱特注射液组18只。放射治疗组给予总剂量为12 Gy的X线照射,剂量为300 cGy/min。其中在研究康莱特与放射治疗的协同效应时,分别给予裸鼠不同剂量的康莱特注射液和放射剂量组合(康莱特/放射剂量固定比为1.04)处理。获得移植瘤生长抑制率为50%左右的剂量组合[此时总剂量为12 Gy的X线照射,剂量为300 cGy/min]用于下一步研究。
1.4 裸鼠移植瘤生长曲线的绘制及肿抑率测定
各组小鼠每隔72 h测定肿瘤体积。并根据肿瘤体积的大小绘制生长曲线,并参考文献提供的方法计算药物的联合系数[5]。14 d治疗结束后,麻醉处死小鼠,4%多聚甲醛心脏灌注,并获取肿瘤组织,包埋后制成5 μm冰冻切片用于免疫荧光分析。
1.5 免疫荧光及微血管计数
冰冻切片经5%山羊血清室温封闭30 min。后滴加CD31抗体室温孵育2 h,PBS漂洗3次后,吸水纸吸干多余液体后,滴加稀释好的AlexaFluor 594标记的二抗,室温避光孵育1 h。PBS漂洗3次,每次3 min。滴加DAPI染色液避光孵育15 min,PBS洗涤多余的DAPI,共洗涤3次。用吸水纸吸干残留液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察,并行微血管计数。
1.6 实时定量PCR检测mRNA表达
实时定量PCR测定Periostin和VEGF-C mRNA的水平。首先GE公司提供的试剂盒提取组织总RNA,随后获取1 μg RNA将其逆转录为cDNA。使用Primer Express软件设计Periostin和VEGF-C基因的引物。人Periostin:正向引物:5'-GCACCGAGTAATGAGGCTTG-3';反向引物:5'-TGCTCTCCA AACCTC TAC GG-3';VEGF-C:正向引物:5'- CATTGGAGCCTTGCCTTG -3';反向引物:5'-TTCGTGGGGTTTCTGGTCT-3'。产物长度分别为242bp和245bp。在实时定量PCR仪(Chromo4,Bio-Rad)上进行PCR。25 μL PCR反应含有30 ng cDNA和200 nmol/L引物。条件为:95℃ 5 min,随后进入40个循环:95℃ 30 s,55℃ 30 s,72℃ 30 s。采用比较阈值循环(CT)方法,通过计算其与管家基因GAPDH的比值来确定相对基因表达水平。
1.7 Western blot检测蛋白表达
将组织制备成匀浆,用裂解缓冲液在4°C下裂解60 min以提取总蛋白。将蛋白质样品(35 μg)经12%SDS-PAGE处理后,电转至硝酸纤维素膜(Amersham,MA,USA)上,经封闭后,分别用P-ERK1/2,total-ERK1/2,total-Akt,P-AKT,Periostin和VEGF-C抗体4℃孵育过夜,充分洗膜后加入辣根过氧化物酶标记的二抗室温孵育30 min。最后经化学发光、显影,并用Image J(National Institute of Health,Bethesda,MD,USA)软件进行灰度扫描。
1.8 统计学分析
所有数据均使用SPSS软件进行分析(SPSS17.0)进行。计量资料用均数±标准差(x±s)表示。所有实验至少进行3次。采用方差分析后,再采用t检验进行组间比较,P<0.05为差异具有统计学意义。
2 结果
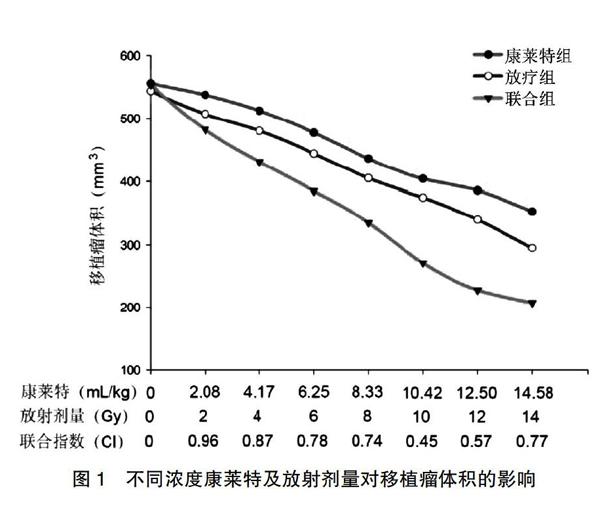
2.1 不同浓度康莱特及放射剂量对移植瘤体积的影响
60只裸鼠在接种FADU细胞10 d后均形成结节,全部成瘤,且在康莱特注射液和(或)放疗之前其移植瘤体积比较,差异无统计学意义(P>0.05);随着康莱特浓度/放疗剂量的增加,对移植瘤的生长也有所不同,通过计算两者的联合指数CI后显示,(2.08~14.58)mL/kg康莱特和2~14 Gy放射剂量对移植瘤的生长增殖具有协同作用(CI<1)。在随后的研究中,本实验选择了12.5 mL/kg和12 Gy放射剂量作为联合组(此时移植瘤生长抑制率为50.1%)。见图1。
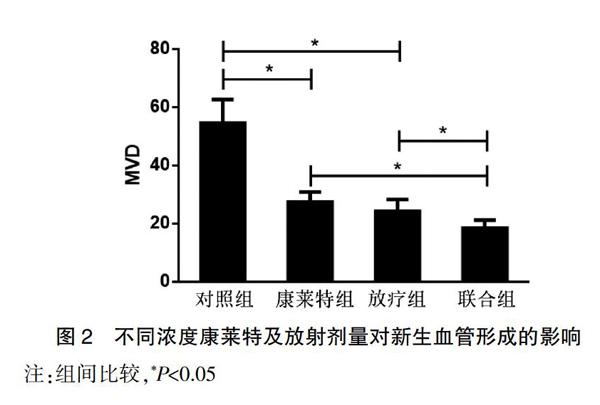
2.2 不同浓度康莱特及放射剂量对新生血管形成的影响
对照组CD31表达水平较高,单纯康莱特注射液以及放疗组CD31的表达水平有所降低,而两者联合使用后CD31表达进一步减少。通过对区域血管计数并计算MVD值后结果显示,康莱特组(27.5±3.4)和放疗组(24.2±4.1)与对照组(54.6±8.1)之间MVD比较,差异有统计学意义(P<0.05),而联合组MVD(18.5±2.7)低于康莱特和放疗组(P<0.05)。
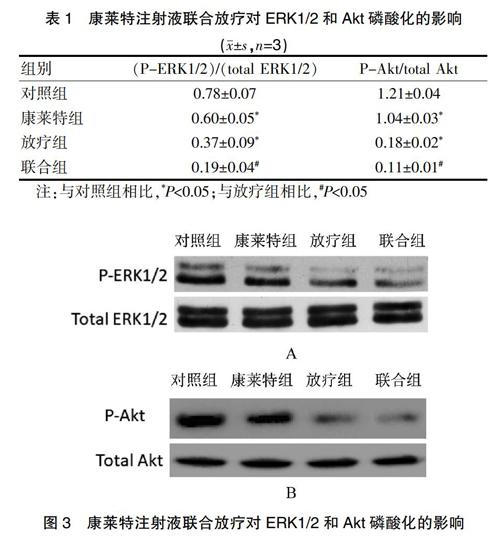
2.3 康莱特注射液联合放疗对ERK1/2和Akt磷酸化的影响
Western blot结果显示,对照组中ERK1/2磷酸化水平较高,经康莱特治疗后ERK1/2磷酸化水平有所减弱,放疗组也与之类似。同样,Akt磷酸化的变化趋势与ERK1/2一致。见表1、图3。
2.4 康莱特注射液联合放疗对Periostin和VEGF-C表达的影响
实时定量PCR结果显示,对照组Periostin和VEGF-C mRNA呈高水平表达,康萊特Periostin和VEGF-C mRNA分别降低了17%和21%。放疗组与对照组比较,两者分别降低了28%和36%。而两者联合后,表达水平降低了37%和46%。Periostin和VEGF-C的蛋白表达趋势与mRNA类似。见表2、图4。
3 讨论
下咽癌年发病率为(0.2~0.8)/10万,占头颈部恶性肿瘤的1.4%~5.0%。其解剖位置较深,早期发现和早期诊断困难,出现临床表现或就诊时多已是局部进展期。下咽癌细胞分化程度较低,几乎均为中、低分化鳞状细胞癌,恶性程度高,较早出现颈部淋巴结转移,常浸润喉、口、咽、颈段食管和咽旁间隙等部位。康莱特注射液主要成分是从薏苡仁中提取的薏苡油,是抗肿瘤制剂,具有诱导肿瘤细胞凋亡,阻滞肿瘤细胞有丝分裂,杀伤癌细胞及提高免疫功能的作用,同时可减轻放疗、化疗的毒副作用,是目前临床用于肺癌的中药制剂之一。大量基础和临床研究证明,康莱特注射液具有抗肿瘤、化疗增敏、减轻副反应、增强机体免疫功能,提高生活质量等作用[6]。Lu等[7]利用肝癌细胞株HepG2研究发现康莱特可影响细胞的G2/M期而抑制肿瘤细胞有丝分裂,同时通过Fas途径诱导肿瘤细胞凋亡。此外,康莱特能降低VEGF表达及血管内皮细胞膜上VEGFR-2蛋白表达和抑制EGFR蛋白的表达。康莱特对肺癌、肝癌、胃癌、胰腺癌等多种恶性肿瘤有明显治疗效果,提高患者生存质量,与其他药物联合放疗更具优势。目前康莱特在下咽癌中的作用未见报道,希望通过本研究能为提高下咽癌治疗有效率并减低毒副作用,提供新的证据。在本实验中,本文对康莱特的体内放疗增敏效果进行研究。为了研究康莱特对放疗是否具有协同作用,本文主要研究两者联合使用前后对细胞生物学行为的改变。Isobologram分析是一种得到广泛应用的研究药物是否具有协同作用的方法,其原理是将固定比例联合应用的药物剂量与产生同样效应的各组成药物剂量进行比较,根据单独用药所获得量效曲线,计算出各药物的IC50,然后用同样的方法获得药物联合应用时的IC50并计算两种药物的联合指数。若联合指数<1,表明两种药物具有协同作用[8]。本研究发现康莱特与放疗联合应用后,肿瘤体积与单纯放疗组或康莱特组相比差异具有统计学意义,提示在体内实验中康莱特对放疗具有协同作用。
下咽癌患者预后的最重要指标是颈部淋巴结或远处器官转移,转移可以通过血管、淋巴管或直接进入组织或体腔。区域淋巴结往往是转移的第一站,原因可能是肿瘤细胞通过丰富的淋巴管网转移或新生毛细淋巴管实现。肿瘤淋巴管生成是已知的促进淋巴转移的因素。VEGF-C可以刺激肿瘤淋巴管生成,促进肿瘤向区域淋巴结及远处转移,是肿瘤转移过程中肿瘤淋巴管生成的重要生长因子。本研究免疫荧光染色结果显示,单纯放疗组中新生微血管较多。康莱特联合放疗组癌细胞周围间质微血管存在一定缺失。提示康莱特可以减少移植瘤微血管形成,并减少肿瘤细胞的再次增殖。Periostin是一种细胞外基质相关分子,主要参与调控细胞的生存、黏附和侵袭,在多种恶性肿瘤中均高度表达且能促进肿瘤的远处转移[9,10]。在Periostin的调控机制中,主要涉及到基于整合素与特定蛋白质结后激活下游相关信号通路,包括ERK1/2和PI3K/Akt[11-13]。为了证实康莱特与放疗是否影响ERK1/2和PI3K/Akt通路的活性,本实验检测了两者磷酸化水平。结果发现尽管单纯康莱特或放疗均可在一定程度上降低其磷酸化水平,但联合应用后其活性进一步降低。随后我们也检测了下游Periostin和VEGF-C的表达变化[14,15]。与预期一致,康莱特特联合放疗后Periostin和VEGF-C表达显著减少。以上结果表明康莱特联合放疗后抑制ERK1/2和PI3K/Akt通路的激活,最终通过降低Periostin和VEGF-C的表达而抑制肿瘤生长。
综上所述,康莱特联合放疗可通过抑制ERK1/2和PI3K/Akt通路的激活,降低肿瘤组织中Periostin和VEGF-C的表达而抑制肿瘤内部微血管生成,减少细胞增殖,为进一步研究其在头颈肿瘤中的作用提供了依据。
[参考文献]
[1] Putten L,Bree R,Doornaert PA,et al. Salvage surgery in post-chemoradiation laryngeal and hypopharyngeal carcinoma:Outcome and review[J]. Acta Otorhinolaryngol Ital,2015,35(3):162-172.
[2] Edson MA,Garden AS,Takiar V,et al. Outcomes for hypopharyngeal carcinoma treated with organ-preservation therapy[J]. Head Neck,2016,38(1):2091-2099.
[3] Cao N,Ma X,Guo Z,et al. Oral kanglaite injection(KLTI)attenuates the lung cancer-promoting effect of high-fat diet(HFD)-induced obesity[J]. Oncotarget,2016,7(38):61093-61106.
[4] Lu Y,Li CS,Dong Q. Chinese herb related molecules of cancer-cell-apoptosis:A minireview of progress between Kanglaite injection and related genes[J]. J Exp Clin Cancer Res,2008,27(4):31-37.
[5] Zhao L,Au JL,Wientjes MG. Comparison of methods for evaluating drug-drug interaction[J]. Front Bio-sci(Elite Ed),2010,2(1):241-249.
[6] 甘霖霖,于鏡泊,张海青,等. 康莱特注射液在乳腺癌新辅助化疗中的作用[J]. 肿瘤,2009,29(3):283-285.
[7] Lu Y,Wu LQ,Dong Q,et al. Experimental study on the effect of Kang-Lai-Te induced apoptosis of human hepatoma carcinoma cell HepG2[J]. Hepatobiliary Pancreat Dis Int,2009,8(3):267-272.
[8] Niyazi M,Belka C. Isobologram analysis of triple therapies[J]. Radiat Oncol,2006,1(1):39.
[9] Ruan K,Bao S,Ouyang G. The multifaceted role of periostin in tumorigenesis[J]. Cell Mol Life Sci,2009,66(14):2219-2230.
[10] Xu X,Chang W,Yuan J,et al. Periostin expression in intra-tumoral stromal cells is prognostic and predictive for colorectal carcinoma via creating a cancer-supportive niche[J]. Oncotarget,2016,7(1):798-813.
[11] Yang L,Serada S,Fujimoto M,et al. Periostin facilitates skin sclerosis via PI3K/Akt dependent mechanism in a mouse model of scleroderma[J]. Plos One,2012,7(7):e41994.
[12] Chen Z,Xie J,Hao H,et al. Ablation of periostin inhibits post-infarction myocardial regeneration in neonatal mice mediated by the phosphatidylinositol 3 kinase/gl-ycogen synthase kinase 3β/cyclin D1 signalling pathway[J]. Cardiovasc Res,2017,113(6):620-632.
[13] Zhu M,Fejzo MS,Anderson L,et al. Periostin promotes ovarian cancer angiogenesis and metastasis[J]. Gynecol Oncol,2016,119(2):337-344.
[14] Liu Y,Huang Z,Cui D,et al. The Multiaspect Functions of Periostin in Tumor Progression[J]. Adv Exp Med Biol,2019,1132(11):125-136.
[15] Jha SK,Rauniyar K,Chronowska E,et al. KLK3/PSA and cathepsin D activate VEGF-C and VEGF-D[J]. Elife,2019, 8(4):745-761.
(收稿日期:2019-07-31)

