亚氨基哒嗪类衍生物对人与昆虫GABA受体的选择性研究
陈佳丽 ,翟 纳 ,陈 达 ,王秀美 ,田亚锋 ,郑小娇 ,刘根炎*
1.武汉工程大学化工与制药学院,湖北 武汉 430205;
2.绿色化工过程教育部重点实验室(武汉工程大学),湖北 武汉 430205
γ-氨基丁酸(γ-aminobutyric acid,GABA)是生物体神经系统中重要的抑制性传导递质,通过与两类GABA受体(离子型和代谢型)结合而发挥生理作用。GABA受体是一种多功能的药物作用靶标,与诸多神经性疾病密切相关[1-2]。离子型GA⁃BA受体属于配体门控氯离子通道,是重要的杀虫剂作用靶标之一,如氟虫腈和林丹等均是作用于该受体的商品化农用杀虫剂[3-4]。因此,离子型GABA受体一直是相关领域的研究热点之一。
离子型GABA受体属于Cys-loop超家族的一员,一般由5个同源或异源的亚基构成。每个亚基含有1个较长的N-端胞外区、4个疏水的跨膜区(TM1-TM4)和1个胞内区[5]。GABA的结合位点位于亲水的胞外区,第二跨膜区(TM2)的大多数氨基酸残基参与形成了离子通道。GABA与受体结合后,离子通道打开,氯离子流入细胞内部,使细胞膜超极化,从而对生物体的神经传导产生抑制作用。2014年,Miller等[6]成功解析了人类 GABA受体一个亚型(β3同源五聚体)的三维结构,这一发现为GABA受体的研究提供了重要的科学依据。目前,19个哺乳动物GABA受体的亚基已被鉴定[1]。对昆虫而言,至今只发现了3种亚基:RDL(resistance to dieldrin,RDL 亚基),GRD(gly⁃cine-like receptor,过 氨 酸 受 体 )和 LCCH3(li⁃gand-gated chloride channel homologue 3,配体门控氯离子通道同系物3)[7-8]。研究表明,这三种亚基中只有RDL可以形成功能性的GABA门控氯离子通道[9],因此昆虫GABA受体也被称为RDL受体。
传统作用于GABA受体的杀虫剂,均属于该受体的非竞争性拮抗剂[3],能直接作用于离子孔道,阻滞氯离子内流,最终导致昆虫神经兴奋无法抑制而死亡。其中典型的芳基吡唑类杀虫剂氟虫腈自20世纪90年代成功上市后,得到了广泛应用,也引起了研究人员的广泛关注。但由于长期使用,多种害虫已对该类杀虫剂产生不同程度的抗药性[3-4,10]。研究表明靶标GABA受体发生抗性突变是害虫产生抗性的主要机制之一,褐飞虱和小菜蛾等害虫GABA受体第二跨膜区的关键氨基酸会产生A’2S和A’2N等突变,从而使这些害虫对氟虫腈类杀虫剂产生数百倍的抗药性[4,10]。GA⁃BA受体竞争性拮抗剂与非竞争性拮抗剂具有相似的功能,均可使氯离子通道呈关闭状态,从而产生杀虫活性,但二者的结合位点和作用机制不同[11]。传统的非竞争性拮抗剂直接作用于跨膜区从而阻滞氯离子通道,而竞争性拮抗剂作用于胞外区,与GABA竞争同一结合位点,使GABA无法达到作用位点而导致氯离子通道无法开启。因此,GABA受体竞争性拮抗剂不会受现有抗药性机制的干扰,是研发高效新型杀虫剂的潜在对象。
目前关于昆虫GABA受体竞争性拮抗剂的报道较少。Gabazine是大鼠GABAA受体一个典型竞争性拮抗剂[12],有报道证明Gabazine对昆虫GABA受体也具有一定的拮抗效应[13-15]。Ozoe课题组发现在Gabazine哒嗪环的3位引入芳香基团会使其对昆虫GABA受体的竞争性拮抗活性明显增加[16-17](图1),但未见文献报道该类化合物的杀虫活性。Frølund课题组设计并合成了多个系列的五元杂环类化合物,包括异噁唑类、异噻唑类和吡唑类等,实验结果证明这些化合物均是哺乳动物GABAA受体竞争性拮抗剂[18-20]。除此之外,Rahman等[17]研究发现氰基可能为哒嗪环1位羧酸的生物电子等排体。因此经过结构修饰的亚氨基哒嗪类衍生物有潜力开发为昆虫GABA受体竞争性拮抗剂的先导化合物。

图1 Gabazine及其衍生物化学结构Fig.1 Chemical structures of gabazine and its derivatives
昆虫GABA受体的三维晶体结构还未见报道。本研究采用同源模建的方法,以人GABAAβ3受体的晶体结构为模板,分别构建家蝇(Musca domestica)、褐飞虱(Laodelphax striatellus)和斜纹夜蛾(Spodoptera litura)的RDL GABA受体以及人(Homo sapiens)的α1β2γ2 GABA受体模型,然后将昆虫GABA受体竞争性拮抗剂亚氨基哒嗪类衍生物与所建模型进行对接,研究亚氨基哒嗪类衍生物与两种农业害虫、一种卫生害虫和一种哺乳动物GABA受体的结合模式和作用机理。我们期望从分子水平预测和阐释亚氨基哒嗪类衍生物在昆虫和哺乳动物的GABA受体中选择性机理,为研发高效、低毒的作用于GABA受体的新型杀虫剂提供理论指导。
1 实验部分
本研究所涉及的分子模拟实验均使用Win⁃dows版 SYBYL-X 2.1软件(Tripos Inc.,St.Louis,MO,USA)完成。如未做特殊说明,所用参数均采用默认值。
1.1 目标序列和模板选择
为构建目标蛋白的三维模型,通过对Uni⁃ProtKB数据库进行搜索,寻找到3种目标昆虫(家蝇、褐飞虱和斜纹夜蛾)和1种哺乳动物(人)的GABA受体的亚基序列,编号分别如下:1)家蝇RDL亚基序列编号Q75NA5;2)褐飞虱RDL亚基序列编号Q0ECT5;3)斜纹夜蛾RDL亚基序列编号G8IIS8;4)人GABA受体α1亚基序列编号P14867,β2亚基序列编号 P47870,γ2亚基序列编号P18507。
对RCSB Protein Data Bank数据库进行搜寻,未发现已经解析的家蝇等昆虫的GABA受体三维结构。因此本研究选用人GABAAβ3受体的晶体结构(PDB ID:4COF)为模板,采用同源模建的方法分别构建家蝇、褐飞虱和斜纹夜蛾的RDL GA⁃BA受体及人α1β2γ2 GABA受体的三维模型。
1.2 构建亚基
利用SYBYL-X 2.1软件Biopolymer模块中的Compare Sequence功能,采用Needleman&Wunsch方法将6个目标亚基序列分别与人GABAAβ3模板序列进行比对,得到序列比对的6个MSF文件。在ORCHESTRAR模块中导入MSF文件,通过构建和分析保守区、搜索并添加疏水环区、添加侧链、氢键优化等步骤分别完成每个目标亚基的构建。
1.3 组合模型
通过分析模板受体人GABAAβ3受体的晶体结构可知,该蛋白是同源五聚的氯离子通道,在构建完成所需的目标亚基后,需通过SYBYL-X 2.1软件Edit/Merge模块将3种昆虫的5个亚基和模板受体4COF叠合后依次组成五聚的氯离子通道。由于人α1β2γ2 GABA受体并不是同源寡聚体,所以将人α1β2γ2 GABA受体与模板4COF进行比对,需要将前者的α1、β2和γ2亚基分别叠合到4COF为模板的各个亚基上,以顺时针方向(β2)(γ2)(α1)(β2)(γ2)组合构建人α1β2γ2 GABA受体(见图2)。
1.4 模型优化

图2 人α1β2γ2 GABA受体亚基排列的示意图Fig.2 Schematic diagram of arrangement of human α1β2γ2 GABA receptor subunits
针对所构建的模型,采用能量优化与分子动力学两种方法对模型结构进行优化,以使各模型获得能量较稳定的构象。首先在AMBER7 FF99力场下,采用共轭梯度法对每个模型进行能量优化至连续两次能量梯度差小于0.005 kcal/(mol·nm)。在此基础上,使用SYBYL-X 2.1软件中内置的分子动力学模块Dynamics执行动力学模拟,具体参数为:NPT模式,温度 300 K,压力101 325 Pa,步长1 fs,每2.5 ps取样一次,总时长为500 ps。
1.5 分子对接
运用SYBYL-X 2.1软件中的Surflex-Docking模块,自定义氨基酸残基模式确定受体结合口袋,其中原型分子(protomol)为结合口袋,参数Bloat值和Threshold值确定结合口袋的形状及大小。将5个亚氨基哒嗪类衍生物(见图1)分别与模建得到的家蝇、褐飞虱和斜纹夜蛾的RDL GABA受体及人的α1β2γ2 GABA受体的三维模型进行分子对接,分析昆虫和哺乳动物GABA受体正构位点与其竞争性拮抗剂亚氨基哒嗪类衍生物的结合模式。
2 结果与讨论
2.1 同源模建
通过序列同源性比对,我们可以发现目标蛋白的各亚基序列与模板蛋白β3序列亚基同源性较高,模板4COF每条链与3种昆虫的RDL亚基和人GABA受体的α1、β2、γ2亚基序列一致性均大于40%。通常来说,模建蛋白序列与构建的目标蛋白序列一致性大于30%时,通过同源模建方法就可以获得较为可靠的目标蛋白三维结构模型。因此,在本研究中,针对同源模建家蝇、褐飞虱、斜纹夜蛾的RDL GABA受体和人的α1β2γ2 GABA受体所选取的人GABAAβ3受体作为模板是合理的。
模板蛋白人GABAAβ3受体为5个同源亚基构成的氯离子通道,因而以其为模板构建3种昆虫GABA受体结构模型时需要对模板蛋白进行拆分,取得每一条模板受体亚基。再分别与3种昆虫RDL GABA受体亚基序列进行1次序列比对,模建得到每条亚基,然后将模建得到的亚基分别与模板蛋白的亚基进行叠合,组合成最终的蛋白模型,如图3所示。人α1β2γ2 GABA受体则需要分别对α1、β2和γ2亚基进行序列比对,再将模建所得的各亚基按顺时针方向(图2)分别叠合到模板蛋白的亚基上,组合成为人α1β2γ2 GABA受体结构模型,见图 3(d)。
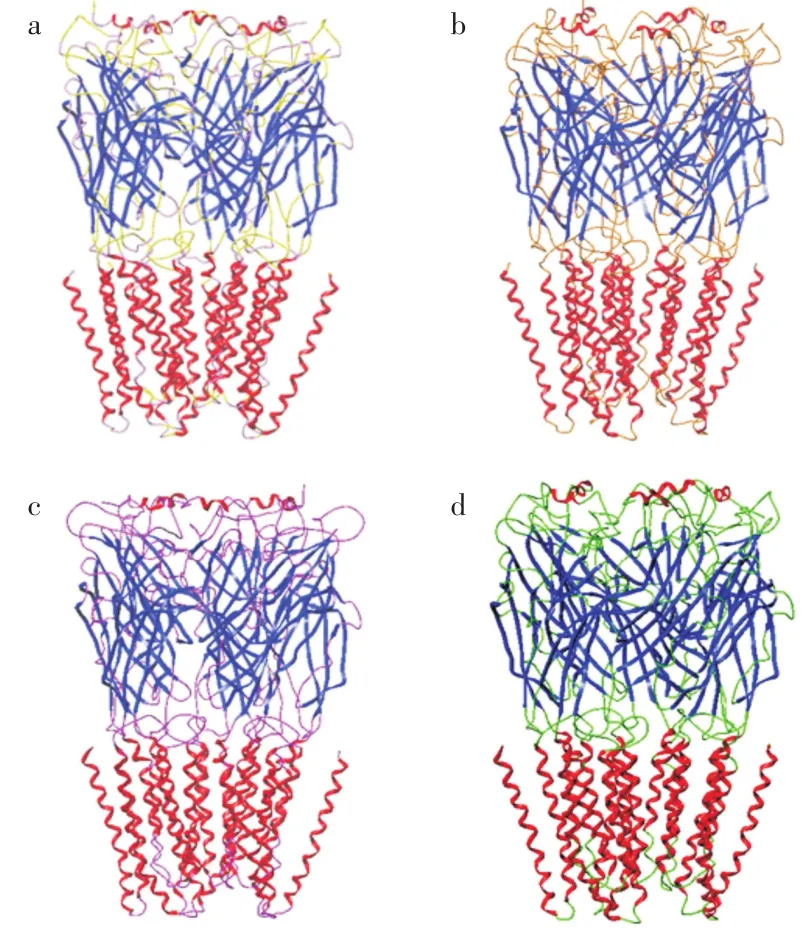
图3 模建的GABA受体三维模型:(a)家蝇,(b)褐飞虱,(c)斜纹夜蛾,(d)人α1β2γ2Fig.3 Three-dimensional models of constructed GABA receptors:(a)housefly,(b)small brown planthopper,(c)common cutworm,(d)human α1β2γ2)
在能量优化方面,利用SYBYL-X 2.1软件中内置的分子动力学模块Dynamics对所构建的4个受体模型分别进行了500 ps的分子动力学模拟。所构建的家蝇和褐飞虱GABA受体模型在开始的80 ps内能量变化较大,在随后的420 ps能量趋于稳定化,波幅较稳定,基本稳定于1 700 kcal/mol和1 900 kcal/mol左右[图4(a),4(b)];所构建的斜纹夜蛾GABA受体模型在开始的60 ps内能量快速下降,在接下来的450 ps能量波幅趋于稳定,最后能量基本稳定在1 800 kcal/mol左右[图4(c)];所构建的人α1β2γ2 GABA受体模型能量在开始的100 ps内下降非常迅速,在随后的200 ps缓慢下降,在350ps后趋于平稳状态,基本能量稳定在1500kcal/mol[图4(d)]。这表明,所构建的4个受体模型能量上合理且均较稳定。

图4 GABA受体模型分子动力学能量-时间图:(a)家蝇,(b)褐飞虱,(c)斜纹夜蛾,(d)人α1β2γ2Fig.4 Plot of potential energies of GABA receptor models versus simulation time for 500 ps molecular dynamics:(a)housefly,(b)small brown planthopper,(c)common cutworm,(d)human α1β2γ2
在构象变化方面,在动力学模拟的最初阶段,家蝇、褐飞虱、斜纹夜蛾和人GABA受体的三维结构骨架原子的位置相对于模型最初构象的均方根差值逐渐上升,约350 ps之后,RMSD(Root-Mean-Square Deviation)值分别稳定在0.41、0.75、0.44 nm和0.55 nm左右(图5),表明体系已趋于稳定,这进一步说明了该模型在结构上的合理性。

图5 GABA受体模型500 ps分子动力学RMSD-时间图:(a)家蝇,(b)褐飞虱,(c)斜纹夜蛾,(d)人α1β2γ2Fig.5 Plot of RMSDs of GABA receptor models versus the simulation time for 500 ps molecular dynamics:(a)housefly,(b)small brown planthopper,(c)common cutworm,(d)human α1β2γ2
运用SYBYL/ProTable模块内拉氏图对所得到模型的构象进行进一步验证(图6)。家蝇、褐飞虱、斜纹夜蛾和人受体结构模型的拉氏图分别如图 6(a),6(b),6(c)和 6(d)所示。由图 6 可知,在模建的4种GABA受体结构模型中,超过99%的氨基酸残基均处于允许区域内,这验证了4个受体模型的可靠性。

图6 GABA受体模型氨基酸Ramachandran图:(a),家蝇,(b)褐飞虱,(c)斜纹夜蛾,(d)人α1β2γ2Fig.6 Ramachandran graph of GABA receptor models:(a)housefly,(b)small brown planthoppe,(c)common cutworm,(d)human α1β2γ2
2.2 分子对接
根据文献报道,GABA受体竞争性拮抗剂的结合区域位于膜外区的正构位点,一般由6个loop区(A-F)的氨基酸残基构成。由于本研究中所构建目标蛋白的序列不同,结合位点的氨基酸残基也存在一定的差异。对各个受体序列和模型进行分析,对接位点的关键氨基酸总结如下。
1)家蝇和褐飞虱:Phe90(loop A)、Glu148(loop B)、Phe150(loop B)、Ser149(loop B)、Tyr198(loop C)、Tyr53(loop D)、Arg55(loop D)。
2)斜纹夜蛾:Phe88(loop A)、Glu146(loop B)、Ser14(loop B)、Phe148(loop B)、Tyr196(loop C)、Arg198(loop C)、Tyr51(loop D)、Arg53(loop D)。
3)人:Phe89(loop A)、Glu146(loop B)、Ser147(loop B)、Tyr196(loop C)、Arg198(loop C)、Tyr53(loop D)。
本研究采用SYBYL-X 2.1软件C_score模块对亚氨基哒嗪类衍生物与所模建的4个GABA受体对接结果分别进行评价打分。如表1所示,在家蝇和褐飞虱GABA受体中,相对Gabazine而言,化合物1-4的对接打分均有所提高,这表明在Gabazine哒嗪环的3位引入芳香基团有助于提高该类化合物对昆虫受体的拮抗活性。其中,化合物3(4-[3-(2-萘基)-1,6-二氢-6-亚氨基哒嗪基]丁酸氢溴酸盐)在三种昆虫受体中的打分均最高,这一结果与Rahman等[16-17]的活性测试结果基本一致。此外,所有亚氨基哒嗪类衍生物(1-4)与三种昆虫GABA受体的对接打分均高于与人α1β2γ2 GABA受体的对接打分,这表明亚氨基哒嗪类衍生物在哺乳动物和昆虫GABA受体之间作用具有差异性,对昆虫选择性更好。化合物3与对人α1β2γ2 GABA受体的对接得分最低为3.49,这表明化合物3与人α 1β2γ2 GABA受体的结合不够稳定。

表1 亚氨基哒嗪类衍生物与四种GABA受体模型的对接打分Tab.1 Docking scores of the iminopyridazines in four GABA receptor models
以亚氨基哒嗪类衍生物具有最高对接分数的化合物3为例,分析其与三种昆虫RDL GABA受体及人α1β2γ2 GABA受体模型正构位点的结合模式,具体结果如图7所示。从对接模式来看,化合物3都是垂直插入三种昆虫GABA受体的正构位点,这与文献中所报道的GABA受体竞争性拮抗剂结合模式基本符合[14-17]。化合物3与三种昆虫GABA受体对接构象差别较小,具有较相似的结合模式。以家蝇GABA受体与化合物3相互作用的结合模式为例,如图7(a)所示,化合物3的哒嗪环1位取代的丁酸羰基O原子可以和loop C中Thr194侧链上的羟基H原子形成较稳定的氢键;loop B中的Phe150的骨架羰基O原子作为氢键受体,与化合物3中6位取代的亚氨基H形成氢键,氢键距离为0.178 nm,作用较强。化合物3在斜纹夜蛾和褐飞虱GABA受体的作用位点也可形成相似的氢键作用[图7(b)和7(c)]。除了氢键作用外,化合物3中哒嗪环3位(R2)取代的2-萘基与loop D中的Tyr53中的苯环产生较强的π-π堆积作用,这也与Rahman等[16]报道的结论相吻合。Rahman等[16-17]的研究表明在哒嗪环的3位引入2-萘基时,所得衍生物在100 μmol/L时,对褐飞虱、斜纹夜蛾和家蝇的GABA受体均表现出较好的拮抗活性。综上,本研究中所发现的π-π堆积作用可能是化合物3对昆虫GABA受体产生竞争性拮抗作用的的关键之一。此外,loop D中的Arg55侧链带一定的正电性,化合物3中1位取代的羧基带有负电,二者之间可以产生静电作用,loop A中的Phe90和loop C中的Tyr198可与化合物3产生较强的疏水作用,这与LIU等[14-15]文献中报道的一致。
在与人的GABA受体模型对接中,笔者发现特征氨基酸残基Arg55、Tyr148、Tyr196和Ser192和化合物3的距离较远,未形成氢键作用,也未发现特征的π-π堆积作用(图7d)。此外,化合物3与昆虫GABA受体的对接打分是与人GABA受体对接打分的2倍及以上(表1),说明其与昆虫GABA受体结合更稳定。化合物3与家蝇、褐飞虱和斜纹夜蛾GABA受体较稳定的结合模式,可以从一定程度上解释其与昆虫GABA受体的结合具有靶标专一性,表明该类对昆虫与哺乳动物GABA受体具有一定的选择性。

图7 化合物3与所构建GABA受体模型的分子对接:(a)家蝇,(b)褐飞虱,(c)斜纹夜蛾,(d)人α1β2γ2Fig.7 Docking results of compound 3 into the constructed GABA receptor models:(a)housefly,(b)small brown planthopper,(c)common cutworm,(d)human α1β2γ2
3 结 语
本论文以人GABAAβ3受体的晶体结构为模板,通过同源模建的方法,分别构建了2种农业害虫(褐飞虱和斜纹夜蛾)、1种卫生害虫(家蝇)和1种哺乳动物(人)的离子型GABA受体的三维结构模型,且经能量优化、分子动力学、拉氏图验证了所有模型的稳定性和合理性。利用分子对接方法,研究了GABA受体竞争性拮抗剂亚氨基哒嗪类衍生物与所构建模型的结合模式和作用机理。结果表明亚氨基哒嗪类衍生物与3种昆虫GABA受体对接打分趋势基本一致,均高于其与人GABA受体的对接打分。亚氨基哒嗪类衍生物的芳香基团可能和昆虫GABA受体中结合位点loop D区域的Tyr形成π-π堆积作用,从而增强其结合能力,这有可能是亚氨基哒嗪类衍生物对昆虫和哺乳动物具有选择性的关键因素之一。本研究从分子水平上预测和阐释了昆虫GABA受体竞争性拮抗剂对昆虫和哺乳动物具有选择性的原因,可以为设计新型竞争性拮抗剂苗头化合物提供新思路,为研发安全、高效的新型农药研发提供理论指导。

