肺复张联合呼气末正压通气对心脏手术患者肺功能的影响
李中云 叶有国 杨焱焰 文建乾 牙 耀 韦晓艳 邓 良
(广西南宁市第三人民医院麻醉科,南宁市 530003,电子邮箱:605983141@qq.com)
体外循环下心内直视手术后肺不张、肺水肿、肺顺应性下降以及肺部感染等并发症发生率升高与体外循环期间肺通气不足有关[1]。研究表明,体外循环中持续低潮气量肺通气可减轻肺部炎症反应,抑制蛋白水解而达到肺保护作用[2]。体外循环下心脏手术患者术后行肺复张,可改善肺氧合功能[3-4]。本研究探讨行心内直视心脏瓣膜置换术体外循环期间定时肺复张联合低潮气量呼气末正压通气对患者术后肺功能及其转归的影响。
1 资料与方法
1.1 临床资料 选择2014年6月至2015年9月在我院择期行心脏瓣膜置换手术的60例患者为研究对象,美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅱ~Ⅲ级,纽约心脏病学会(New York Heart Association,NYHA)心功能分级为Ⅱ~Ⅲ级,年龄35~54岁,体重48~70 kg,男27例,女33例。纳入标准:心脏彩色多普勒超声诊断为心脏瓣膜病,有手术指征,需行心脏瓣膜置换术的患者。排除标准:合并有原发性肺疾病、冠心病、中重度肺动脉高压、糖尿病患者及心脏超声检查提示左室舒张末直径>70 mm或射血分数<50%、心胸比>0.70的患者。采用随机数字表法将60例患者分为肺复张组和对照组,每组30例。其中肺复张组男14例,女16例,年龄(54.3±5.2)岁,体重(57.1±11.0)kg,ASA分级Ⅱ级12例、Ⅲ级18例,NYHA心功能分级Ⅱ级16例、Ⅲ级14例,体外循环时间(98.0±20.0)min,手术时间(209.0±14.0)min,麻醉时间(252.0±13.0)min,二尖瓣置换术10例、主动脉瓣置换术9例、二尖瓣置换术+三尖瓣整形术11例;对照组男13例,女17例,年龄(53.4±8.3)岁,体重(55.1±13.1)kg,ASA分级Ⅱ级13例、Ⅲ级17例,NYHA心功能分级Ⅱ级16例、Ⅲ级14例,体外循环时间(95.0±18.0)min,手术时间(198.0±16.0)min,麻醉时间(243.0±18.0)min,二尖瓣置换术9例、主动脉瓣置换术7例、二尖瓣置换术+三尖瓣整形术14例。两组患者的年龄、性别、体重、ASA分级、NYHA心功能分级、体外循环时间、手术时间、麻醉时间、手术类型等资料比较,差异均无统计学意义(均P>0.05),具有可比性。
1.2 麻醉方法 两组麻醉方法相同。麻醉前30 min肌注吗啡0.1~0.2 mg/kg,入室后采用多功能监护仪监测ECG、心率、SpO2,开放外周静脉,输注乳酸林格氏液,局麻下桡动脉置管监测有创动脉压。麻醉诱导:静脉注射咪达唑仑0.05~0.1 mg/kg,依托咪酯0.1~0.3 mg/kg,顺苯阿曲库铵0.2 mg/kg、舒芬太尼1 μg/kg;麻醉维持:间断静脉注射舒芬太尼及顺苯阿曲库铵0.075 mg/kg,持续静脉输注1%异丙酚4~8 mg/(kg·h)。气管插管后接Drager 多功能麻醉机(德国生产,型号:Fabius Plus)行机械通气,呼吸参数设置:潮气量8~10 ml/kg,呼吸频率10~12次/min,吸呼比1 ∶2,维持呼气末二氧化碳分压35~45 mmHg,连续监测气道峰压、气道平台压、气道压力、生理无效腔率、肺动态顺应性;右颈内静脉穿刺置7Fr3L中心静脉导管监测中心静脉压。
1.3 体外循环方法 两组患者的体外循环均使用德国生产的Stockert Ⅲ型人工心肺机,国产中空纤维膜式氧合器(东莞科威医疗器械有限公司);预冲液采用乳酸林格氏液和血浆代用品(羟乙基淀粉130/0.4氯化钠注射液),预冲总量1 300~1 600 ml,红细胞比容维持在24%左右,晶胶比0.45。采用4 ∶1高钾冷氧合血灌注实施心肌保护。体外循环期间维持激活凝血时间>480 s,浅低温体外循环,鼻咽温降至31℃~33℃,灌注流量2.2~2.5 L/(m2·min),维持平均动脉压 60~80 mmHg,α稳态血气管理,维持pH 7.35~7.45,PaCO235~45 mmHg,复温速率0.10~0.20℃/min。对照组体外循环期间于体外循环腔静脉阻断后静态膨肺,维持气道压力8 cmH2O;肺复张组体外循环期间于体外循环腔静脉阻断后手控呼吸囊膨肺,使气道压力升至20 cmH2O,维持3~5 s,重复5次,膨肺后进行持续机械通气:潮气量为5 ml/kg,呼气末气道压力为8 cmH2O,并每隔60 min膨肺1次(方法同第一次)。在停止体外循环后两组患者均恢复全量通气,呼吸参数与麻醉诱导后相同。
1.4 观察指标 (1)观察两组胸骨锯开前(T0)、体外循环开始时(T1)、体外循环结束即刻(T2)、手术结束时(T3)及手术后4 h(T4)的肺功能指标和血流动力学相关参数,包括心率、平均动脉压、中心静脉压,动脉氧分压、肺泡-动脉氧分压差、肺内分流率、气道峰压、气道平台压、气道压力、生理无效腔率、肺动态顺应性、氧合指数。肺内分流率的计算公式:肺内分流率=(CcO2-CaO2)÷(CcO2-CvO2)×100%。其中CaO2为动脉血氧含量,CvO2为混合静脉血氧含量,CcO2为肺毛细血管氧含量。CcO2=PaO2×0.0031+(1.34×Hb);PaO2=FiO2×(PB-PH2O)-(PaCO2÷R),PB为760 mmHg,PH2O为47 mmHg,R为0.8[9],氧合指数=PO2÷FiO2,其中PO2为氧分压,FiO2为吸入氧浓度分数。(2)观察两组术后呼吸机辅助通气时间、ICU停留时间、术后3 d肺不张、肺水肿、低氧血症以及肺部感染发生率。
1.5 统计学分析 采用SPSS 15.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用成组t检验;重复测量资料比较采用重复测量方差分析;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组血流动力学指标比较 两组患者平均动脉压、心率、中心静脉压比较,差异均无统计学意(F组间=2.532、1.042、2.374,P组间=0.151、0.811、0.158),两组平均动脉压、心率、中心静脉压均无随时间变化的趋势(F时间=0.719、0.126、0.439,P时间=0.866、0.975、0.606),分组与时间均无交互效应(F交互=0.042、0.278、1.214,P交互=0.837、0.926、0.721)。见表1。

表1 两组患者的血流动力学指标、血气分析比较(x±s)
注:与对照组比较,aP<0.05;ScvO2为中心静脉血氧饱和度。
2.2 两组患者术中血气分析指标比较 两组患者ScvO2、PaCO2比较,差异均无统计学意(F组间=2.810、3.157;P组间=0.198、0.311),两组ScvO2、PaCO2均无随时间变化的趋势(F时间=0.874、0.902,P时间=0.905、0.912),分组与时间无交互效应(F交互=0.067、0.073,P交互=0.865、0.881)。两组患者PaO2、肺动态顺应性、氧合指数、肺泡-动脉氧分压差比较,差异均有统计学意(F组间=3 145.812、164.634、1 186.210、1 031.103;均P组间<0.001),两组PaO2、肺动态顺应性、氧合指数、肺泡-动脉氧分压差均有随时间变化而下降的趋势(F时间=6 682.625、112.622、2 153.390、324.591,均P时间<0.001),PaO2分组与时间无交互效应(F交互=734.353,P交互=0.837),肺动态顺应性、氧合指数、肺泡-动脉氧分压差的分组与时间有交互效应(F交互=24.791、261.594、197.121,均P交互<0.001),肺复张组患者体外循环结束即刻、手术结束时及手术后4 h时的PaO2、肺动态顺应性、氧合指数高于对照组,肺泡-动脉血氧分压差低于对照组患者,见表1。
2.3 两组患者各时点呼吸参数比较 两组患者肺内分流率、生理无效腔率、气道峰压、气道平台压、气道压力比较,差异均有统计学意(F组间=388.781、301.235、133.303、411.732、2 754.362,均P组间<0.001),两组肺内分流率、生理无效腔率、气道峰压、气道平台压、气道压力均有随时间变化而升高的趋势(F时间=83.602、251.243、68.151、245.173、445.302,均P组间<0.001),分组与时间均有交互效应(F交互=88.184、69.693、41.490、69.311、305.402,均P组间<0.001),肺复张组患者体外循环结束即刻、手术结束时、手术后4 h时肺内分流率、生理无效腔率、气道峰压、气道平台压、气道压力均低于对照组患者。见表2。
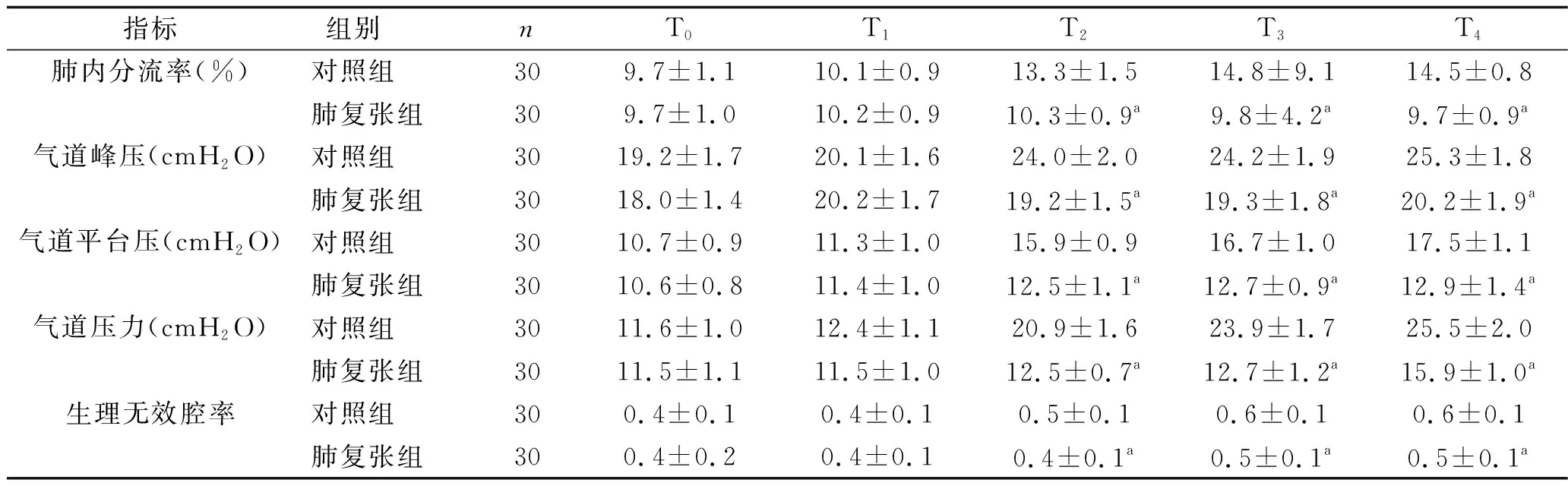
表2 两组患者各时点呼吸参数比较(x±s)
注:与对照组比较,aP<0.05。
2.4 两组术后情况比较 肺复张组术后机械通气时间为(9.1±3.4)h,短于对照组的(5.3±1.1)h(t=2.302,P=0.027)。肺复张组ICU停留时间为(29.5±9.3)h,短于对照组的(18.4±4.2)h(t=5.958,P<0.001)。肺复张组术后并发低氧血症、肺不张各1例,并发症发生率为6.67%(2/30),对照组术后并发肺部感染4例,低氧血症5例,肺不张8例,并发症发生率为56.67%(17/30),对照组并发症发生率高于肺复张组(χ2=41.550,P<0.001)。
3 讨 论
体外循环心脏手术后并发急性肺损伤是困扰临床的难题,其为全身炎症反应综合征在肺部的主要表现。体外循环期间肺局部生理改变主要是因手术需要行上、下腔静脉阻断及停止通气,使肺因血供完全依靠支气管动脉而处于相对缺血缺氧状态,以缺血后再灌注损伤和体外循环时肺部处于相对“高温”的高代谢、高氧耗状态为特征[1]。体外循环期间氧合血持续肺动脉灌注是解决肺缺血的方法,但其操作复杂,且对手术操作视野有一定影响,目前很难应用于临床,而恢复体外循环期间的通气则相对简单易行。
本研究探讨体外循环期间定时肺复张联合低潮气量呼气末正压通气对心脏手术患者肺功能的影响,结果显示,在体外循环时施行定期肺复张联合低潮气量低呼气末正压机械通气的肺复张组,在体外循环结束即刻、手术结束时及手术后4 h时PaO2、肺动态顺应性、氧合指数下降幅度明显减少。这提示在体外循环心脏手术中,采用定期肺复张联合低潮气量低呼气末正压机械通气可有效防止肺泡萎缩,使塌陷的肺泡重新开放,增加呼气末肺容量和残气量,减少肺内分流及无效腔容积,有利于气体交换和肺保护。此外,肺复张组患者的肺泡-动脉氧分压差、肺内分流率、生理无效腔率、气道峰压、气道平台压、气道压力均低于对照组,这可能因肺复张组患者体外循环中肺持续低潮气量通气,经肺泡途径弥散至肺组织的氧可保证肺组织代谢水平从而改善肺组织缺氧所致。而且持续机械通气,因机械动力作用使肺内积血回流左心,减少了肺内白细胞与血管内皮的黏附及炎症因子释放及聚集,减轻体外循环中因肺缺氧缺血造成的肺损伤[5]。
本研究结果还显示,肺复张组术后呼吸机通气时间、ICU停留时间短于对照组,肺部并发症发生率低于对照组(P<0.05),提示体外循环期中,采用定期肺复张联合低潮气量低呼气末正压机械通气可使患者平均气道压增高,并维持一定的时间,使萎陷的肺泡最大限度地复张,防止低潮气量通气诱发的继发性肺不张,并且可扩张小气道,促进细小支气管末端及肺泡内的分泌物排出,从而预防肺部感染[6]。肺复张联合低潮气量低呼气末正压机械通气,可保持肺泡相对开放,增加肺泡压力,降低肺泡表面张力和肺的气道压力,从而改善术后肺通气效果,改善肺顺应性,减少肺水肿的发生[7-8]。此外,两组患者围术期各时点平均动脉压、心率、中心静脉压差异均无统计学意义(均P>0.05),提示心脏手术患者施行肺复张联合低潮气量低呼气末正压机械通气并不影响患者的循环指标。
综上所述,心脏手术患者体外循环期间定时肺复张联合低潮气量呼气末正压持续通气,可改善肺功能,降低术后肺部并发症发生率,有利于预后。

