“通督启神”法两种电针对AD模型小鼠行为学及大脑皮层COX-2、TGF-β1表达的影响*
牟秋杰,嵇 波,李昱颉,刘俊彤,杨利娟,卢梦晗,李志刚
(北京中医药大学,北京 100029)
阿尔茨海默病(Alzheimer’s disease,AD),又称为“老年性痴呆”,约占所有痴呆的60%~80%,是以进行性认知功能障碍和记忆力减退为主要临床表现的中枢神经系统疾病[1],其发病与年龄密切相关,在老年群体中属常见病和多发病[2],严重危害老年人的身心健康,且死亡率较高[3]。据国际阿尔茨海默病协会(ADI)发布的《2016年全球阿尔茨海默病报告》显示,全球AD患者近4 700万人,预计到本世纪中叶将会达到1.3亿人,仅2018年全球用于治疗AD的费用就会达到1万亿美元。AD的发病与环境、遗传、年龄、机体功能状态等诸多因素相关,其发病机制十分复杂,且各种机制相互影响,互为因果,所以AD的治疗也相对复杂,而且疗效不佳,只能在一定程度上改善其临床症状,并不能延缓或阻止疾病的发展。因此,对AD发病机制、治疗方案的探究显得尤为紧迫和重要。
研究显示,AD患者脑内会出现大量β-淀粉样蛋白(Aβ)的沉积并产生具有神经毒性的老年斑(SP);另外,AD患者脑内还会出现Tau蛋白过度磷酸化[4],导致神经原纤维缠结(NFTs)形成。Aβ沉积形成的SP和Tau蛋白过度磷酸化形成的NFTs被认为是AD的两大主要病理改变[5],但随着研究的深入,越来越多的实验证实小胶质细胞(MG)活化所诱导的神经炎性反应已成为AD的第三大病理改变,大量Aβ的沉积会激活MG,产生具有严重神经毒性炎性介质[6],导致神经元的损伤及凋亡,另外还会加速Aβ的沉积,形成恶性循环。“通督启神”法是北京中医药大学针灸推拿学院李志刚教授经过多年的临床实践总结出来的一套对神志类疾病有确切疗效的针法,李志刚教授团队前期研究证实,“通督启神”法电针能够抑制AD模型小鼠海马炎性反应[7]、改善海马神经元的形态结构[8]、提高大脑葡萄糖代谢水平[9]等。基于此,本实验选取7月龄APP/PS1双转基因小鼠为模型小鼠,采用Morris水迷宫观察其行为学变化,Western blot检测其大脑皮层COX-2、TGF-β1表达情况,阐释“通督启神”法两种电针治疗AD的机理及疗效差异。
1 材料与方法
1.1 动物
AD模型动物为7月龄、SPF级、雄性APP/PS1双转基因小鼠,正常对照组为同背景C57BL/6小鼠,体质量(24.6±4.3)g,由南京大学模式动物研究所提供,批号:SCXK(苏)2015-0001。本实验经北京中医药大学实验动物伦理委员会批准。
1.2 主要试剂、药物及仪器
兔多克隆COX-2抗体(英国,Abcam,ab15191);兔多克隆TGF-β1抗体(美国,Proteintech,18978-1-AP);盐酸多奈哌齐(中国,卫材药业有限公司,H20050978,5 mg/片×10片);一次性使用无菌针灸针(中国,北京中研太和医疗器械有限公司,ZYTH2013030504,0.25 mm×13 mm);韩氏电针仪(中国,北京华卫产业开发公司,HANS-LH202);音乐电针仪(中国,深圳圣祥高科技有限公司,ZJ-12H);Morris水迷宫系统(中国,上海欣软信息科技公司,XR-XM101)。
1.3 分组及干预
40只AD模型小鼠随机分为模型组(AD model group,AD)、药物组(Medicine group,M)、脉冲电针组(Electro-Acupuncture group,EA)、音乐电针组(Musical Electro-Acupuncture group,MEA),C57BL/6小鼠为正常对照组(Normal Control Group,N),每组10只,常规、单笼饲养于北京中医药大学动物中心屏障系统。
N组、AD组:与其他组同等条件束缚20 min;M组:盐酸多奈哌齐0.92 mg/kg剂量灌胃给药并同等条件束缚20 min;EA组:将小鼠固定于自制鼠套内,印堂、百会均向后15°平刺进针0.5 cm,针柄连接HANS-LH202电针仪20 min,疏密波,输出频率为2~50 Hz,水沟点刺不留针;MEA组:针刺同EA组,针柄连接ZJ-12H音乐电针仪20 min。每天1次,共15天。
1.4 检测方法
1.4.1 隐蔽平台实验 治疗结束后第1天,为让实验小鼠熟悉水迷宫环境,撤除目标象限(第3象限)平台,从第1象限将实验小鼠放入水池中自由游泳90 s;第2天至第6天恢复目标象限平台并正式实验,入水前将每只实验小鼠放于平台上停顿10 s,然后头朝水池壁,分别从第1象限和第2象限中点放入水池中,游泳登台5 s停止记录时间,即为当次的逃避潜伏期,最长为90 s,两次游泳时间的算术平均值即为当天的逃避潜伏期。本实验主要测试实验小鼠的空间学习能力。
1.4.2 空间探索实验 隐蔽平台实验结束次日撤除目标象限平台,使实验小鼠头朝水池壁,从第1象限中点放入水池中,记录其目标象限游泳时间/总时间和穿越平台次数。本实验主要测试实验小鼠的空间记忆能力。
1.4.3 Western blot检测 每组随机选取5只实验小鼠断头处死(剩余5只用于本课题组其他相关指标检测),迅速剥离大脑,取出大脑皮层置于无菌冻存管中液氮保存。每组新鲜大脑皮层加入含1 mmol/L-1PMSF的RIPA裂解液匀浆并提取总蛋白;然后4℃、10 000 r/min离心10 min,计算上样量;SDS-PAGE电泳;把蛋白转印至PVDF膜上,5%的脱脂奶粉37℃振荡封闭1 h,加入一抗(COX-2 1∶1 500;TGF-β1 1∶3 000;β-actin 1∶5 000)4℃过夜;次日洗膜,加入二抗(1∶7 500)37℃振荡孵育1 h;添加发光液,曝光显影,标定Marker,冲洗晾干,扫描分析。
1.5 统计学方法

2 结果
2.1 各组隐蔽平台实验结果比较
实验期间,各组小鼠逃避潜伏期均呈下降趋势,其中N组最明显,其次依次为MEA组、EA组、M组,最后为AD组。见图1。
实验第1天至第5天,N组与AD组的逃避潜伏期比较均有统计学差异(P<0.05或P<0.01),且差异逐渐加大;与AD组相比,第1天至第2天M组、EA组、MEA组的逃避潜伏期均减少,但无统计学差异(P>0.05),第3天至第5天出现了统计学差异(P<0.01);与M组相比,第1天至第3天EA组、MEA组的逃避潜伏期均减少,但无统计学差异(P>0.05),第4天至第5天出现了统计学差异(P<0.01),说明3种干预方法均能改善AD模型小鼠的空间学习能力,且EA组、MEA组优于M组,但EA组、MEA组之间无统计学差异(P>0.05)。见表1、图1。

表1 不同组别逃避潜伏期比较
注:与N组相比,*P<0.05,**P<0.01;与AD组相比,##P<0.01;与M组相比,△P<0.01。

图1 不同组别逃避潜伏期变化趋势图
2.2 各组空间探索实验结果比较
与N组相比,AD组目标象限游泳时间/总时间、穿越平台次数均减少(P<0.01);与AD组相比,M组、EA组、MEA组目标象限游泳时间/总时间、穿越平台次数均增加(P<0.05或P<0.01);与M组相比,MEA组目标象限游泳时间/总时间增加(P<0.01)。说明3种干预方法均能改善AD模型小鼠的空间记忆能力,就目标象限游泳时间/总时间而言,MEA组优于M组,就穿越平台次数而言,三者无统计学差异(P>0.05)。见表2。
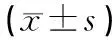
表2 不同组别目标象限游泳时间/总时间、穿越平台次数比较
注:与N组相比,**P<0.01;与AD组相比,#P<0.05,##P<0.01;与M组相比,△△P<0.01。
2.3 各组Western blot结果比较
与N组相比,AD组COX-2、TGF-β1表达均增加(P<0.01);与AD组相比,M组、EA组、MEA组COX-2、TGF-β1表达均减少(P<0.01),说明3种干预方法均能抑制模型小鼠大脑皮层炎性因子的表达;与M组相比,EA组、MEA组大脑皮层COX-2、TGF-β1表达减少(P<0.05或P<0.01),但两者无统计学差异(P>0.05)。见表3、图2。

注:1为N组;2为AD组;3为M组;4为EA组;5为MEA组。图2 不同组别大脑皮层COX-2、TGF-β1表达情况

表3 不同组别大脑皮层COX-2、TGF-β1表达比较
注:与N组相比,**P<0.01;与AD组相比,##P<0.01;与M组相比,△P<0.05,△△P<0.01。
3 讨论
AD属中医学“呆证”范畴,病机为“督脉受阻,神机失用”“髓消脑减”[10]。“脑为元神之府”,与人的精神、神志功能密切相关;“督脉者,贯脊属肾……入络脑……”,督脉是贯通脑与肾的桥梁;脑为髓海,其源于肾之真阴真阳,缘督脉贯注于脑,若督脉受阻,则会髓消脑减、神机失用。“通督启神”法的物质基础为“督脉-脑”系统,以“通督”为治疗方案,达到“启神”的目的,主要治疗精神、神志类疾病[11]。“通督启神”法由印堂、百会、水沟3穴组成:印堂属于督脉穴,位于两眉连线的中点,主要有通督安神的功效;百会位于头的巅顶部位,为手太阳经、足太阳经、督脉、足厥阴经的交会处,又称为三阳五会,直接与脑髓相通,对头部疾病具有很好的疗效;水沟穴位于人中沟中,又称人中穴,为督脉穴位,对癔症、呆证、癫狂痫、急慢惊风等神志病症疗效较好,属“十三鬼穴”。3穴皆位于头部督脉循行线上,与脑髓相通,由“病变在脑,首取督脉”[12]“经脉所过,主治所及”可知,印堂、百会、水沟3穴合用具有“通督启神”之效。
APP/PS1双转基因小鼠是国际公认的AD模型小鼠,广泛用于AD的相关机理研究[13]。该模型小鼠大脑皮层Aβ沉积速度最快[14],学习记忆功能随着Aβ的沉积逐渐下降[15];其脑内Aβ沉积的分布区与AD患者的分布区比较相似[16],在4、5月龄时大脑皮层就已经出现了SP的沉积并出现了认知功能障碍[17],且渐进性加重,对AD患者的病理变化和行为学改变有很好的模拟作用[18],较10月龄而言,6~7月龄APP/PS1双转基因小鼠对认知功能的模拟作用更优,其可能是电针干预AD的最佳时期[19],因此本实验的研究对象为7月龄APP/PS1双转基因小鼠。另外,通过长期临床实践和实验评估,第二代胆碱酯酶抑制剂盐酸多奈哌齐具有高选择性、可逆性优势,可提高胆碱系统的活性和药物的敏感性[20]、减少乙酰胆碱的水解、降低Aβ的神经毒性等,从而起到改善患者临床症状的作用,是治疗轻、中度AD的经典有效药和首选药,因此本实验选取盐酸多奈哌齐为药物组的治疗用药。
Aβ在AD患者脑内的大量沉积会激活MG,产生能够导致神经元损伤及凋亡的炎性介质。由前列腺素(PGs)合成的诱导型限速酶环氧化酶2(COX-2)是环氧化酶(COX)的一种亚型,当小胶质细胞激活后其表达水平显著增加,催化花生四烯酸产生PGs参与神经系统的炎性反应,是炎性反应介导的细胞毒性的决定因素之一,与AD的发病密切相关,能促进SP的形成并加速MG的活化。研究证实,APP转基因小鼠中COX-2表达的增加会引起小胶质细胞和神经元的变性,产生慢性炎症和神经毒性作用,损伤神经系统[21]。由于COX-2与AD关系密切,神经元中COX-2的早期表达是AD患者发展为痴呆的重要标志,揭示其可能增加AD的易感性,可能成为治疗AD的新靶点。转化生长因子β1(TGF-β1)是TGF-β的一种亚型,其在正常脑组织中的表达水平不高,仅少量表达于大脑皮质、脑膜及脉络膜丛细胞,但在病理条件下,病变部位的表达水平就明显增加[22],研究证实,APP转基因小鼠如果同时表达TGF-β1,其脑内Aβ的沉积便会加速,同时还会诱导APP的高表达,加速脑内Aβ的沉积[23],因此,TGF-β1在Aβ的沉积和SP的形成中具有重要作用。本实验研究结果显示,“通督启神”法两种电针均能改善模型小鼠的认知功能,降低大脑皮层COX-2、TGF-β1的表达,说明两种电针均是治疗AD行之有效的方法,但两者的疗效并无统计学差异,其治疗AD的机理可能与抑制MG活化、降低大脑皮层COX-2、TGF-β1的表达有关,但其深层机理还有待于进一步研究。

