糖精废水中铁的回收与纳米NiFe2O4 的制备研究
张惠欣,王培培,王有臣,夏邦望
(河北工业大学化工学院,天津 300131)
糖精废水是生产糖精钠工艺过程中产生的废水,主要为含铁(质量分数约为3.5%)和邻氨基苯甲酸的废水,是一种高浓度、高色度、高盐、高COD(25 200 mg/L)和低pH(<1)的难降解废水,若直接排放不仅会污染环境,还会造成资源浪费。
NiFe2O4纳米材料兼具磁性材料和纳米材料的特点,故在磁分离[1]、催化[2]、微波器件[3]、生物医药[4]等方面展现出了优良的应用前景。 其制备方法有水热 法[5-6]、共 沉 淀 法[7]、模 板 法[8]和 溶 胶 凝 胶 法[9]等。其中,水热法因其工艺流程简单、制备的产物组分纯度高、晶体发育完整和粒径分布均匀等优点受到广泛关注。 笔者以糖精废水作铁源,与硫酸镍发生水热反应,成功地制备了磁性纳米NiFe2O4,并用响应面法考察了共沉淀pH、水热合成时间、水热合成温度和原料物质的量比[n(Fe3+)/n(Ni2+)]等因素及其交互作用对产品纯度的影响, 确定了糖精废水中铁的回收及纳米NiFe2O4最优制备条件。
1 实验部分
1.1 原料与仪器
原料:糖精废水(总铁质量分数为3.5%)、NiSO4、NaClO3、NaOH。
仪器:AND-240 型电子分析天平、pHS-2F 型数显pH 计、TDA-8002 型 恒 温 水 浴 锅、101-1AB 型水热合成烘箱、DGG-101-1 电热鼓风干燥箱、D8 DISCOVER 型X 射线衍射仪、S-4800 型扫描电子显微镜、LAKESHORE7400 型振动样品磁强计等。
1.2 检测方法
糖精废水中铁含量的检测采用HG/T 4324—2012《清洗液中铁含量的测定》的方法测定。 产品中NiFe2O4含量的检测则采用TOPAS 软件对产品XRD 全谱图做无标样相定量分析完成。
1.3 实验方法
1.3.1 糖精废水中铁的回收及纳米NiFe2O4的制备条件的确定
称取4 mmol NaClO3溶于25 mL 糖精废水(含0.02 mol Fe2+),按比例称取定量的NiSO4加入上述溶液中并完全溶解,向溶液中滴加6 mol/L 的NaOH溶液至指定pH,搅拌30 min,全部溶液定量转移至100 mL 反应釜中;将反应釜置于±0.1 ℃的水热合成烘箱中反应一定时间。 将反应釜自然冷却至室温,抽滤并收集反应釜中的固体,依次用无水乙醇和蒸馏水洗涤, 最后于60 ℃下真空干燥12 h 得到干基产品。
1.3.2 糖精废水中铁回收及纳米NiFe2O4制备条件的优化
采用响应面法中的中心复合设计(CCD)方法,进行4 因素3 水平响应面实验的设计与分析,结果见表1。
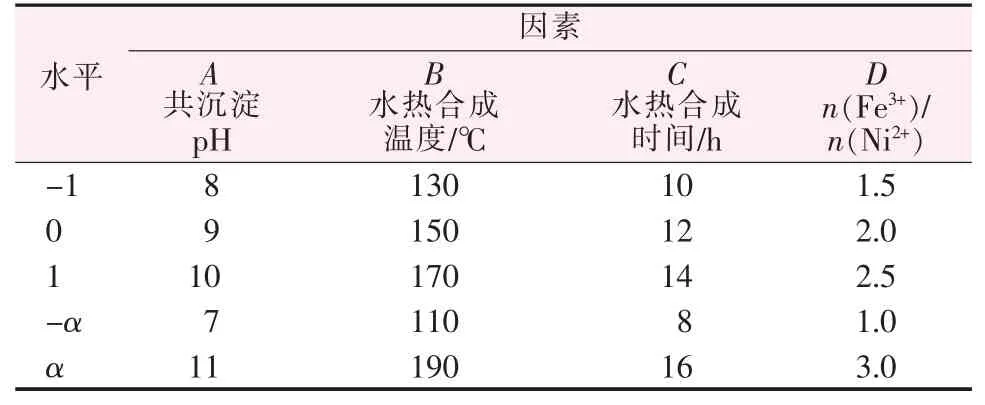
表1 响应曲面优化的因素及水平设置
2 结果与讨论
2.1 糖精废水的主要成分
表2 为糖精废水中铁的含量分析。 表3 为糖精废水在100 ℃恒温水浴锅中蒸发得到的蒸发残渣的组分经XRF 测得的结果。
由表2 和表3 可知,糖精废水中铁的质量分数为3.5%,其中大部分为Fe2+;糖精废水除了含有铁元素以外,还含有多种其他元素,但除钠元素外其他金属元素的含量远小于铁元素含量。 因此,从成分上考虑,从糖精废水中回收铁资源作为反应原料是可行的。
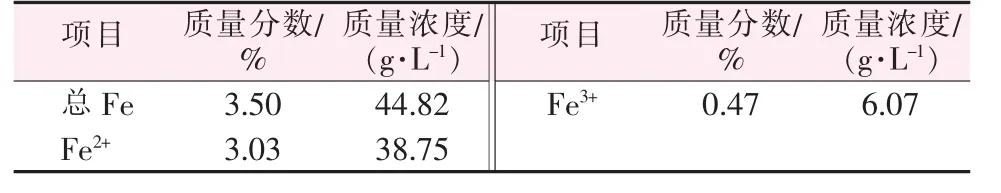
表2 糖精废水的铁组分分析(密度为1 280 g/L)
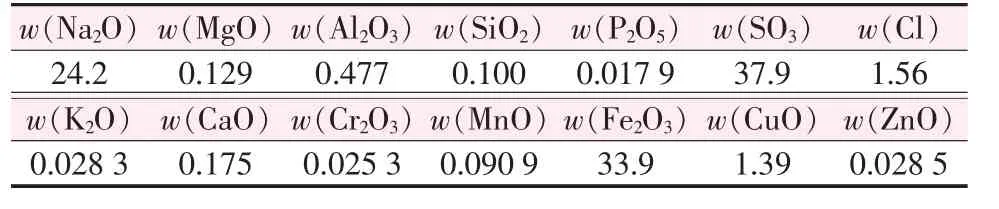
表3 糖精废水XRF 元素组成分析 %
糖精生产过程需要的原料种类繁多,工艺复杂,故其形成的废水中含有邻氨基苯甲酸甲酯、 邻氨基苯甲酸钠、甲醇、邻氯苯甲酸甲酯和苯酐等大量有机物,其COD 高达25 200 mg/L。
2.2 糖精废水中铁回收及NiFe2O4 纳米材料制备条件的优化实验
表4 为多因素优化的实验结果与模型预测值的分析。 其中,1~24 为析因实验,它们主要是共沉淀pH(A)、水热合成温度(B)、水热合成时间(C)和原料物质的量比[n(Fe3+)/n(Ni2+)](D)4 个自变量围绕中心点构成模型的三维结构定点;而25~30 这6 组中心实验则用来估计实验误差。
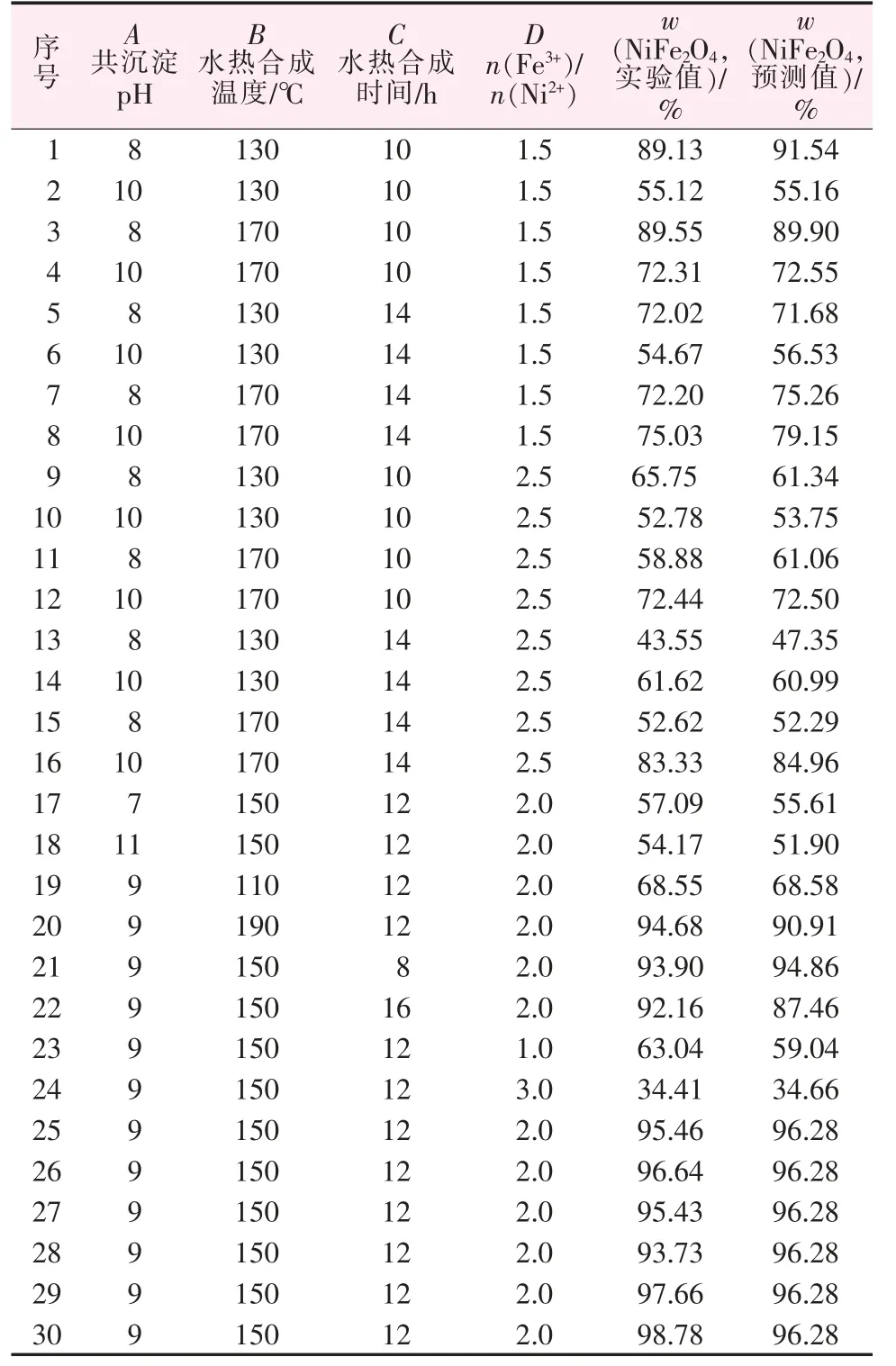
表4 CCD 的响应值及预测值
本文采用二阶模型对表4 中的实验结果做了多元回归拟合, 得到响应值NiFe2O4含量与自变量之间的关系式:

对式1 做方差和显著性分析,结果见表5。 由表5可看出,该方程的回归项是极显著水平(P<0.000 1),失拟项为不显著水平(P=0.060 4),其拟合度R2=0.984 6,预测值与实验值具有高度相关性,响应值的变化为98.46%, 源自所选4 个变量因素的影响。也就是说,式1 可以较好地描述各个因素与响应值之间的真实关系;同时,回归系数的显著性显示,交互相AB、AC和AD的F检验结果均达到显著水平(P<0.05),说明pH 与其他3 个因素之间的交互作用同样都对产品质量有显著的影响。
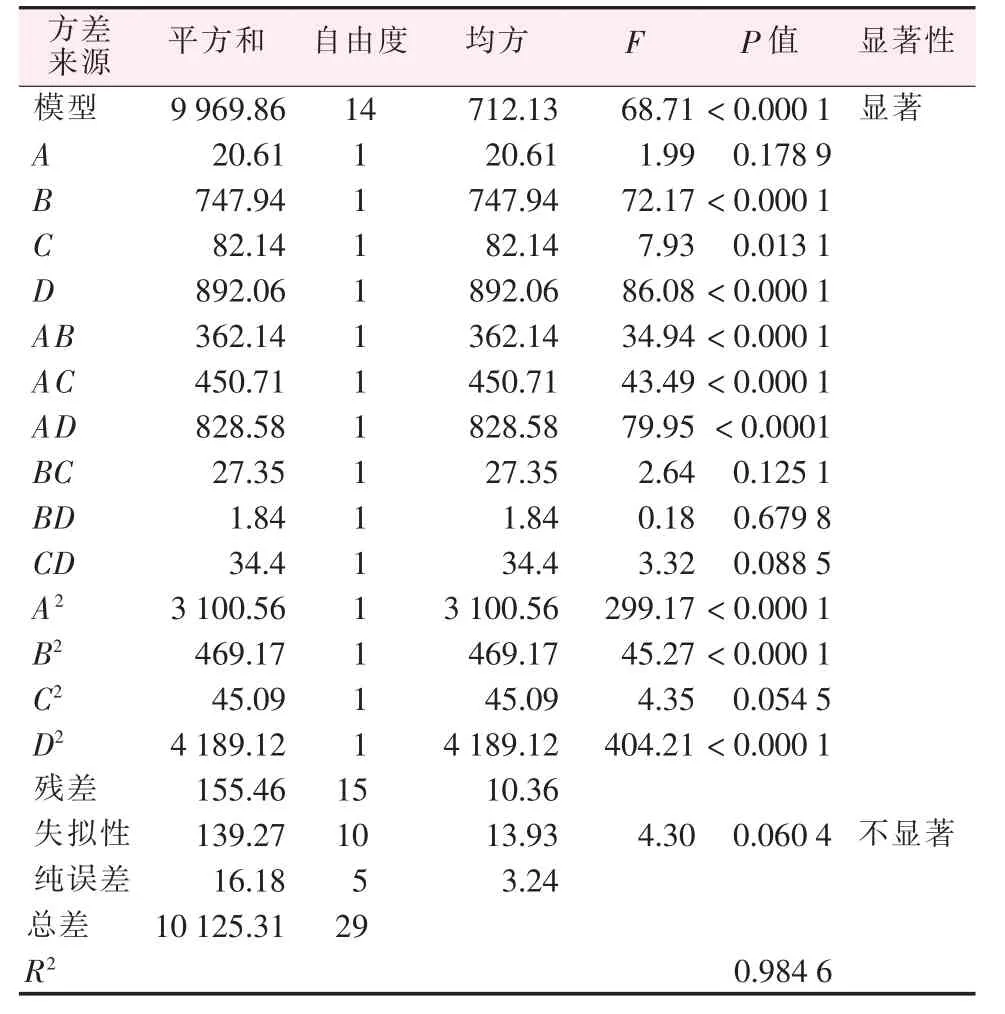
表5 响应值方差分析与显著性分析
图1~3 为各因素与响应值之间的响应面3D 立体图和等高线图。 模型回归方程的响应面三维立体图和等高线图, 等高线的形状可以反映出交互效应的强弱,椭圆形表示2 因素交互作用显著,而圆形则与之相反。 由图1~3 可见,AB、AC和AD交互项的等高线图呈椭圆形, 这3 组交互参数之间存在着强烈的交互效应,这将对相应结果产生显著的影响,印证了前面得出的结论。
为了进一步确定糖精废水中铁回收及NiFe2O4纳米材料制备的最佳条件, 利用Design-expert 软件,选择NiFe2O4质量分数为100%,得到制备NiFe2O4纳米材料的最佳条件:共沉淀pH=9、水热合成温度为150 ℃、水热合成时间为12 h、n(Fe3+)/n(Ni2+)=2,在此条件下糖精废水中铁资源的回收率最高,且COD的去除效果最好,随后的验证实验也证实了这个结论。

图1 共沉淀pH 与水热合成温度对NiFe2O4含量影响的响应面和等高线图

图2 共沉淀pH 与水热合成时间对NiFe2O4含量影响的响应面和等高线图

图3 共沉淀pH 与n(Fe3+)/n(Ni2+)对NiFe2O4含量影响的响应面和等高线图
2.3 产品的表征
2.3.1 NiFe2O4纳米材料的XRD 分析
图4 为优化条件下制得的NiFe2O4纳米材料的XRD 结构精修谱图。 从图4 可以看出,样品在2θ为18.4、30.3、35.7、43.4、53.8、57.4、63.0° 处 给 出 了 与NiFe2O4的(111)、(220)、(311)、(422)、(400)、(511)和(440)晶面对应的特征峰(JCPDS 10-0325),通过jade 软件计算,其结晶度为99.7%,说明结晶完好。利用Scherrer 公式计算出产品的平均晶粒尺寸为15.7 nm。图4 插图为NiFe2O4的晶胞结构示意图,其中1 号球代表四面体位置的元素Ni/Fe,2 号球代表八面体位置的元素Fe/Ni,3 号球代表元素O, 晶胞为立方体结构。

图4 NiFe2O4 纳米材料的XRD 结构精修图(插图为NiFe2O4 的立体晶胞图)
2.3.2 NiFe2O4纳米材料的SEM 分析
图5 为优化条件下制得的NiFe2O4纳米材料的扫描电镜(SEM)照片。 由图5 可见,NiFe2O4的颗粒外形呈近球状,颗粒均匀,具有一定的孔道结构,粒径大约为20 nm, 比利用XRD 分析的晶粒尺寸略大。SEM 分析说明,NiFe2O4纳米材料团聚并不严重,呈现疏松结构,可作为吸附剂和催化剂使用。

图5 NiFe2O4 纳米材料的SEM 照片
2.3.3 NiFe2O4纳米材料的VSM 分析
图6 为优化条件下制得的NiFe2O4纳米材料的磁滞回线。 由图6 可见,NiFe2O4纳米材料的饱和磁化强度和矫顽力分别为35.87 emu/g 和99.87 Oe,其磁滞回线接近重合, 表明NiFe2O4纳米材料为磁性不高的软磁性材料,可以进行磁分离操作,极大地简化了与吸附和催化相关的分离再生。

图6 NiFe2O4 纳米材料的磁滞回线
3 结论
糖精废水中的铁与硫酸镍通过水热反应成功制备了NiFe2O4纳米材料,该工艺简便、快速实现了废物的资源化利用。 选用响应面法对回收条件和纳米材料的制备条件做了研究,最终确定最佳反应条件:共沉淀pH=9、水热合成时间为12 h、水热合成温度为150 ℃、原料物质的量比[n(Fe3+)/n(Ni2+)]为2∶1,在此条件下合成产品的NiFe2O4质量分数为98%,糖精废水中的铁的回收率为95%,其COD 的去除率为82%。 NiFe2O4纳米材料的饱和磁化强度为35.87 emu/g,是软磁性物质,能够满足磁分离应用要求,可用于废物废水处置后的分离与再生。 同时,产品的晶粒尺寸为15.7 nm,晶体发育完整,颗粒呈近球状,堆积疏松,具有一定的孔道结构,在吸附材料和催化剂研究方面具有巨大潜力, 可用于废水中有害物质的催化降解和吸附去除。

