纳米HAP 复合型材料吸附水中镍离子性能
钱 程,张卫民
(东华理工大学省部共建核资源与环境国家重点实验室培育基地,江西 南昌 330013)
镍是地壳中含量较高的第24 种元素,约占地球组成的3%[1]。镍元素被广泛运用的同时,电镀、镍矿开采与冶炼等过程所产生的含镍废弃物均会导致地下水的镍污染。 人体一旦摄入高浓度含镍地下水,将对肺部、肾脏造成严重损害,并且引起肺纤维化和皮肤皮炎等健康问题[2]。
羟基磷灰石(HAP)因具有较好的去除性能、适中的溶解性而常应用于水体重金属污染处理中[3-4]。然而,纳米HAP 在处理污染物时容易发生团聚而导致去除性能的降低[5]。稳定剂的使用、介质材料的改性以及复合型材料的研制均能使团聚问题得到解决。 因此,纳米HAP 复合型材料的运用不仅能解决团聚问题,还能保证可渗透反应墙(PRB)具有良好的渗透性。本实验通过静态吸附、表征分析等方法研究了HAP 复合型材料对水中Ni2+的吸附性能,确定了HAP 复合型材料的可行性, 并为PRB 处理地下水中镍污染物提供了有效数据。
1 实验部分
1.1 试剂与仪器
试剂:四水硝酸钙(AR)、磷酸(AR)、氨水(AR)、石英砂、硝酸镍(AR)、丁二酮肟(AR)、柠檬酸铵(AR)、碘(AR)、碘化钾(AR)、乙二胺四乙酸二钠(EDTA,AR)。
仪器:FE20 型pH 计、AR2140 电子天平、DGG-9070B 型恒温鼓风干燥箱、SHZ-82 型气浴恒温振荡器、722G 型分光光度计、TDL-5-A 离心机、SEM450场发射扫描电子显微镜。
1.2 实验方法
1.2.1 吸附剂的制备
将石英砂浸泡于盐酸后干燥,过筛,称取适量;在240 mL 浓度为0.25 mol/L 的H3PO4溶液中加入氨水,调节溶液pH 为10;随后,将石英砂加入以上溶液并搅拌均匀;再缓慢加入100 mL 浓度为1 mol/L 的Ca(NO3)2·4H2O;期间不断补充氨水使溶液pH 保持为10 并不断搅拌。 反应完成后,陈化24 h。最后离心、洗涤,取出固体并放置65 ℃环境中烘干24 h 后制得吸附剂。
1.2.2 吸附剂的表征
通过低真空扫描电子显微镜(SEM)对吸附前后的纳米HAP 复合型材料以及石英砂做表面变化与能谱变化分析。
1.2.3 静态吸附实验
取一定量HAP 复合型材料,投于50 mL 已知浓度的镍溶液中;放置于温度为26 ℃、转速为165 r/min的恒温振荡箱中振荡4 h。 其后取出静置30 min,过滤,测定溶液中Ni2+的浓度。
1.2.4 镍离子浓度检测方法
取10 mL 过滤后的待测液于25 mL 比色管中,加入2 mL 的50%(质量分数)柠檬酸钠溶液,摇匀;加入1 mL 的碘-碘化钾溶液,加去离子水至20 mL,摇匀;加入2 mL 的丁二酮肟溶液,摇匀;加入2 mL的Na2-EDTA 溶液,定容,摇匀,使用波长为530 nm的分光光度计测定吸光值并计算浓度。
2 结果与讨论
2.1 纳米HAP 复合型材料表征分析
利用扫描电镜对石英砂和复合型材料做表征,结果见图1。 由图1 可见,石英砂表面凹凸不平且颜色为灰黑色, 而复合型材料表面呈平缓光滑状且为灰白色。 根据二者的不同, 证明复合型材料的纳米HAP 已成功包裹石英砂。 根据图1 分析可知,吸附后的复合型材料表面物质有所增加, 说明复合型材料发生了吸附作用。 HAP 主要通过离子交换、吸附、溶解沉淀等作用去除重金属离子[4]。

图1 石英砂(a)、吸附前后(b、c)复合材料扫描电镜照片
图2 为吸附前后的复合材料能谱图。 由图2可知,吸附后复合型材料的元素发生了明显变化,其中吸附后的钙元素波峰有所削弱并且出现镍元素波峰。 由此得知,溶液中的Ni2+与复合型材料中的Ca2+发生了相互转换并发生了阳离子交换作用。
2.2 投加量对吸附镍离子的影响
在初始质量浓度为5 mg/L 镍溶液中依次投入0.05~11.9 g 复合型材料做4 h 的静态投加量实验,结果见图3。 由图3 可知,Ni2+的去除率随投加量的增加而上升。 当投加量小于3.3 g 时,去除率曲线斜率较大;当投加量大于5.2 g 时,曲线趋于平衡且最高去除率达91.8%。但在投加量的增加过程中,吸附量则逐渐下降。 这主要由于复合型材料的增加引起材料表面积与吸附位点的增加[6],促使去除率的上升。 然而,投加量的增加使溶液中的Ni2+不能完全覆盖复合型材料上所有可交换点, 并且还带来颗粒间黏结力与结合位点的干扰[7],从而导致吸附量的下降。因此,考虑PRB 介质的吸附性能与使用成本,实验选择适宜的投加量为5.2 g。

图2 吸附前后的复合材料能谱图
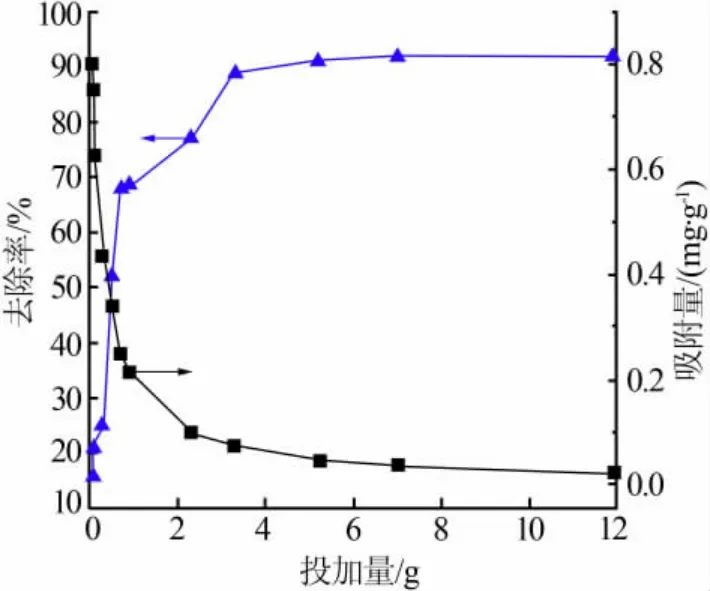
图3 复合型材料投加量对去除镍效果的影响
2.3 初始pH 对吸附镍离子的影响
据文献报道,镍矿及电镀厂周边含镍污染物的地下水pH 为2.8~7.6[8-9]。 为避免Ni(OH)2沉淀和HAP 溶解的产生对实验结果的影响, 实验pH 设定为3~7,投加量设定为5.2 g,考察了初始pH 对去除Ni2+的影响,结果见图4。 由图4 可知,当水环境由酸变碱的过程中,复合型材料对Ni2+的去除率与吸附量逐步上升。当pH 小于4 时,增长速率较快;当pH 为4~7 时,增长速率相对缓慢,而当pH 为7 时得到最大去除率为92.98%,且最大吸附量为0.044 7 mg/g。酸性条件下复合型材料去除效果较差的原因是溶液中H+含量多且竞争能力较强[10],阻碍了复合型材料对Ni2+的吸附。其次,羟基磷灰石的pHpzc(零点电位)范围为4.36~7.6[11]。当水环境pH 小于pHpzc时,复合型材料表面带正电,反之则带负电[12]。 随着水环境pH 的逐步上升,复合型材料的表面电荷由正电变为中性,最后变为负电。 对此,复合型材料对Ni2+的吸附逐渐由物理吸附转变为静电吸引。因此,随着水环境pH 上升。复合型材料对Ni2+的去除率与吸附量不断增长。

图4 初始pH 对去除Ni2+的影响
2.4 反应时间对吸附镍离子的影响
将5.2 g 复合型材料投入pH 为7、体积为5 mL的镍溶液中, 考察了不同反应时间对去除Ni2+的影响,结果见图5。 由图5 可知,随着反应时间的延长,去除率与吸附量均以曲线增长。 当反应时间到达180 min 时,复合型材料对Ni2+的去除率与吸附量达到平衡。 总体而言,整个实验过程可分为3 个阶段。第一阶段为0~120 min 的快速反应阶段,第二阶段为120~180 min 的缓慢反应阶段, 最后一个阶段为180~240 min 的完全平衡反应阶段。 在考虑去除率与处理速率等方面后,复合型材料对溶液中Ni2+的最佳反应时间确定为180 min。
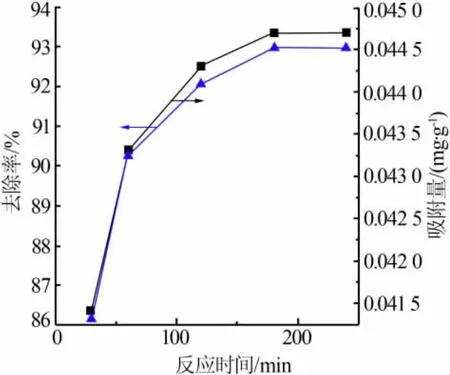
图5 反应时间对去除Ni2+的影响
2.5 溶液初始浓度对吸附镍离子的影响
图6 为溶液初始浓度对去除Ni2+的影响。由图6可见,当浓度增大时,复合型材料对Ni2+的去除率由96.85%逐步降至90.27%,而吸附量则由0.009 mg/g升至0.078 mg/g。此外,去除率曲线在质量浓度为1~3 mg/L 时变化较为平缓,之后变化迅速,当质量浓度为7~9 mg/L 时则回归相对平缓的状态,而吸附量曲线则呈线性增长趋势。对此,吸附量的增长可由菲克定律分析。当溶液中浓度梯度越大时,溶质的分子扩散越大,促使更多重金属离子进入复合型材料中,最终导致吸附量的线性增长。然而,去除率的下降则主要由于投加量不变而浓度增大, 导致Ni2+对材料吸附位点的竞争加剧。
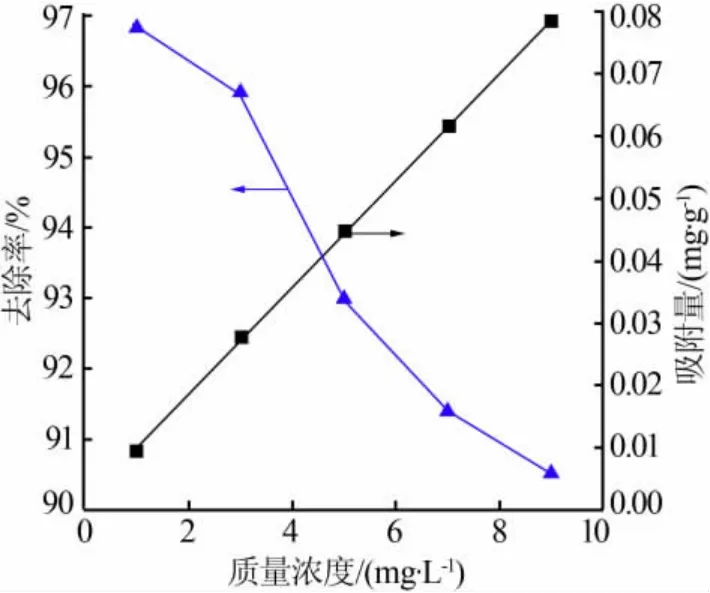
图6 溶液初始浓度对去除Ni2+的影响
2.6 复合材料粒径对吸附镍离子的影响
复合型材料的粒径对材料的渗透性与去除效果影响较大。 实验通过对比3 种粒径材料的吸附效果进行研究。 实验中复合型材料的粒径通过制样前后的过筛来确定,结果如图7 所示。 由图7 可见,各粒径复合型材料对Ni2+的去除率变化较为一致, 去除率均为先快速增长再逐步趋于平衡, 而去除率曲线则随粒径减小依次上移。 当固定各粒径复合型材料投加量时,粒径为0.15~0.3 mm 的复合型材料去除效果最佳。根据比表面积与吸附性能的关系,当复合型材料粒径越小,则比表面积越大,其吸附能力则越强[13]。 因此,粒径较小的复合型材料吸附性能更好。在PRB 的设计中, 为防止污染羽在PRB 中发生绕流,PRB 介质的渗透系数(K)需大于或等于含水层介质的K值。因此选择PRB 介质时需考虑介质的去除效果和介质材料的渗透性能。 因此考虑介质吸附性能的同时需对场地进行水文地质参数的测定,以确定合适的材料粒径。
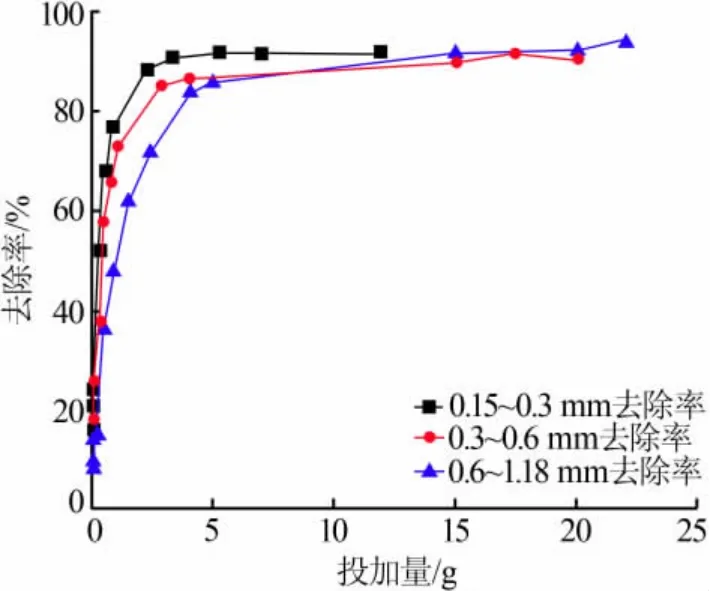
图7 复合材料粒径对去除Ni2+的影响
2.7 等温吸附模型分析
本实验对复合型材料在不同浓度的吸附量做了Langmuir、Freundlich 等温吸附模型线性拟合分析,结果见图8。 Langmuir、Freundlich 等温吸附曲线拟合方程:
Langmuir 等温吸附方程:

Freundlich 等温吸附方程:

式中,qe为不同浓度下吸附量,mg/g;qm为最大吸附量,mg/g;kL为Langmuir 等温吸附常数,L/mg;kF为Freundlich 等温吸附常数,L/mg;ρe为反应平衡时溶液中的镍离子质量浓度,mg/L。
由图8 可知,Langmuir、Freundlich 等温吸附曲线均能较好地拟合实验数据。 表1 为Langmuir 与Freundlich 等温吸附曲线的拟合参数。 由表1 拟合参数可知,Freundlich 等温吸附曲线拟合度更好,说明HAP 复合型材料对溶液中Ni2+的吸附作用为非均匀的多分子吸附。 Freundlich 等温吸附拟合参数1/n可表示吸附剂对金属离子吸附的难易程度。 当1/n为0.1~0.5 时,吸附剂则易于吸收溶液中的金属离子,而当1/n大于2 时则难以吸附[13]。由表1 数据可得1/n为0.657,因此,HAP 复合型材料对于水中Ni2+的吸附效果较好。

图8 Langmuir 与Freundlich 等温吸附曲线

表1 Langmuir 与Freundlich 等温吸附曲线拟合参数(26 ℃)
2.8 吸附动力学分析
为研究复合型材料吸附溶液中Ni2+的动力学特征。现根据准一级动力学方程、准二级动力学方程以及Elovich 方程进行分析。

式中,qt某一时间点的吸附量,mg/L;qe为反应平衡时的吸附量,mg/L;k1、k2分别为拟一级、拟二级吸附速 率 常 数,g/(mg·min);t为 反 应 时 间,min;a、b为Elovich 方程常数。
图9 为吸附动力学方程的拟合曲线。 由9 图可知, 准二级动力学方程拟合度最好,Elovich 方程次之,而准一级动力学方程拟合度较低。 此外,各动力学方程的拟合方差按大小依次顺序为准二级、Elovich、准一级。根据各动力学方程曲线拟合情况以及吸附方程的相关参数(表2),发现准二级动力学方程能较好地描述复合型材料对溶液中Ni2+的吸附过程, 说明复合型材料对Ni2+的吸附主要受化学吸附所控制[14]。

图9 吸附动力学方程拟合曲线
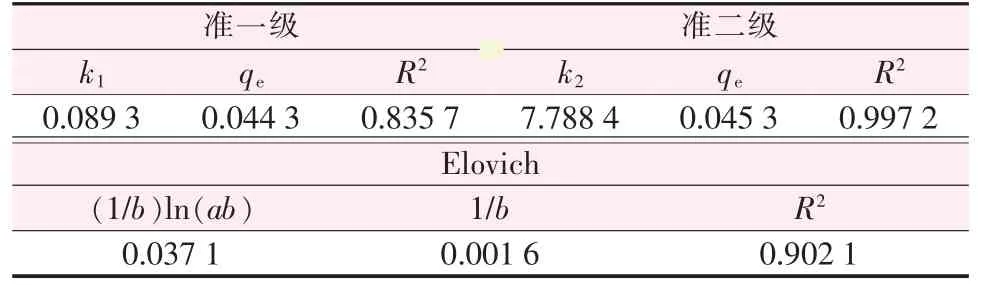
表2 吸附动力学方程拟合参数(5 mg/L)
3 结论
1)投加量、初始pH、初始浓度对纳米HAP 复合型材料吸附Ni2+的过程均有较大影响。 其中,投加量、 浓度对Ni2+的去除率与复合型材料吸附量的影响恰恰相反。 此外,吸附量与去除率随初始pH 增大而增加。 2)在比表面积等因素影响下,粒径为0.15~0.3 mm 的复合型材料去除效果较好,但仍需考虑PRB 对介质渗透性的要求选取粒径。 3)复合型材料对于Ni2+的吸附符合Frenudlich 等温吸附模型和准二级动力学模型。结合电镜扫描结果可知:复合型材料对溶液中Ni2+的吸附作用主要为阳离子交换作用。

