广谱抑菌性多粘类芽孢杆菌的筛选及其细菌素理化特性
(南京师范大学食品科学与工程系,江苏南京 210097)
随着生活水平的提高,人们对食品品质和食品安全越来越重视。食品添加剂的安全性越来越受人们关注,因此占主导地位但有一定危害的化学防腐剂的使用量逐渐减少,而天然防腐剂成为近年来的热点,其中生物保鲜是常用的化学防腐剂的替代方法。生物防腐剂的有效发展可作为化学防腐剂的替代途径,生物防腐剂通过微生物的新陈代谢产生抑菌物质起到防腐保鲜的作用[1]。细菌素已被用于治疗传染病、预防胃肠道疾病、维持人体健康以及作为食品工业中的防腐剂[2]。目前乳酸菌细菌素研究的较多,但在商业中成熟应用较少[3-4]。相比而言,学者对产生抑菌物质的多粘类芽孢杆菌关注相对较少,因为多粘类芽孢杆菌属细菌能够产生多种不同化学结构的抗菌多肽,所以对产细菌素的多粘类芽孢杆菌的研究显得更有意义[5]。广谱抑菌性多粘类芽孢杆菌具有广泛的抑菌性,抑菌成分多为多糖、多肽、蛋白质等。抑菌机理多为作用于目的菌的细胞壁、细胞膜等,从而达到抑菌的效果。
国内外学者从不同的环境中分离筛选出产细菌素的芽孢杆菌。如Kavitha等[6]在水稻的根际土壤中筛选出一株优良多粘类芽孢杆菌VLB16,对稻纹枯病菌的生长具有良好的抑制作用。Balaiah等[7]从发酵番茄果实中分离到一株芽孢杆菌NP75,对革兰氏阳性细菌有显著的抑菌活性。Yang等[8]筛选出一株多粘类芽孢杆菌Jsa-9,其产生的细菌素对食品中的优势腐败菌有良好的抑制作用。Kim等[9]从韩国东大麦根际分离出一株多粘类芽孢杆菌E681,具有促进植物生长和抑制植物病害的能力。目前国内外研究的多粘类芽孢杆菌抑菌普较窄,且多应用于生物防治,在食品防腐中应用极少。为获得新颖、抑菌活性更为稳定的细菌素,本文拟从不同环境中的湖泥、土壤中分离筛选具有广谱抑菌作用的多粘类芽孢杆菌菌株,进而为生物保鲜新品种的开发奠定基础。
1 材料与方法
1.1 材料与仪器
湖泥和根系土壤 取自玄武湖、中山陵景区、南京清凉山、南京国防园、南京师范大学随园校区;金黄色葡萄球菌(Staphylococcusaureus)、赖氨酸芽孢杆菌(Lysinibacillus)、大肠埃希氏杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis) 均由南京师范大学实验室保藏;LB肉汤、LB琼脂培养基、营养琼脂培养基 BR,南京腾春生物试剂有限公司;胃蛋白酶、木瓜蛋白酶、胰蛋白酶、蛋白酶K、氯化钠、革兰氏染色试剂盒、蔗糖 AR,南京腾春生物试剂有限公司;DNA抽提试剂盒、通用引物 上海生工生物工程技术服务有限公司。
CJ-2S型超净工作台 天津市泰斯特仪器有限公司;生化培养箱LRH-250A 广东省医疗器械厂;自动高压灭菌锅HVE-50 南京博惠科学仪器有限公司;ALLEGRA64R台式高速冷冻离心机 美国Beckman Coulter 公司;电子分析天平AUY220 日本ShiMADzu;Phs-3C精密pH计 上海三信仪表厂;DK-8D电热恒温水槽 上海一恒科学仪器有限公司;TH2-C恒温摇床 太仓市实验设备厂;2720 thermal cycle PCR仪 上海巴玖实业有限公司。
1.2 实验方法
1.2.1 芽孢杆菌的分离纯化 取1 g分离样品于9 mL无菌生理盐水中,混匀后于80 ℃水浴30 min,杀死营养细胞,10-1~10-7梯度稀释,取梯度稀释液100 μL涂布于LB固体培养基,观察细菌菌落的形态特征,对疑似菌落进行革兰氏染色[10],挑取产芽孢的革兰氏阳性单菌落于LB固体培养基中培养36 h后,保存于4 ℃冰箱备用。
将已分离的菌株置于LB肉汤液体培养基中180 r/min、37 ℃摇床培养24 h,发酵液经过10000 r/min离心15 min,弃沉淀,0.22 μm的滤膜过滤上清去除菌体,获得拮抗液。利用平板打孔法测定抑菌活性,取大肠杆菌培养液(1.0×108CFU·mL-1)均匀涂布于固体培养基表面,于每个孔中加入100 μL拮抗液,培养24 h,观察抑菌作用,记录抑菌圈直径[11-12]。
1.2.2 H2O2作用的排除 H2O2作用的排除参照张艾青等[13]方法,利用H2O2受热分解的特性,取菌株发酵产物于80 ℃水浴加热10 min,参照1.2.1测定除去H2O2的上清液对大肠杆菌的抑菌直径。
1.2.3 蛋白酶的处理 取排除H2O2作用的拮抗液,分别加入蛋白酶k、胰蛋白酶、胃蛋白酶、木瓜蛋白酶,使酶的终浓度为2 mg/mL,在酶的最适pH下,37 ℃保温2 h,再将pH调回至6.8±0.2,以不加酶液的拮抗液作为对照,参照1.2.1测定蛋白酶和非蛋白酶处理后上清液对大肠杆菌的抑菌直径。
1.2.4 菌株鉴定 根据目标菌的形态特征结合革兰氏染色,并依照《微生物学实验教程》[14]提供的途径进行生理生化实验,参照《伯杰细菌鉴定手册》[15]做出初步鉴定。之后进行16S rRNA序列同源性分析鉴定[16],把得到的测序结果利用NCBI的Gen Bank数据库进行BLAST分析,按照序列同源性选择不同模式菌株,利用MEGA6.06软件构建系统发育树,从而确定菌株XW4的种属。
1.2.5 温度和pH对细菌素的影响
1.2.5.1 温度对细菌素的影响 菌体培养物以2%的接种量接入50 mL LB培养基中,37 ℃培养24 h,取上清液分别于60、80、100、120 ℃水浴中处理30 min,冷却至室温后,参照1.2.1测定上清液对指示菌大肠杆菌的抑菌直径[17]。
1.2.5.2 pH对细菌素的影响 菌体培养物以2%的接种量接入50 mL LB培养基中,37 ℃培养24 h,获得拮抗液,用1 mol/L HCl和1 mol/L NaOH调节无细胞发酵上清液pH,使其pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,37 ℃保温2 h后,再调回至初始pH6.8±0.2,参照1.2.1测定上清液对大肠杆菌的抑菌直径[17]。
相对抑菌率(%)=[(对照组扩展直径-处理组扩展直径)/对照组扩展直径]×100
1.2.6 细菌素抑菌谱 以主要的食源性致病菌大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、金黄色葡萄球菌(Staphylococcusaureus)和克氏原鳌虾优势腐败菌赖氨酸芽孢杆菌(Lysinibacillus)做为指示菌,活化后稀释到1.0×108CFU·mL-1,涂布接种于营养琼脂培养基表面,参照1.2.1测定上清液对各指示菌的抑菌直径[17]。
1.3 数据处理
实验中每组数据均进行3次重复,数据用Excel 2007软件处理。
2 结果与分析
2.1 多粘类芽孢杆菌菌株的筛选
利用高温水浴杀死营养细胞体的方法,从样品中共分离出103株产芽孢细菌,通过革兰氏染色和芽孢染色后,发现其中87株菌同时具有革兰氏阳性、产芽孢、杆状细胞的特点,初步确定这87株菌属于芽孢杆菌属细菌。
2.2 抑菌物质产生菌株的筛选
利用琼脂扩散法,以大肠杆菌为指示菌,对从湖泥中分离的87株芽孢杆菌属细菌进行抑菌活性检测,选取一株抑菌效果最好的菌株将其命名为XW4,结果如图1所示。由图1可见,XW4对大肠杆菌有抑制作用,能形成抑菌圈,图1中该细菌素抑菌圈平均直径为(17.86±0.33) mm,打孔直径为6 mm;选用XW4菌株作为进一步试验的测试菌。

图1 菌株对指示菌的抑菌作用Fig.1 The antimicrobial effect of the selected strain
2.3 排除H2O2的抑菌作用
细菌生长代谢过程所产有机酸、H2O2以及菌体细胞常常也具有抑菌作用,初步筛选的XW4需进一步确定其抑菌活性是否为细菌素所致。由于拮抗液的制作过程包含过滤除菌环节,故排除菌体细胞的影响;此外,在发酵前后上清液的pH无显著变化为6.8±0.2,排除酸的干扰;加热法分解H2O2,结果如图2所示。由图可知上清液排除H2O2后仍然具有显著抑菌作用,抑菌圈直径平均为(16.88±0.71) mm,和处理前相比抑菌性变化不大,初步判断H2O2不是XW4的抑菌物质。

图2 H2O2 排除后的抑菌作用Fig.2 The antimicrobial effect of Bacillus XW4 after eliminating H2O2
2.4 对蛋白酶的敏感性
为确定XW4的抑菌物质是否为蛋白或肽类,分别用木瓜蛋白酶、胰蛋白酶、蛋白酶k、胃蛋白酶对上清液进行处理,抑菌结果见图3。图3表明,拮抗液中加入不同蛋白酶后,加蛋白酶k与对照相比抑菌圈直径显著减小,抑菌活性降低;而木瓜蛋白酶和胰蛋白酶、胃蛋白酶对上清液抑菌活性的影响较小,抑菌圈相对抑菌率为6.82%、5.89%、11.00%,与对照组相比差异不显著;蛋白酶k对其抑菌活性的影响较大,其相对抑菌率为50.5%。从酶处理的结果来看,说明XW4所产抑菌物质为蛋白类的细菌素物质。由于细菌素的氨基酸组成特征不同,造成细菌素对蛋白酶的敏感型不同。
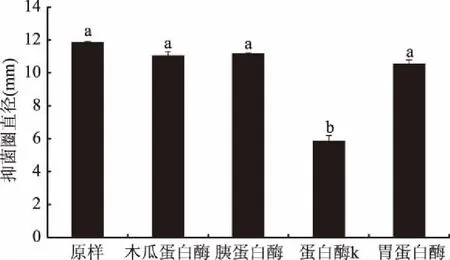
图3 蛋白水解酶对芽孢杆菌XW4细菌素活性的影响Fig.3 The effect of proteolytic enzyme on the activitiy of bacteriocin from Bacillus XW4注:图中不同小写字母表示差异显著(P<0.05)。
2.5 菌株鉴定
2.5.1 菌株XW4菌体形态学观察 由图4可观察到菌落成圆形,直径大小0.9~1.7 mm,白色菌落,半透明,表面光滑湿润,革兰氏染色呈阳性,放大倍数为100时显微镜观察下细胞形状为长杆状。
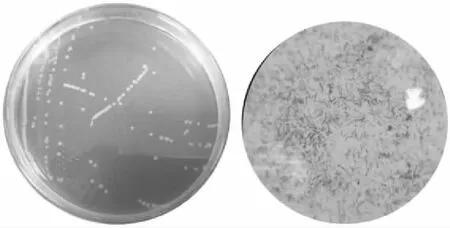
图4 菌株XW4的形态特征Fig.4 The morphological characteristic of train XW4
2.5.2 生理生化特征 菌株XW4的生理生化测定结果见表1。由表1可知,菌株XW4能还原硝酸盐、水解淀粉等。根据鉴定结果查表,并结合革兰氏染色观察结果,可初步确定XW4菌株属于多粘类芽孢杆菌(Paenibacilluspolymyxa)。
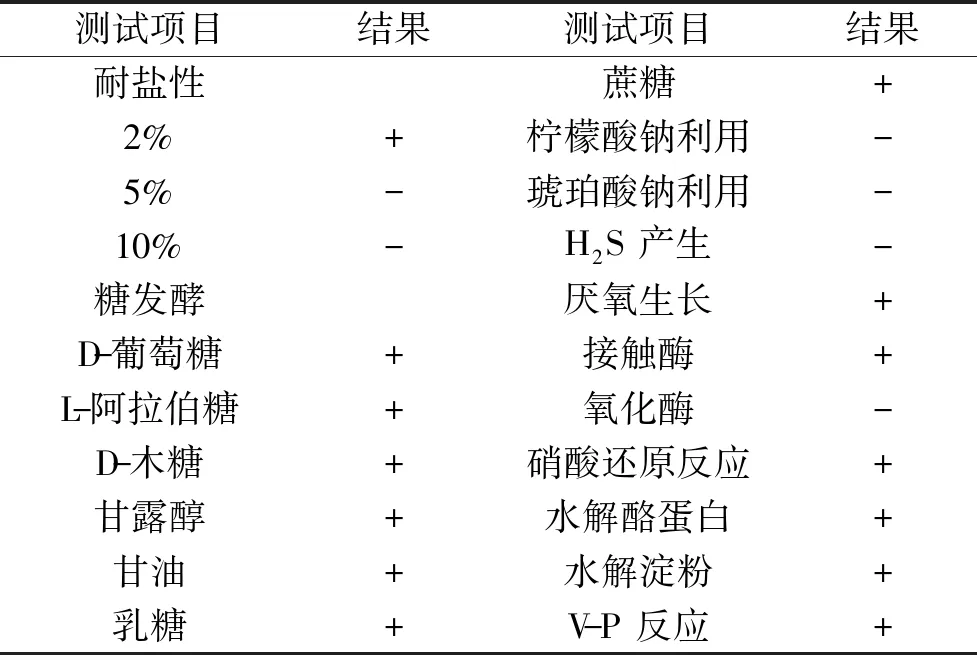
表1 芽孢杆菌XW4的生理生化特征 Table 1 Biochemical characteristic of Bacillus XW4
注:“+”表示为阳性;“-”表示为阴性。
2.5.3 细菌16S rDNA基因序列分析和系统发育树构建 测试菌株XW4经过扩增电泳后得到大约1498 bp的序列。将测序的结果输入到Genebank中,使用Blast功能对目的序列与Genebank库中的已有数据序列进行同源性比对[18]。Clustal X 1.8对齐之后使用MEGA 5.0计算序列相似性,构建系统发育树,发育树结果见图5。软件进行序列分析后,菌株XW4与同源性搜索后关系最近的前2株来自多粘类芽孢杆菌的亲缘性最高,与菌株PaenibacilluspolymyxaKRO58350.1处于同一个小分支,亲缘关系最接近。结合菌落形态学特征和生理生化鉴定的结果,菌株XW4被鉴定为多粘类芽孢杆菌(Paenibacilluspolymyxa)。

图5 菌株XW4的16S rDNA序列系统发育树Fig.5 The developmental phylogenetic tree of XW4 based on 16S rDNA
2.6 温度和pH对细菌素的影响
2.6.1 温度对细菌素的影响 经过不同温度处理后结果如图6所示。由图6可知,菌株XW4的拮抗液经60、80和100 ℃处理30 min后,对大肠杆菌的抑菌活性基本无影响,抑菌圈直径保持在(16±0.30) mm范围内;经120 ℃处理30 min后仍具有一定的抑菌性,表明XW4所产细菌素有显著的热稳定性。研究发现地衣芽孢杆菌产生的杆菌素490是一种新型的食品抗菌剂,在热处理和贮藏过程中表现出良好的稳定性,在高温下也具有杀菌活性[19]。苏云金芽孢杆菌HD868所产细菌素在90 ℃时相对耐热,但煮沸30 min后未检测到菌素活性[20]。地衣芽孢杆菌MKU3所产细菌素在100 ℃ 维持10 min时稳定,在121 ℃时15 min失去活性[21]。苏云金杆菌SF361产生的细菌素,其活性在50 ℃维持30 min时稳定,在80 ℃以上时,维持10 min,其活性降低到无法检测到的水平[22]。解淀粉芽孢杆菌J4产生的细菌素在80 ℃、20 min稳定,在100 ℃、15 min失活[23]。枯草芽孢杆菌sly-3产生的细菌素在100 ℃的温度下保存60 min不会失去任何活性[24]。综上所述与已报道的菌株相比XW4产生的抑菌物质热稳定性突出,有良好的应用前景。
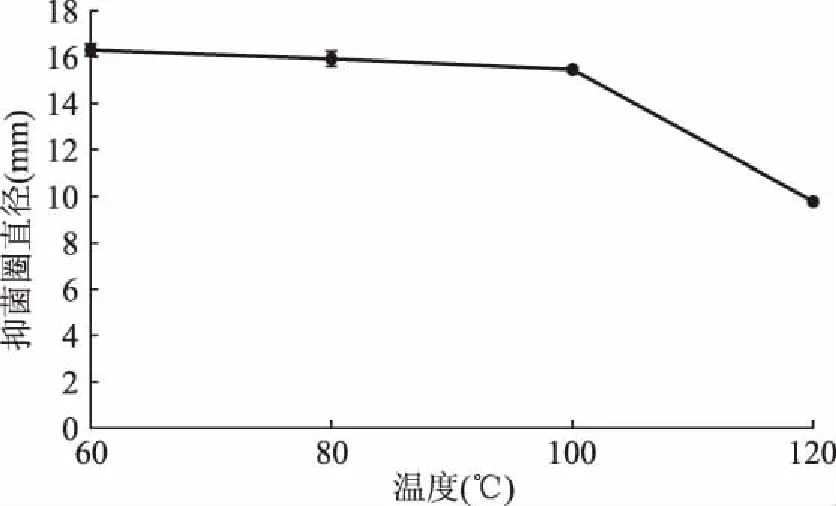
图6 温度处理对多粘类芽孢杆菌XW4抑菌效果的影响Fig.6 Effect of temperature on the activity of bacteriocin from Paenibacillus polymyxa XW4
2.6.2 pH对细菌素的影响 不同pH条件下菌株XW4的拮抗液对大肠杆菌的抑菌活性变化情况如图7所示,由图7可知,XW4所产细菌素在相对较宽的pH范围(pH3.0~11.0)内抑菌活性稳定,pH9.0~11.0的碱性环境中抑菌活性相对其他报道耐受性较强。处于pH7.0的中性条件下抑菌活性最强,低于或高于此值的偏酸或偏碱环境时,抑菌活性会不同程度递减。pH3.0的偏酸环境时,抑菌活力减少到77.04%,pH11.0的偏碱环境中,抑菌活力减少到79.75%。偏碱环境下的抑菌效果强于偏酸环境下的抑菌效果。而相关研究多有报道偏碱环境下的抑菌效果弱于偏酸环境下的抑菌效果。苏云金芽孢杆菌菌株BUPM103中提取的一种新的细菌素F103在pH3.0~10.0范围内活性均稳定[25]。克劳氏芽孢杆菌GM17产生的细菌素在pH3.0~9.0范围内活性均稳定[26]。枯草芽孢杆菌H27产生的细菌素在pH3.0~9.0范围内活性均稳定,在pH10及以上时无活性[27]。多粘类芽孢杆菌JB05-01-1产生的抗菌物质,活性在2~9的pH范围内均稳定[28]。因此,该细菌素的这一特性不但有利于其在弱酸性、中性,而且在碱性食品中都可作为防腐剂的使用。
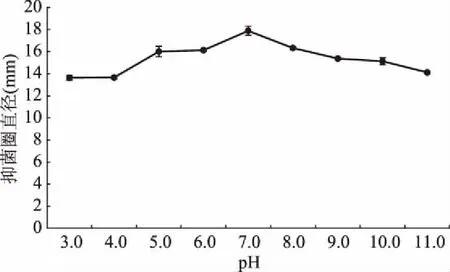
图7 pH对多粘类芽孢杆菌XW4抑菌效果的影响Fig.7 Effect of pH on the activitiy of bacteriocin from Paenibacillus polymyxa XW4
2.7 细菌素抑菌谱
通过平板打孔法检测菌株XW4抑菌普,结果见图8。结果表明,该拮抗液抑菌谱较广,分别对G-菌(如大肠杆菌)和G+菌(如金黄色葡萄球菌)均有良好抑菌作用,抑菌圈的直径均为(17±0.86) mm;对克氏原鳌虾优势腐败菌赖氨酸芽孢杆菌有显著的抑制作用,抑菌圈直径为(18±0.47) mm;对食品中常见腐败菌枯草芽孢杆菌抑菌效果良好,抑菌圈直径为(17±0.37) mm。表明菌株XW4所产细菌素具有广谱抑菌性,对克氏原鳌虾优势腐败菌赖氨酸芽孢杆菌有显著的抑制作用。多粘类芽孢杆菌XW4所产细菌素对食品中的常见优势腐败菌有显著抑制的作用,表明其在生物保鲜方面的应用有良好的前景。

图8 多粘类芽孢杆菌XW4所产细菌素的抑菌谱 Fig.8 Inhibition spectrum of bacteriocin produced by Paenibacillus polymyxa XW4
3 结论
本研究从湖泥中分离得到1株不仅对食物中的腐败菌及致病菌具有显著抑菌作用,而且对水产中克氏原鳌虾优势腐败菌具有良好抑菌作用的芽孢杆菌菌株XW4,经生理生化试验和16S rDNA鉴定为多粘类芽孢杆菌(Paenibacilluspolymyxa)。抑菌物质具有显著的热稳定性,100 ℃ 处理30 min后活性仍为原来的79.63%,120 ℃ 处理30 min后抑菌活性为原来的31.82%。抑菌活性在pH3.0~11.0范围内稳定,XW4的抑菌物质在碱性环境中稳定性与已报道的相比更好,在碱性环境中活性减弱幅度较小且抑菌效果显著,利用这一特性可作为碱性食品保鲜剂。经蛋白酶k处理后抑菌活性显著降低,初步可以推测抑菌活性物质为蛋白质类的细菌素。该抑菌物质抑菌谱较广,包括大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌,且抑菌效果显著。因此,本实验室从克氏原鳌虾分离出的优势腐败菌,其细菌素有显著的抑菌效果,为生物保鲜行业的广泛应用奠定了基础。本研究将会进一步分析菌株XW4的抑菌物质结构、安全性和抑菌机理,为其商业化应用奠定基础。

