薰衣草精油缓释系统的构建及药效学评价
撒玉良,刘盼盼,张敏敏,陈 文
(石河子大学药学院,新疆植物药资源利用教育部重点实验室,新疆石河子 832002)
薰衣草(LavandulaangustifoliaMill.)别名香水植物,是一种珍贵的天然香料,主要分布于地中海沿岸的国家,新疆伊犁是中国薰衣草的最大的生产基地。薰衣草精油提取自花穗,香气宜人,因此作为赋香的主要成分在化妆品和医药方面有广泛的用途[1]。近年来有关薰衣草精油在镇静助眠、抗焦虑、止痛等药理作用方面有大量研究[2-5]。它是一种复杂的混合物,其中以芳樟醇和乙酸芳樟脂的含量最多[6],两者总含量达到60%以上。
缓释制剂是指通过延缓药物从制剂中的释放速率,降低药物进入体内的吸收速率,从而起到更好的治疗效果的制剂。对于精油的缓释制剂主要是通过包合物、脂质体等方法增加精油的稳定性,减缓精油挥发速率,当前精油缓释制剂对于精油的释放速率的控制还没有较好的控制方法,对于精油的外用制剂研究较少,因此,本文通过采用不同材料包合与外用制剂自身对精油的缓释作用,制备具有恒速释放的精油外用制剂[7-8]。
本文针对薰衣草精油在外用制剂中的研究现状,结合增加薰衣草精油稳定性的包合技术,研究薰衣草精油以及β-环糊精(β-CD)包合物、羟丙基-β-环糊精(Hp-β-CD)包合物在4种软膏基质中的释放特点,调整三者加入比例,构建一种初期速释后期恒速释放的精油软膏系统,为薰衣草精油以及其他挥发性成分在外用制剂中的应用奠定实验基础。
1 材料与方法
1.1 材料与仪器
薰衣草精油 新疆伊犁;昆明小鼠 健康雄性,48只,5~6周龄,体重为20~23 g,购买于新疆医科大学动物实验中心,许可证号:SCXK(新)-2019-0003;羊毛脂 天津福晨化学试剂厂;凡士林 天津市福晨化学试剂厂;β-CD、PEG4000、十八醇、Hp-β-CD 天津市盛奥化学试剂有限公司;液状石蜡、三乙醇胺 天津市东天正精细化学试剂;硬脂酸 天津市东天正精细化学试剂;吐温80、司盘80、丙三醇 天津市富宇精细化工有限公司;PEG600、尼泊尔金乙酯 天津市光复精细化工研究所;蒸馏水 自制;5-羟色胺(5-HT)、多巴胺(DA)、去甲肾上腺素(NE)试剂盒 上海酶联生物科技有限公司。
KQ-500DE数字化超声清洗仪 昆山市超声仪器有限公司;6890气相色谱仪 美国Agilent公司;DB-YSD-1C小动物自主活动测定仪 北京智鼠多宝生物科技有限责任公司。
1.2 实验方法
1.2.1 薰衣草精油含量测定
1.2.1.1 气相色谱条件 色谱柱:HP-5 30 m×0.25 mm×0.25 μm;载气:氮气,流速为2.0 mL/min,进样口温度为250 ℃,柱箱升温程序为:初始柱温80 ℃,以15 ℃·min-1的速率升温至150 ℃(保持1 min),继续以15 ℃·min-1的速率升至260 ℃(保持1 min),分流比为35∶1,进样体积1 μL,FID检测器温度为300 ℃,氮气流量35 mL·min-1,空气流量350 mL·min-1,氢气流量35 mL·min-1,隔垫吹扫为3 mL·min-1。
1.2.1.2 芳樟醇对照品线性考察 精密称取芳樟醇对照品8.5 mg置于10 mL的容量瓶中,用一定量的丙酮稀释并定容至刻度线,即得对照品溶液母液。精密量取一定量的芳樟醇对照品母液于5 mL的容量瓶中,分别配制成质量浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg·mL-1的对照品溶液,通过0.22 μm的微孔有机滤膜进行过滤,备用。
1.2.1.3 专属性试验 精密吸取芳樟醇对照品溶液、薰衣草精油溶液、以及空白对照(丙酮),按照1.2.1项下的色谱条件进样,进行图谱对比。
1.2.1.4 精密度考察 吸取高、中、低质量浓度(0.05、0.40、0.85 mg·mL-1)的芳樟醇对照品溶液,连续进样6次,分别记录芳樟醇的峰面积,并计算其RSD。
1.2.1.5 稳定性考察 吸取中等质量浓度的芳樟醇对照品溶液(0.40 mg·mL-1),在制备后的0、2、4、6、8、10、12、18和24 h,按照1.2.1项下的色谱条件进样,记录芳樟醇在不同时间点的色谱峰峰面积,计算其RSD。
1.2.1.6 加样回收率 精密量取薰衣草精油5份,每份2.0 mL,分别加入一定浓度的芳樟醇对照品溶液各1 mL,按照1.2.1项下的色谱条件进样,计算芳樟醇的加样回收率。
1.2.2 不同基质薰衣草精油软膏的制备
1.2.2.1 油性软膏基质的制备 称取凡士林8.0 g,羊毛脂2.0 g,液体石蜡2.0 g,将称取的凡士林、羊毛脂、液体石蜡置于烧杯中,于80 ℃的恒温水浴锅中加热融化后混合均匀,慢慢加入薰衣草精油1.5 g,持续搅拌至冷凝,即得薰衣草精油油性软膏[9]。
1.2.2.2 水性软膏基质的制备 按PEG600与PEG4000质量比为6∶4分别称取PEG600 7.2 g,PEG4000 4.8 g,置于烧杯中与80 ℃水浴条件下加热熔融,混合均匀后,加入薰衣草精油1.5 g,在不停搅拌下冷却至室温,即得薰衣草精油水溶性软膏。
1.2.2.3 水包油(O/W)软膏基质的制备 称取凡士林3.0 g、硬脂酸1.0 g、单硬脂酸甘油酯1.0 g置于适当的烧杯中,加热至80 ℃左右融化,向其中加入1.5 g薰衣草精油,混合均匀。另取吐温80 2.0 g、丙三醇2.0 g、水4.0 g,将其加热至油相相同的温度,将油相在600 r/min搅拌条件下缓慢加入水箱中,直至全部乳化后,置于室温条件下搅拌至冷凝即得[10]。
1.2.2.4 油包水(W/O)软膏基质的制备 称取羊毛脂3.0 g、凡士林3.0 g、液体石蜡3.0 g、单硬脂酸甘油酯1.0 g加热至80 ℃熔融,再加入薰衣草精油1.5 g,混合均匀;另取司盘80 1.2 g、甘油2.0 g、水2.0 g混合溶解并加热至同样的温度,在600 r/min的搅拌条件下,将水相缓慢加入油相中,直至全部乳化后放置冷却即得。
1.2.3 薰衣草精油软膏释放度测定方法及释放曲线绘制 称取已制备好的软膏同等质量,均匀涂抹在口径为5 cm的10个称量瓶中,将称量瓶置于37 ℃的水浴锅中,在恒温条件下释放一定的时间,分别在0、0.5、1、2、3、4、6、8、10 h向称量瓶中加入5 mL的丙酮溶液,在500 W的超声条件下超声萃取20 min,将超声处理后的软膏丙酮溶液,采用微孔滤膜进行过滤,采用GC法进行测定,绘制释放曲线。
测定不同时刻的薰衣草精油在油性基质、水溶性基质、水包油基质以及油包水基质中残留量,将所测定的色谱峰面积代入标准曲线中求出丙酮萃取液中薰衣草精油的浓度,按照以下公式计算累计释放率:
其中:C0、V0为释放0 h时丙酮萃取液的浓度(mg/mL)及体积(mL),Ci、Vi分别为某个时间萃取液的浓度(mg/mL)及体积(mL)。
1.2.4 薰衣草精油释放评价方法 根据《中国药典》对于缓控释制剂的指导原则,采用综合评分的方法,对处方中1、6、10 h的累计释放度分别为30%、50%、80%作为考察指标,对其进行加权评价,评分公式为:
L=|L1-30%|×100+|L6-50%|×100+|L10-80%|×100
其中,L值越小,越接近于药典规定的缓控释制剂的释放过程,其缓释系统越好[11]。
1.2.5 薰衣草精油包合物的制备及表征
1.2.5.1 薰衣草精油β-CD包合物的制备 准确称取一定质量的β-CD,置于适宜容积的烧杯中,加入一定量的蒸馏水,在80 ℃水浴条件下搅拌配制成饱和水溶液,按照芯材比为1∶5称取薰衣草精油,并用相同体积的无水乙醇稀释后,在搅拌温度为45 ℃,搅拌速率为400 r·min-1的条件下缓慢加入已制备好的β-CD的饱和溶液中,包合2.0 h后冷却至室温,放置于4 ℃的冰箱中过夜,抽滤,将滤饼用无水乙醇冲洗3次后,在50 ℃的鼓风干燥箱中干燥,即得β-环糊精包合物[12-14]。
1.2.5.2 薰衣草精油Hp-β-CD包合物的制备 精密称取Hp-β-CD 4.0 g,加入40 mL的蒸馏水中,在35 ℃条件下搅拌,制备成澄清溶液,取精油1.0 g,用同样体积的无水乙醇稀释混匀,在搅拌速率为400 r·min-1,水浴温度为35 ℃条件下缓慢加入已制备好的Hp-β-环糊精溶液中,包合1.5 h后,冷却至室温,在4 ℃条件下放置过夜,在-92 ℃条件下冷冻干燥,将干燥产物用丙酮洗涤3次,干燥即得Hp-β-环糊精包合物[15-16]。
1.2.5.3 包合物红外表征 采用KBr压片法。光谱条件:分辨率:4 cm-1,扫描速度:0.6329 cm-1/s,光圈:100 μm×100 μm,光谱范围:4000~400 cm-1。分别对薰衣草精油、β-CD(Hp-β-CD)、β-CD(Hp-β-CD)与薰衣草精油的物理混合物以及薰衣草精油β-CD(Hp-β-CD)包合物样品红外区间吸收峰的变化进行分析。
1.2.6 精油包合物加入对薰衣草精油软膏释放的影响
1.2.6.1 不同环糊精类型的包合物对精油释放的影响 根据以上实验结果,选择O/W乳膏基质作为研究对象,按照1.2.2项下的水性乳膏制备方法制备乳膏基质,在制备的乳膏基质中加入精油以及相等于精油质量的Hp-β-CD包合物和β-CD包合物,并按照1.2.3项下的释放方法进行测定,并对其结果进行综合评分和分析。
1.2.6.2 不同比例的精油与β-CD包合物加入乳膏基质对精油释放的影响 根据实验结果,将释放速率最快的精油和释放速率最慢的β-CD包合物按照一定的比例(精油与包合物中所含精油的质量比)加入乳膏基质中,依次按照精油:β-CD包合物为1∶1、2∶1、3∶1、4∶1、5∶1制备乳膏,并测定其累计释放率,计算综合评分L。
1.2.6.3 不同比例的精油与Hp-β-CD包合物加入乳膏基质对精油释放的影响 根据实验结果,将释放速率最快的精油和释放速率最慢的Hp-β-CD包合物按照一定的比例(精油与包合物中所含精油的质量比)加入乳膏基质中,依次按照精油:Hp-β-CD包合物为1∶1、2∶1、3∶1、4∶1、5∶1制备乳膏,并测定其累计释放率,计算综合评分L。
1.2.6.4 不同比例的精油与两种包合物加入乳膏基质对精油释放的影响 根据以上对精油和两种包合物在乳膏中的比例选择结果可知,当加入精油过多时,释放过程中会出现突释现象,而包合物比例过高,精油10 h累计释放量不能满足缓释制剂的要求,结合以上结果推断精油比例为70%~85%时,制备的乳膏缓释效果较好。因此,根据精油和两种环糊精包合物在O/W乳膏中的释放速率不同,改变精油:Hp-β-CD包合物:β-CD包合物为5∶1∶1、6∶1∶1、10∶2∶1、20∶3∶2、25∶4∶1,分别制备乳膏,测定其累计释放率计算累计释放率综合评分L。
1.2.7 薰衣草精油缓释乳膏药效学评价
1.2.7.1 失眠模型的建立及判断 PCPA溶液配制:根据预实验结果,以小鼠腹腔注射剂量为350 mg·kg-1,用生理盐水进行溶解,用NaOH溶液调节pH为7~8,配制成给药体积为0.01 mL·g-1的PCPA混悬液,在每天早上10点左右,除对照组小鼠外,其余小鼠通过腹腔注射PCPA混悬液进行失眠模型的建立,连续注射2 d,第一次腹腔注射PCPA混悬液后,28~30 h后,小鼠出现昼夜节律消失,白天活动不停,睡眠时间减少,食量减少以及饮水量增加。在第一次给药36 h后,对照组及造模组进行戊巴比妥钠翻正实验,记录对照组和模型组的睡眠潜伏期和睡眠持续时间,根据两组中的睡眠潜伏期和睡眠持续时间判断失眠模型是否复制成功[17-18]。
1.2.7.2 实验分组及方法 取健康昆明小鼠48只,采用随机数字表法分为4组,每组12只,分为对照组(生理盐水)、模型组(空白乳膏基质)、薰衣草精油组(50 mg纯精油加30 mL的温开水配制成的香薰液)以及缓释乳膏组(相当于50 mg薰衣草精油的缓释乳膏),每天10点进行香薰,香薰8 h,连续香薰5 d[19-20]。
1.2.7.3 小鼠体重变化 PCPA药物造模法复制的失眠模型造成小鼠失眠后,会出现食量减少,饮水增多,毛色发黄,具有攻击性等特点,在造模前和香薰结束时,分别称取各组小鼠体重,对比体重增加量。
1.2.7.4 薰衣草精油缓释乳膏对戊巴比妥钠小鼠睡眠时间的影响 在通过戊巴比妥钠翻正实验睡眠潜伏期和睡眠持续时间的对比,确定造模成功后,除对照组和模型组不进行香薰外,薰衣草精油组和缓释乳膏组在香薰盒中分别以含有50 mg的薰衣草精油香薰液以及相当于50 mg精油的缓释乳膏,通过加热装置在37 ℃条件下,香薰8 h,连续香薰5 d,在最后一次香薰结束1 h后,通过腹腔注射给予小鼠50 mg·kg-1戊巴比妥钠(通过前期预实验所得到的引起100%小鼠睡眠的最小剂量),分别观察和记录各组小鼠的睡眠潜伏期和睡眠持续时间,进行比较。
1.2.7.5 薰衣草精油缓释乳膏对小鼠自主活动的影响 将各组小鼠连续香薰5 d,每天8 h,在最后一次香薰结束后30 min 内,将小鼠置于一个干净的鼠笼中,适应2 min 后,打开小鼠自主活动测定仪,测定和记录5 min内小鼠活动的次数,比较各组自主活动差异性。
1.2.7.6 小鼠下丘脑中5-HT、NE以及DA含量变化 在连续香薰5 d后,快速断头处死,在冰块上快速剥离小鼠脑组织,称重后置于已准备好的冷冻管中,放入液氮中进行快速冷冻后,将其移至-80 ℃的超低温冰箱中,采用ELISA试剂盒进行三种神经递质测定,测定方法按照ELISA试剂盒说明书进行测定,对各组小鼠脑组织中的5-HT、DA和NE的含量进行比较[21]。
1.3 数据处理
使用SPAA 20.0统计软件进行分析,实验数据用均值±标准差表示,组间比较用单因素方差分析。
2 结果与分析
2.1 薰衣草精油方法学考察
2.1.1 线性考察 按照1.2.1项下的实验方法,以纵坐标为气相色谱峰峰面积,横坐标为两个标准品的浓度,绘制标准曲线,芳樟醇标准曲线见图1,得到标准曲线方程为A=20052c+228.8,R2=0.9992。
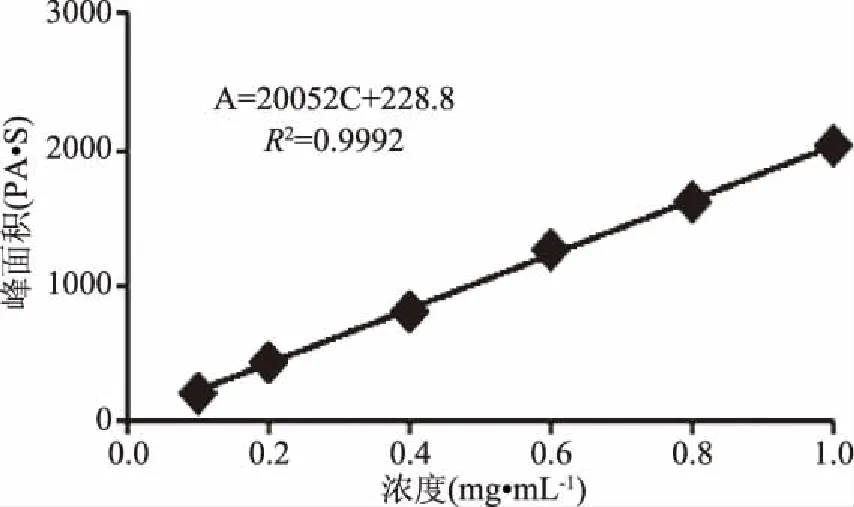
图1 芳樟醇标准曲线Fig.1 Linalool standard curve
2.1.2 专属性考察 根据1.2.1项下的专属性考察方法和色谱条件进样测定,其色谱图见图2,结果显示在该色谱条件下,对照品与薰衣草精油溶液中的芳樟醇出峰位置一致,均为6.1 min,而空白试剂丙酮对其出峰无影响。
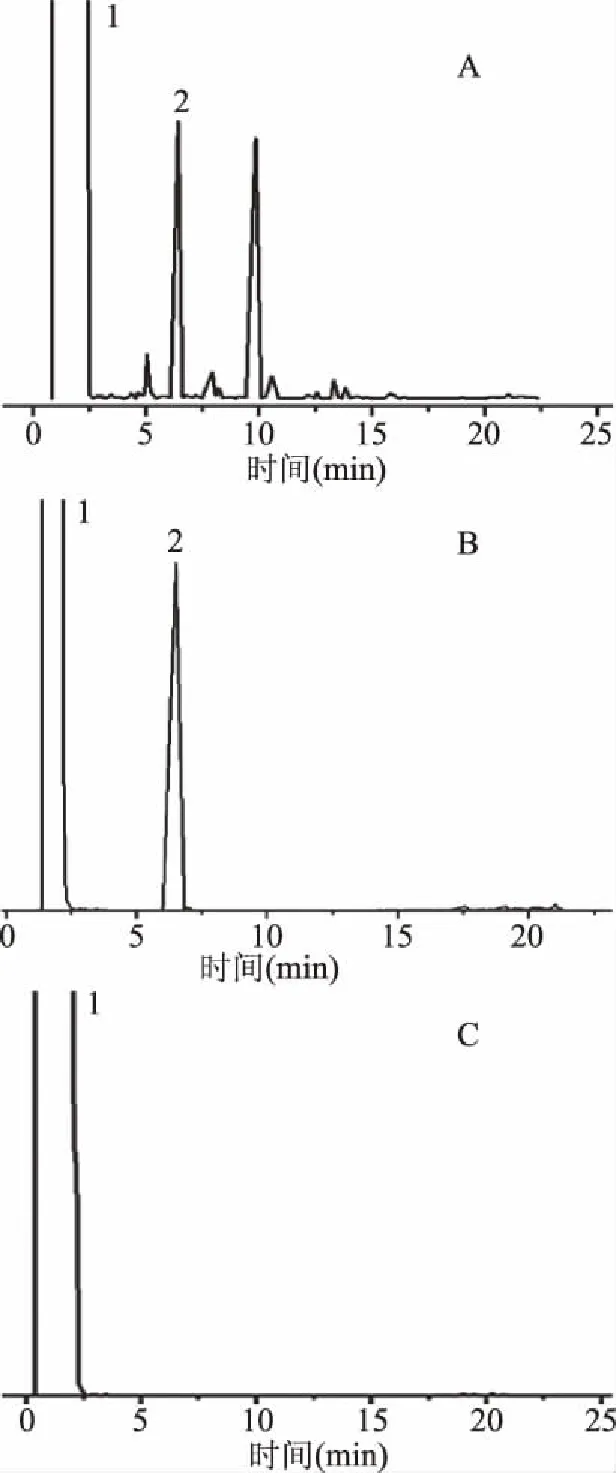
图2 薰衣草精油(A)、芳樟醇(B)和阴性对照色谱图Fig.2 Chromatograms of lavender essential oil(A), linalool(B)and negative control注:A:薰衣草精油溶液;B:芳樟醇对照品溶液; C:丙酮;1:丙酮;2:芳樟醇对照品。
2.1.3 精密度考察 吸取高、中、低三个质量浓度的芳樟醇对照品溶液,连续进样6次,结果显示其峰面积RSD分别为1.35%、0.59%、2.85%(n=6),表明精密度良好。
2.1.4 稳定性考察 根据1.2.1项下的稳定性考察方法和色谱条件进行测定,结果显示在对照品溶液制备后0、2、4、6、8、10、12、18和24 h其色谱峰面积RSD为2.4%,表明芳樟醇在24 h内稳定。
2.1.5 加样回收率 根据1.2.1项下的加样回收率考察方法和色谱条件,得到芳樟醇平均加样回收率为98%±1.2%(n=5)。
2.2 薰衣草精油软膏释放度测定方法及释放曲线绘制
采用1.2.1项下精油释放及测定方法所得精油及其在不同软膏基质中的释放曲线见图3,计算各种基质软膏的累计释放综合评分,其结果见表1。
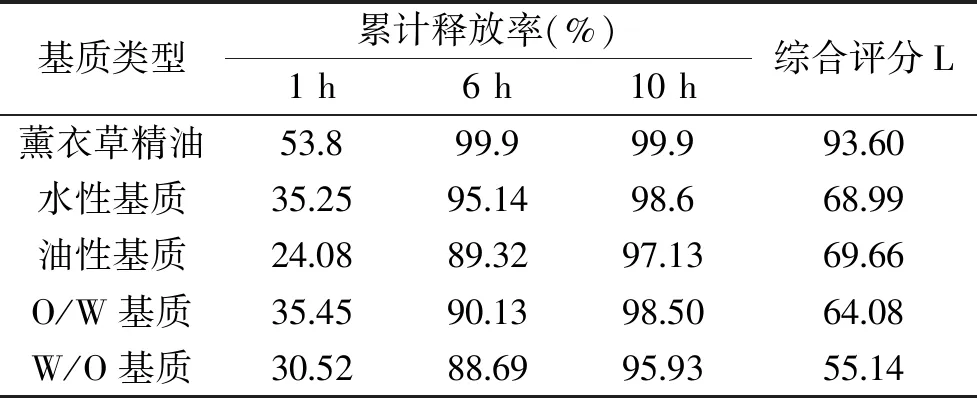
表1 不同基质累计释放率综合评分Table 1 Comprehensive scores of cumulative release rates of different substrates
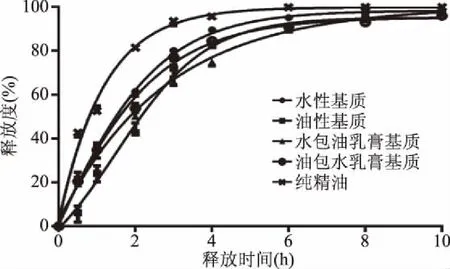
图3 薰衣草精油在不同基质中的释放曲线Fig.3 Release curve of lavender essential oil in different matrices
由图3的实验结果可以看出,将薰衣草精油加入4种基质中的任何一种机制,其对于精油的释放均有一定的缓释作用,纯薰衣草精油在4 h释放95%以上,而且其在0~2 h时的释放速率较快,能够很快达到一定浓度,在4 h以后精油的释放基本结束,不具有缓释作用。将薰衣草精油加入不同类型的基质中,其释放速率具有明显的减弱,能够达到一定的缓释作用。根据表1的实验数据,L值越小,表示精油在该基质中的释放越接近于《中国药典》规定的缓释制剂的释放规律,根据实验数据应该选择W/O基质作为研究对象,但是W/O基质在使用过程中有难以清洗、容易污染,以及不利于皮肤通透性等缺点,因此选择O/W乳膏基质作为研究对象,进一步薰衣草精油缓释系统进行研究。
2.3 薰衣草精油包合物红外表征
薰衣草精油包合物若卫星城,则基本为两者的混合物IR图形,主要呈现两者光谱的叠加,若包合物已形成,则挥发油分子的红外振动受到限制,整个包合物主要应呈现β-CD、Hp-β-CD的IR图形。利用这种性质,可以判断包合物是否包合成功。由图4、图5可知,薰衣草精油特征峰在1744 cm-1处,β-CD和Hp-β-CD在此处没有特征吸收峰,薰衣草精油与β-CD、Hp-β-CD的混合物在1742 cm-1处有薰衣草经的特征吸收峰,而薰衣草精油β-CD包合物中这些吸收峰明显减弱,表明薰衣草精油与β-CD、Hp-β-CD结合生成了新的物相,而非简单的物理混合。
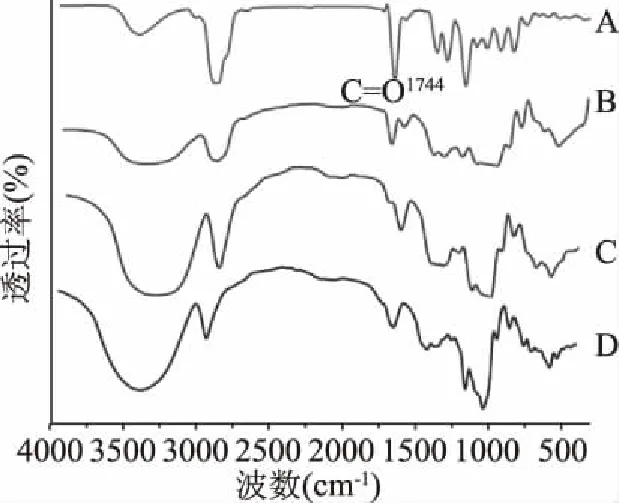
图4 β-CD包合物红外色谱图Fig.4 Infrared chromatograms of β-CD inclusion complex注:A:精油;B:物理混合物; C:薰衣草精油β-CD包合物;D:β-CD。
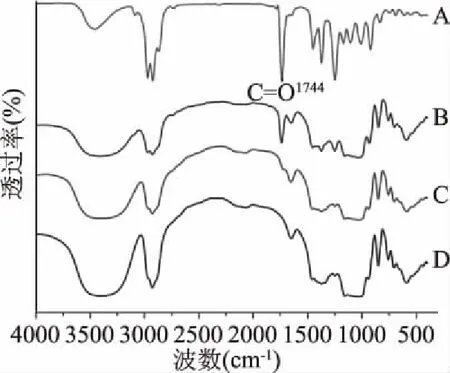
图5 Hp-β-CD包合物红外光谱图Fig.5 Infrared chromatograms of Hp-β-CD inclusion complex注:A:薰衣草精油;B:物理混合; C:Hp-β-CD包合物;D:Hp-β-CD。
2.4 精油包合物加入对于薰衣草精油软膏释放的影响
2.4.1 不同环糊精类型的包合物对精油释放的影响 采用1.2.6项下的实验方法进行实验,将不同的乳膏进行体外释放,并进行释放曲线的拟合,计算曲线的累计释放综合评分,结果见图6。
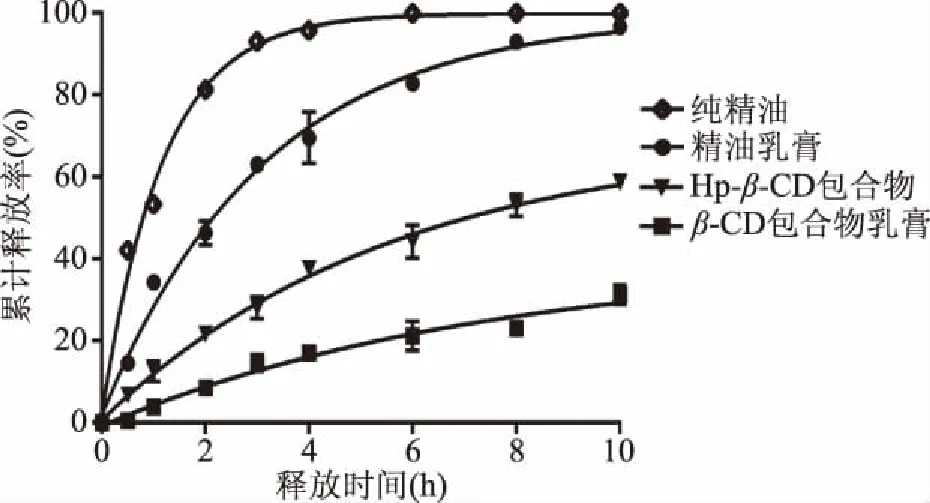
图6 不同类型环糊精包合物对精油释放的影响Fig.6 Effects of different types of cyclodextrin inclusion complexes on essential oil release
通过图6可知,精油乳膏、Hp-β-CD包合物乳膏以及β-CD包合物乳膏对于薰衣草精油的释放都具有一定的缓释作用,其缓释效果依次为β-CD包合物乳膏、Hp-β-CD包合物乳膏以及精油乳膏,其中β-CD包合物乳膏和Hp-β-CD乳膏可能是由于其精油释放过程要通过两次释放,因此对精油的缓释作用更强,而Hp-β-CD较β-CD其水溶性较好,因此释放速度快于β-CD包合物乳膏。薰衣草精油、精油乳膏、Hp-β-CD包合物乳膏、β-CD包合物乳膏综合评分L值分别为93.60、66.95、67.08、103.69,Hp-β-CD包合物乳膏的释放,最接近药典规定的缓释制剂,其L值为67.08,而β-CD包合物乳膏因其释放速率最慢,而不符合缓释制剂的释放过程。因此可以利用三种不同类型的乳膏的释放速率,改变精油、β-CD包合物、Hp-β-CD包合物的比例,建立一个良好的薰衣草精油缓释系统。
2.4.2 不同比例的精油与β-CD包合物加入乳膏基质对精油释放的影响 采用1.2.6项下的实验方法进行实验,将不同的乳膏进行体外释放,并进行释放曲线的拟合,计算曲线的累计释放综合评分,其结果见图7。
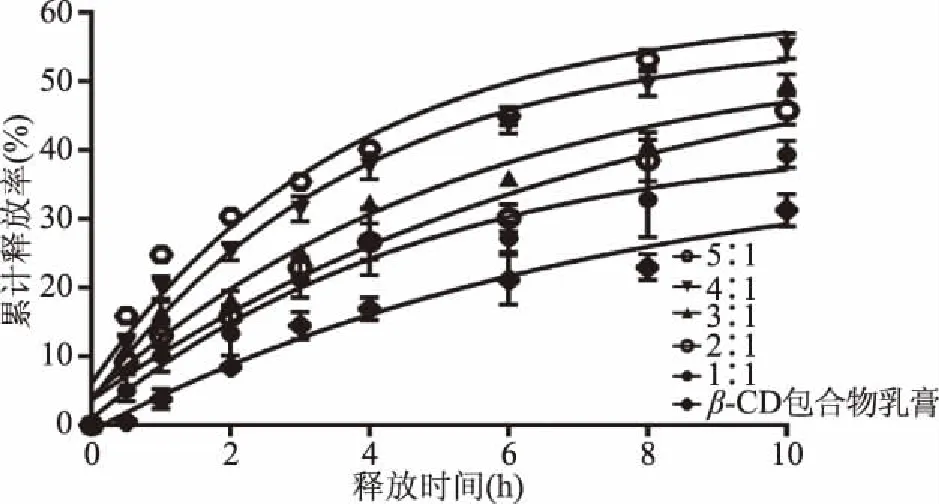
图7 不同比例的精油与β-CD包合物对精油释放的影响Fig.7 Effects of different proportions of essential oils and β-CD inclusion complex on essential oil release
由图7可知,按照不同比例向乳膏基质中加入薰衣草精油与β-CD包合物,因精油本身挥发性较高,所以乳膏中精油的释放速率随着精油所占比例的增加而加快,而且精油含量较高的乳膏,其在10 h精油的累计释放率最高,由图7的释放曲线还可以得出,包合物的比例较高时,其曲线趋近于零级释放曲线,释放速率趋近于恒速,而精油比例增加时,其释放曲线趋近于一级释放,其释放速率呈现逐渐减小的趋势。随着精油比例增加综合评分L值依次为83.21、70.91、57.7、41.33、28.49,随着入乳膏中精油的比例增加,其体外释放越接近于《中国药典》规定的缓释制剂,因此精油与β-CD包合物的比例为5∶1时,作为缓释制剂更为适合。
2.4.3 不同比例的精油与Hp-β-CD包合物加入乳膏基质对精油释放的影响 采用1.2.6项下的实验方法进行实验,将不同的乳膏进行体外释放,并进行释放曲线的拟合,计算曲线的累计释放综合评分,其结果见图8。
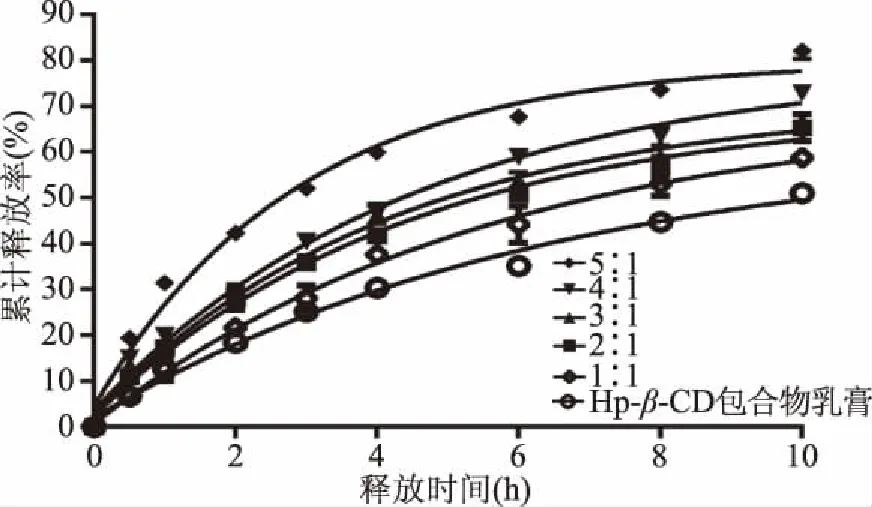
图8 不同比例的精油与Hp-β-CD包合物 对精油释放的影响Fig.8 Effects of different proportions of essential oils and Hp-β-CD inclusion complex on essential oil release
根据图8所示的释放曲线可知,随着乳膏中的纯薰衣草精油的比例不断的增加,释放过程的前4 h的释放速率再明显增大,而且其10 h的累计释放量也在不断的增加,随精油比例增加,乳膏的释放越接近于缓释制剂释放的规律,如果精油的比例继续增大,综合评分L值依次为44.52、28.44、28.98、26.08、21.21,因此精油与Hp-β-CD包合物的比例不能再增大,选择精油与Hp-β-CD的比例为5∶1,进一步研究。
2.4.4 不同比例的精油与两种包合物加入乳膏基质对精油释放的影响 采用1.2.6项下的实验方法进行乳膏制备,将不同的乳膏进行体外释放,并进行释放曲线的拟合,计算曲线的累计释放综合评分,其结果见图9。
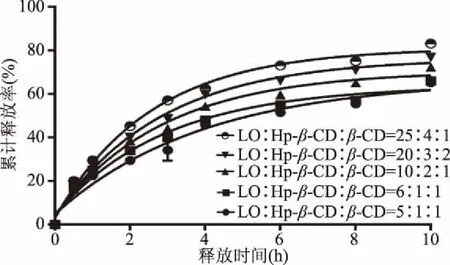
图9 不同比例的精油与两种包合物对精油释放的影响Fig.9 Effects of different proportions of essential oils and two inclusion complexes on essential oil release
如图9所示,在不改变Hp-β-CD包合物与β-CD包合物的比例时,只增加精油的量,前期释放速率增加,而后期释放速率变化不大,总的累计释放率几乎无变化;在增加精油比例的同时,增加Hp-β-CD包合物的比例时,其前期释放速率和中期释放速率均有所增加;增加β-CD包合物的比例时,后期释放速率未见显著增加,因此在整个系统中β-CD包合物的比例不宜太高,不然会影响总累计释放率。当比例为10∶2∶1时,综合评分为20.53,其释放规律最符合《中国药典》规定的缓释制剂的释放过程,因此,选择薰衣草精油:Hp-β-CD包合物:β-CD包合物比例为10∶2∶1加入O/W乳膏基质作为精油的缓释系统,即当三者之间薰衣草精油百分比为75%、15%和10%时,该缓释乳膏系统对精油释放效果最好。
2.5 薰衣草精油缓释乳膏药效学评价
2.5.1 失眠模型的建立 根据1.2.7项下的方法建立失眠模型,采用戊巴比妥钠翻正实验根据对照组和造模组睡眠潜伏期和睡眠持续时间的变化,确定小鼠失眠模型是否复制成功,各组睡眠时间见表2。

表2 对照组和模型组造模结束后翻正实验结果Table 2 Results of the correction test after the end of modeling in the control group and the model group
注:与对照组相比,*表示差异显著,P<0.05;**表示差异极显著,P<0.01。
根据表2可知,对照组和造模组之间通过腹腔注射戊巴比妥钠引起的睡眠潜伏期和睡眠持续时间之间均存在极显著性差异(P<0.01),实验结果说明,失眠模型复制成功。
2.5.2 小鼠体重变化 在小鼠造模前和香薰实验结束后分别称量每组小鼠的体重,并进行记录,通过体重差异计算各组小鼠体重增加量,其结果见表3。

表3 各组小鼠体重增加量Table 3 Weight gain of each group of mice
注:与对照组相比,*代表差异显著,P<0.05,**代表差异极显著,P<0.01;与模型组相比,#代表差异显著,P<0.05,##代表差异极显著,P<0.01;表4~表6同。
通过SPSS数据分析软件对实验结果进行分析,采用方差分析,4个组整体比较有显著性差异,对各组单因素方差分析,模型组与对照组比,体重增加量极显著减少(P<0.01),薰衣草精油组和乳膏组与模型组相比,体重增加量明显,存在显著性差异(P<0.05)。
2.5.3 薰衣草精油缓释乳膏对小鼠睡眠时间的影响 通过1.2.7项下的给药方法,连续香薰5 d 后,在最后一次给药结束60 min后,通过腹腔注射戊巴比妥钠溶液,分别记录各组小鼠睡眠潜伏期和睡眠持续时间,其结果见表4所示。

表4 各组小鼠香薰实验结束后戊巴比妥钠睡眠时间结果Table 4 Results of the correction of pentobarbital sodium after the end of the aromatherapy experiment in each group of mice

表6 不同处理组小鼠下丘脑中5-HT、DA、NE的表达值Table 6 Expression of 5-HT,DA and NE in the hypothalamus of mice in different treatment groups
通过对不同处理方法处理的小鼠睡眠潜伏期和睡眠时间进行比较,从睡眠潜伏期分析,模型组与对照组相比,模型组小鼠睡眠潜伏期较长,存在极显著性差异(P<0.01);薰衣草精油组和乳膏组与模型组相比,薰小鼠睡眠潜伏期明显缩短,存在极显著性差异(P<0.01)。从睡眠持续时间进行分析,模型组与对照组相比,睡眠持续时间均缩短,存在极显著性差异(P<0.01);薰衣草精油组和乳膏组与模型组相比,睡眠持续时间增加,存在显著性差异(P<0.05)。
2.5.4 薰衣草精油缓释软膏对小鼠自主活动性的影响 将各组以不同的处理方法处理后的小鼠,分别放入自主活动测定箱中适应2 min后,打开检测设备,记录小鼠5 min内活动次数,进行显著性比较,其结果见表5。

表5 薰衣草精油缓释乳膏对小鼠自主活动的影响Table 5 Effect of lavender essential oil sustained-release cream on spontaneous activity of mice
采用方差分析,方差齐整体比较具有显著性差异(F=124.9,P<0.01),对各组进行单因素方差分析,模型组与对照组相比小鼠自主活动性显著增加,存在极显著性差异(P<0.01),薰衣草精油组和缓释乳膏组与模型组相比,出自主活动性明显减低,存在极显著性差异(P<0.01)。
2.5.5 小鼠下丘脑中5-HT、NE、以及DA含量变化 采用ELISA试剂盒进行三种神经递质测定,测定方法按照ELISA试剂盒说明书进行测定,对各组小鼠脑组织中的5-HT、DA和NE的含量进行比较,结果见表6。
根据各组小鼠脑内5-HT进行单因素方差分析,检测统计量F值为17.53(P<0.01),说明各组小鼠脑内5-HT含量总体均值存在差异。模型组与对照组相比较,小鼠脑内的5-HT含量显著减小,存在极显著性差异(P<0.01);薰衣草精油组和乳膏组与模型组相比,薰衣草精油组与缓释乳膏组小鼠脑内5-HT含量均显著增加,存在极显著差异(P<0.01),说明PCPA能够减少小鼠脑内5-HT的含量。
根据各组小鼠脑内DA进行单因素方差分析,检测统计量F值为9.69,P<0.01,说明各组小鼠脑内DA含量总体均值存在差异。模型组与对照组相比,小鼠脑内的DA含量显著增加,存在极显著性差异(P<0.01);薰衣草精油组和缓释乳膏组与模型组相比,小鼠脑内DA含量均显著减少,存在极显著差异(P<0.01),说明PCPA能够增加的小鼠脑内的DA含量。
根据各组小鼠脑内NE进行单因素方差分析,检测统计量F值为15.60(P<0.01),说明各组小鼠脑内NE含量总体均值存在差异。对各组小鼠脑中NE进行多重比较结果,模型组与对照组相比,小鼠脑内的NE含量显著增加,存在极显著性差异(P<0.01);薰衣草精油组和乳膏组与模型组相比,小鼠脑内NE含量显著或极显著减少(P<0.05或P<0.01),说明PCPA能够增加的小鼠脑内的NE含量。
3 结论
薰衣草精油是一种易挥发的物质,本实验对薰衣草精油的外用剂型-缓释乳膏进行了研究,制备了以薰衣草精油β-包合物、Hp-β-CD包合物以及精油作为主药加入形式,当精油、Hp-β-CD包合物精油、β-CD包合物精油比例分别为75%、15%、10%时,缓释乳膏系统对精油的缓释作用较好,释放规律呈现先速释后恒速释放。通过对小鼠进行药效学评价,该缓释乳膏能够增加小鼠脑内5-HT,减少脑内DA和NE的水平发挥镇静催眠作用,对于PCPA引起的小鼠失眠具有显著的改善作用[22-23]。

