前列腺癌组织中miRNA-34c、E2F3的表达变化及意义
王继贤,童占表,张栋邦,马有才
(青海红十字医院,西宁810000)
前列腺癌是男性常见恶性肿瘤,是导致肿瘤患者特异性死亡的第二大病因[1]。近年来随着我国生活水平的提高,人们饮食和生活方式的转变,诊断技术不断发展,我国前列腺癌的发病率及病死率逐渐增高[2]。目前前列腺癌的病因及发病机制尚不清楚,进一步从分子机制了解前列腺癌的发生发展,对于早期诊断、治疗及病情监测等具有重要价值。微小RNA(miRNA)是一类小型内源性非编码RNA调控因子,由18~25个核苷酸组成,具有影响细胞分化、调节细胞周期和调控细胞凋亡等生物学作用。多种mirna的异常表达能够调节下游靶基因表达,促进细胞增殖、侵袭和迁移,影响多种恶性肿瘤的发生发展[3]。miR-34家族包括miR-34a、miR-34b及miR-34c,家族成员miR-34a基因位于1p36,miR-34b和miR-34c位于11q23。研究发现在肺癌、结肠癌、神经母细胞瘤及前列腺癌等多种肿瘤组织中存在miR-34c表达下调[4]。细胞周期紊乱及调控异常导致细胞持续异常增殖是肿瘤发生、发展的机制之一,多种细胞因子如癌基因编码促生长或增殖的调节因子、抑癌基因编码的抑制生长或增殖的调节因子等均参与细胞周期的调控,其中转录因子家族参与细胞周期调控的重要环节。E2F转录因子3(E2F3)是E2F转录因子家族成员,参与细胞周期的调控,控制细胞增殖基因的表达。研究表明,通过RNA干扰技术诱导E2F3基因沉默能使膀胱癌5637细胞系G1期阻滞,促进细胞凋亡[5]。在前列腺癌组织中E2F3基因表达增加[6]。本研究应用RT-PCR法检测前列腺癌组织中miR-34c和E2F3的表达,分析其与前列腺癌临床病理特征的关系及二者之间的相关性,初步探讨miR-34c、E2F3在前列腺癌发病机制中的作用。
1 资料与方法
1.1 临床资料 选择2013年1月~2017年10月本院行外科手术切除的前列腺癌组织标本56例,患者年龄56~79(69.47±6.75)岁,行前列腺癌根治性切除术41例、行姑息性经尿道前列腺电切术15例,根据Gleason评分系统[7]分为Gleason评分≤6分21例、Gleason评分>6分35例,初始血清前列腺特异抗原(PSA)<10 ng/mL 14例、10~20 ng/mL 31例、>20 ng/mL 11例,TNM分期Ⅰ~Ⅱ期27例、Ⅲ~Ⅳ期29例,有转移灶8例、无转移灶48例。选择同期前列腺增生组织标本40例作对照,患者年龄58~81(72.57±7.92)岁,均行耻骨上前列腺摘除术。前列腺癌患者与前列腺增生患者年龄具有可比性,均为初次诊治,排除其他恶性肿瘤患者。研究经本院伦理委员会批准,患者均签署知情同意书。
1.2 癌组织及前列腺增生组织中miR-34c、E2F3 mRNA表达检测 收集癌组织及前列腺增生组织,液氮速冻后,-80 ℃保存。TRIzol法提取总RNA。以总RNA 5μL为模板,用Taq Man MicroRNA ReverseTranscription试剂盒(ABI)进行逆转录,总反应体系为15μL,反应条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min。miR-34c特异性茎环引物,正向引物序列:5′-CGCGAGGCAGTGTAGTTAGCT-3′,反向引物序列:5′-AGTGCAGGGTCCGAGGTATT-3′;内参基因U6上游引物序列:5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物序列:3′-CGCTTCACGAATTTGCGTGTCAT-5′;E2F3上游引物序列:5′-ACGTCTCTTGGTCTGCTCAC-3′,下游引物序列:5′-TCTTAATGAGGTGGATGCCT-3′。miRNA-34c及E2F3反转录引物、PCR引物和探针分别来自ABI生物公司TaqMan MiRNA RT Kit和TaqMan MiRNAAssay Kit。荧光定量PCR反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。均在ABI荧光定量PCR仪上完成反应,每个样本重复3次。用2-ΔΔCt法计算目的基因相对表达量。

2 结果
2.1 前列腺癌组织及前列腺增生组织中miR-34c、E2F3 mRNA表达比较 前列腺癌组织、前列腺增生组织中miR-34c相对表达量分别为0.501±0.115、1.132±0.426,E2F3 mRNA相对表达量分别为1.224±0.875、0.217±0.140。前列腺癌组织中miR-34c的相对表达量低于前列腺增生组织(t=2.495,P=0.011),E2F3相对表达量高于前列腺增生组织(t=-3.780,P=0.000)。
2.2 miR-34c、E2F3 mRNA表达与前列腺癌患者临床病理特征的关系 癌组织中miR-34c、E2F3表达与Gleason评分、TNM分期有关(P均<0.05),而与年龄、初始PSA水平及有无转移灶无关(P均>0.05)。见表1。
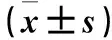
表1 miR-34c、E2F3 mRNA表达与前列腺癌患者临床病理特征的关系
2.3 前列腺癌组织中miR-34c与E2F3 mRNA表达的相关性 癌组织中miR-34c与E2F3 mRNA表达呈负相关(r=-0.694,P=0.000)。
3 讨论
近年来研究发现,miRNA参与调节多条细胞信号转导通路,如雄激素受体信号转导、notch信号转导等,从而与前列腺癌细胞增殖、凋亡、转移等恶性生物学行为密切相关[8]。miRNA可以通过与靶基因3′UTR区域的特定靶点联结使靶基因mRNA的生物稳定性下降,诱导mRNA降解或直接抑制靶基因mRNA的翻译,导致细胞信号传导通路异常,参与多种疾病的发生发展。有研究发现在非小细胞肺癌、结肠直肠癌、肝细胞癌和鼻咽癌等19种肿瘤组织中均存在miR-34家族异常表达。但对前列腺癌的研究中,癌组织中miR-34c表达变化尚不一致[9]。本研究癌组织中miR-34c的相对表达量低于前列腺增生组织,表明前列腺癌miR-34c表达下调。其机制可能为存在miR-34c基因位点11q23杂合性缺失,也可能与基因表观遗传学修饰后功能失活有关[10]。此外,本研究中Gleason评分>7分的癌组织中miR-34c相对表达量低于评分≤6分的癌组织,TNM分期Ⅲ~Ⅳ期的癌组织miR-34c相对表达量低于Ⅰ~Ⅱ期。表明miR-34c表达与肿瘤的发生发展有关。
前列腺癌的发生发展与细胞周期失控及相关调控因子的表达异常有关,而E2F家族参与细胞周期调控,E2F3是E2F家族的成员,基因位于6p22.3,E2F3通过调节多个基因表达影响细胞G1期向S期转变,进而影响细胞增殖[11]。本研究结果表明,前列腺癌组织中E2F3 mRNA的相对表达量高于前列腺增生组织,其机制可能与p53依赖的miRNA介导的基因沉默有关,即DNA损伤引起p53基因活化,转录因子p53诱导miR-34b和miR-34c表达增加,miRNA结合下游基因的mRNA的3′UTR区,抑制下游基因的翻译,如miR-34c能结合并抑制E2F3、Bcl-2、Cyclin D1及Met等基因的翻译。体外实验研究表明,利用RNA干扰技术抑制E2F3基因的表达后,前列腺癌Du145细胞的侵袭和迁移能力明显降低[12]。此外,E2F3的表达在TNM分期Ⅲ~Ⅳ期癌组织中高于Ⅰ~Ⅱ期,Gleason评分>7分癌组织中E2F3的表达高于评分≤6分,表明E2F3可能与前列腺癌的发生发展及与肿瘤恶性程度有关。其机制可能为p53基因的突变多发生于进展期前列腺癌,磷酸化的p53与E2F3亲和力下降,E2F3活性增加,引起下游基因表达增加,进而使癌细胞增殖、浸润能力增强。Foster等[13]研究表明前列腺癌组织E2F3高表达是患者不良预后的独立预测因素。
研究表明miR-34c过表达时E2F3蛋白表达低,进而影响肿瘤细胞增殖、侵袭转移及凋亡[14]。本研究中,对前列腺癌组织中miR-34c与E2F3 mRNA的表达进行相关性分析,结果表明二者呈负相关。提示二者可相互作用,共同促进前列腺癌的发生发展。miR-34c的高表达抑制了E2F3蛋白表达,而低水平的E2F3通过作用于一系列的细胞周期阻滞相关的蛋白,导致细胞G1期阻滞。
综上所述,前列腺癌组织中miR-34c及E2F3 mRNA的表达与正常前列腺增生组织相比明显异常,提示miR-34c及E2F3共同参与前列腺癌的发生发展,有希望成为前列腺癌分子诊断、药物治疗及预后评估的新靶点。但对于miR-34c及E2F3的具体作用机制及二者相互作用机制有待进一步研究。

