生物基质中芬太尼类物质分析方法研究进展
秦 楠,向 平,施 妍
(1.司法鉴定科学研究院 上海法医学重点实验室 上海市司法鉴定专业技术服务平台,上海 200063;2.广东药科大学药学院,广东 广州 510006)
芬太尼(fentanyl)是一种合成阿片类药物,于1960 年由比利时科学家Paul Janseen 首次合成,作为镇痛药出售,其镇痛效果为吗啡的80 倍。 芬太尼在1972 年被美国食品药品监督管理局(Food and Drug Administration,FDA)批准为静脉麻醉剂[1]。 由于其强大的镇痛效果,芬太尼类物质被广泛使用,芬太尼非药用以及芬太尼滥用的现象也随之出现。芬太尼滥用首次报道是在20 世纪80 年代并持续到21 世纪初[2-9]。 在2010 年,将芬太尼类物质掺杂在海洛因或可卡因中的现象严重[10-13],这对各国社会公共卫生安全造成了严重威胁。 据估计,2012 年至2014 年间美国约7 100 例与海洛因相关的死亡中,有41%涉及芬太尼[14]。 2015 年,美国疾病控制中心(CDC)报告了33 091 例阿片类死亡,其中近10 000例是由于美沙酮以外的合成类阿片(包括芬太尼及相关药物)造成的,比2014 年增加了72%[15]。 而在我国芬太尼的生产和走私也呈上升趋势,2016 年发现的芬太尼类物质有66 份,但在2012 年至2015年期间总计仅发现芬太尼类物质6 份[16]。
芬太尼类物质药效较强,摄入极少量即可对人体造成伤害乃至危及生命。 由于个体耐受和给药途径不同,给药剂量差异也较大。 静脉给药、吸入给药和鼻腔给药吸收较快,而口服或肌内给药的吸收则较慢。 如卡芬太尼的剂量约为几微克,芬太尼的剂量约为1 mg,而较低效的阿片类药物的剂量则为10 mg 左右。
由于芬太尼类物质滥用情况严重且药效强,致死率高,因此对该类药物的检测越来越受到分析工作者的重视。 本文就芬太尼类物质代谢、前处理方法和分析方法等进行综述。
1 芬太尼类物质的结构
芬太尼分子由三个主要部分组成:苯基烷基部分,哌啶基环和丙基烷基酰胺部分。 许多芬太尼类似物是通过对芬太尼的丙基烷基酰胺部分进行修饰,改变哌啶基上的链长或由苯基烷基部分上的芳族取代基取代而产生的。芬太尼pKa 为8.4,其他芬太尼类似物的pKa 如下:阿芬太尼6.5,瑞芬太尼7.1和舒芬太尼8.0。 芬太尼及其类似物的理化性质对于指导其样品处理有着重要意义。
2 芬太尼类物质的代谢
芬太尼类物质在肝脏内进行代谢。 芬太尼主要经由P450 3A4 代谢为无活性的去甲芬太尼, 其代谢途径是哌啶环上N-脱烷基化[17],而少量芬太尼被代谢为无活性的羟基芬太尼和羟基去甲芬太尼[18],后两者进一步转化为结合物[19]。 由于芬太尼及其类似物结构相似,所以大多数类似物的代谢途径与芬太尼相似。 MAYER 等[20]验证了3-甲基芬太尼在大鼠及重组人类同工酶中经N-脱烷基化代谢为3-甲基去甲基芬太尼,随后其烷基、芳基以及丙酰胺侧链均经羟基化代谢为羟基化产物。 此外MELENT等[21]证明了乙酰芬太尼在人体内主要经羟基化(苯基部分)代谢为羟乙酰芬太尼,少量经N-脱烷基化称为去甲基乙酰芬太尼。
但是值得注意的一点是,由于其相似的结构以及代谢途径,使得许多芬太尼类物质可能有共同的代谢产物。 如芬太尼、α-甲基芬太尼和β 羟基硫代芬太尼有共同的代谢产物去甲芬太尼[22-23],这就使得我们对鉴定结果的解释更为复杂。
3 死亡案例
已有许多文献报道了与芬太尼类物质滥用有关的案例,与大多数药物引起的死亡一样,在芬太尼类物质致死的案例中也常有与其他药物混用的现象。 表1 总结了由芬太尼类物质引起的中毒死亡案例数据。
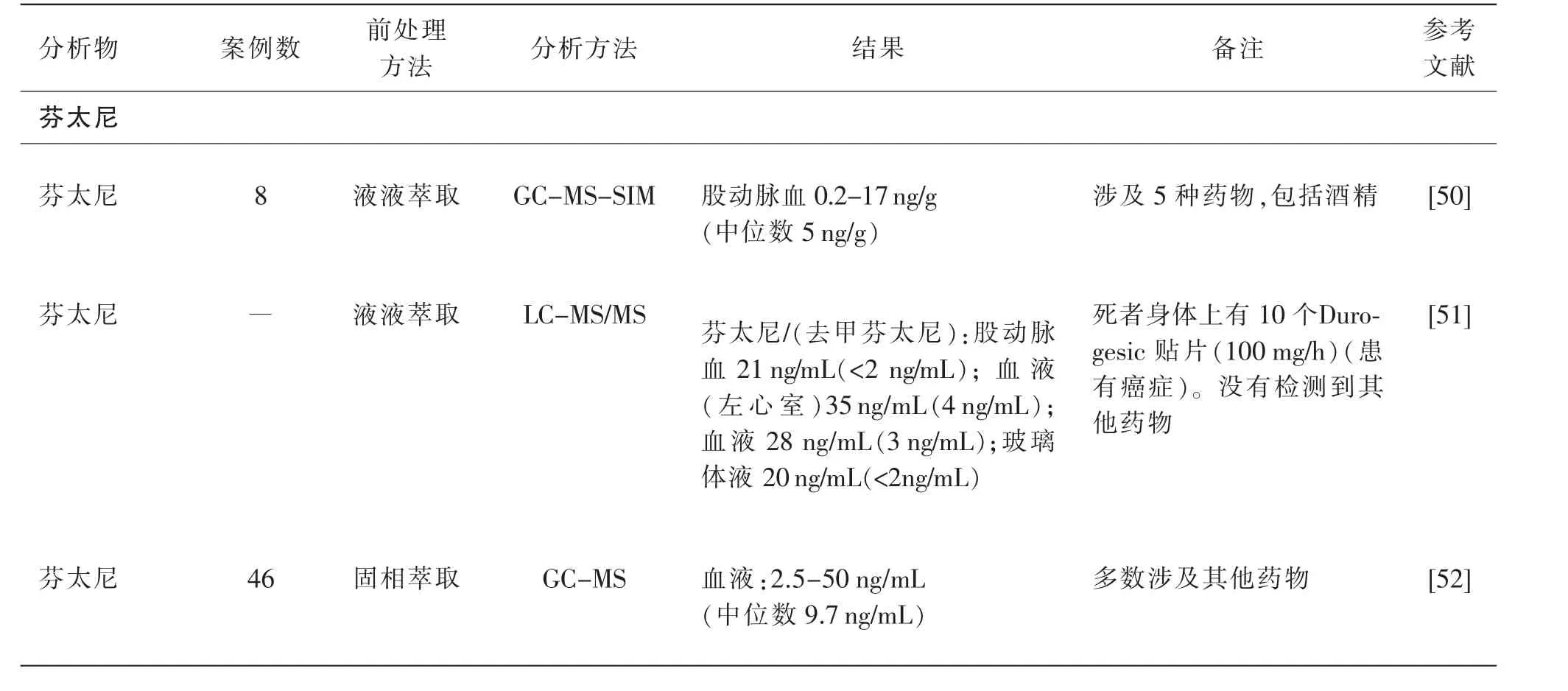
表1 芬太尼及其类似物中毒死亡案例

续表1
4 样品处理
检材是案件的重要证据,法医毒物实验室常见的生物检材有血液、尿液、毛发、汗液和尸体检材等。 生物检材的处理关系到分析的准确性和结果的科学性,对于结果的判断至关重要。
4.1 血液
血液是芬太尼类物质定量分析的最常用的生物检材。 许多因素会影响血液中芬太尼类物质的浓度,包括耐受性、死后再分布以及受体激活等。 在血液中,未结合的芬太尼为34%(范围17%~45%)[24],单次静脉内给药后,母体药物的峰浓度分别为去甲芬太尼37 倍和去丙酰基芬太尼256 倍[25];然而,如果长期使用,去甲芬太尼可能会累积,母体与代谢物的比值可能接近1.5[26]。
4.1.1 液液萃取
由于芬太尼多为脂溶性药物,而大多数内源性杂质是强极性的水溶性物质,因此用有机溶剂提取一次即可除去大部分杂质,是目前最常用的样品处理方法之一。
MCINTYRE 等[27]用液液萃取的方法提取血液中的丁酰基芬太尼。 取1 mL 样品与2 mL 去离子水混匀,加入1 mL 浓氢氧化铵使样品呈碱性,涡旋混匀,加入1-氯丁烷1 mL,混匀,以2 400×g 离心5 min,加入硫酸钠200 mg 以抑制乳化现象,离心,移取有机层至另一玻璃管内,加入1 mol/L 盐酸2 mL,混匀10 min,弃去有机层,水层用1mL 浓氢氧化钠碱化,然后移取有机层。 COOREMAN 等[28]用液液萃取的方法对血液及尿液中的芬太尼、去甲芬太尼、舒芬太尼、瑞芬太尼和阿芬太尼进行提取。取血浆或尿液500μL,加入内标50 μL,碳酸钾溶液(pH=12.3)500 μL,涡旋混匀,加入7mL 正己烷和乙酸乙酯(7∶3,V/V),混匀,以1 619×g 离心5 min,取上层有机相40 ℃氮气流下吹干,残渣用300 μL 流动相复溶,取25 μL 进样。
4.1.2 蛋白沉淀法
蛋白沉淀是基于蛋白质变性的原理进行样品前处理。 该方法操作简便,但是不能完全去除基质中的盐和磷脂类杂质,这些杂质的存在会产生离子增强或离子抑制作用,干扰测定方法的稳定性。
CAROLINA 等[29]采用沉淀蛋白法对全血进行处理。 取全血0.1g 置96 孔板中,加乙腈700μL,涡旋离心,取上清液于35 ℃下氮气流吹干,残渣用100 μL流动相水∶甲醇∶甲酸(74 ∶25 ∶1,V/V/V)复溶,涡旋,离心,上清液置于96 孔板进样。 CAROLINA 等用该方法筛选了全血中50 种4-苯胺基哌啶芬太尼类似物。
4.1.3 固相萃取
固相萃取是用应用液相色谱法原理处理样品,该方法与液液萃取相比,大大地缩短了样品制备时间,所需样品量少,避免了乳化现象,而且方便与自动化操作,是生物样品处理中具有发展优势的技术之一。
AMANDA 等[30]用固相萃取的方法提取了全血中新型合成阿片类物质U-47700、U-50488 和呋喃芬太尼,从而对其进行定量。取全血500 μL,加内标50 μL,磷酸盐缓冲溶液2 mL,混匀,离心5 min。 固相萃取柱依次用3 mL 甲醇,3 mL 去离子水和1 mL磷酸盐缓冲溶液预处理。 将离心好的上清液加入固相萃取柱, 依次用1.5 mL 去离子水,0.5 mL 0.1mol/L的醋酸和1.5 mL 的甲醇洗涤,然后干燥固相柱。 用2 mL 乙酸乙酯∶乙腈∶氢氧化铵(78 ∶20 ∶2,V/V/V)的洗脱液洗脱。 洗脱液在40 ℃干燥,然后用流动相复溶。 KRAIG 等[31]采用固相萃取技术检测了全血中纳克级以下的24 种芬太尼类物质及其代谢物。取全血1.0 mL,加入缓冲溶液4.0mL,水0.2 mL,内标100μL,涡旋,以1 811×g 离心10min,取上清液。 SPE柱用3.0 mL 甲醇活化, 用3.0 mL 水洗涤, 用pH=6的缓冲液预处理。 将上清液置于SPE 柱,用3.0 mL水,1.0 mL 1 moL/L 醋酸以及3.0 mL 甲醇去除内源性蛋白。 用3.0 mL 二氯甲烷∶异丙醇∶氢氧化铵(78 ∶20 ∶2,V/V/V)洗脱,洗脱液在40 ℃下用空气吹干,残渣用甲醇100 μL 溶解,进样。
4.2 尿液
体内药物清除主要是通过尿液排出,尿样一般用于药物剂量回收、尿清除率、生物利用度、内源性活性物质、药物代谢分型及代谢物等研究测定。 芬太尼主要经历肾脏清除,在尿中4 天内清除67%~85%[25,32,33],粪便中清除9%。 在尿液中,只有0.4%~6%的芬太尼作为母体药物排出,而69%作为代谢物排出[32]。 其中去甲芬太尼占26%~55%[19],还有较少量的羟基芬太尼,去甲羟基芬太尼和去丙酰基芬太尼[19,25]。
STEVEN 等[34]用LC-MS/MS 对人体尿液中的U-47700 进行定量分析,并用LC-QTOF 鉴定其代谢产物。 取尿液450 μL,加内标50 μL,β-葡萄糖醛酸酶25 μL,0.1 mol/L 醋酸钠425 μL,于60 ℃下孵育45 min。 然后用固相萃取柱进行提取,首先用0.5 mL 水,0.2 ml 100 mmol/L 的 盐 酸 溶液和0.1 mL 的水∶甲醇(75 ∶25,V/V)洗涤固相柱,接着在60 psi 下吹干,最后用250 μL 洗脱液:乙酸乙酯∶甲 醇∶氢氧化铵(78 ∶20 ∶2,V/V/V)洗脱。 洗脱液在氮气流下吹干,然后用50 μL 甲醇和250 μL流动相复溶。
4.3 唾液
以唾液作为作为样本,很大程度上提高了患者的依从性。 与采集血样相比,唾液的采集不受时间和地点的限制,很容易反复采集,且采集时无痛苦、无危险。 但由于唾液是由腮腺、颌下腺及舌下腺等各腺体分泌的组成不同的混合液体,各组成也会发生经时变动;因此,唾液中的药物浓度与血浆中的游离型药物浓度相比就容易变动; 而且唾液中药物浓度与血浆中药物浓度的比值(S/P)只有少数药物是恒定值;有些与蛋白结合率较高的药物,药物在唾液中的浓度比血浆药物浓度低得多, 需要高灵敏度的分析方法。 一项早期研究发现,单次给予静脉注射(110±56 μg)剂量后,唾液中只有去甲芬太尼未检测到芬太尼或去丙酰基芬太尼[33]。 最近的研究表明,芬太尼的S/P 值为3~4,芬太尼在两种基质中的浓度呈中度相关[26,35],去甲芬太尼的S/P 比值为1[26]。
SUDEEP 等[26]通过蛋白沉淀法提取血浆和唾液中的芬太尼和去甲芬太尼,并比较其含量及其相互关系。取样品200μL 与内标溶液600μL 于EP 管中,涡旋30s,以2 000×g 离心10 min。 取上清转移至12 mL的玻璃锥形管中,于40 ℃下氮气流吹干。残渣加0.1%甲酸水溶液200 μL复溶,涡旋30 s,以2 000×g离心10 min,取上清150 μL 进样。 结果表明,唾液中的芬太尼浓度超过血浆浓度,而且没有在血浆和唾液之间观察到相关性。
4.4 干血点
干血斑(dried bloid spots)与传统临床样品形式相比具有许多优点,包括提高分析物稳定性,样品体积小(<20 μL),降低处理样品的感染风险,以及降低运输和储存成本。 但是由于干血点取样量少,对仪器灵敏度要求较高。
CLAUDIA 等[36]通过LC-MS/MS 对干血点中芬太尼及其代谢物去甲基芬太尼和去甲硫酚基太尼进行分析。 取全血20 μL 制备干血点,裁剪干血点后,加纯水100 μL,涡旋5 s,加蛋白沉淀溶液(0.2mol/L ZnSO4)600 μL,涡旋2.5 min,在4 ℃下,以13 000×g离心8 min,取上清,进样。 结果表明,芬太尼、去甲芬太尼及去丙酰基芬太尼的LLOQ为0.1 ng/mL,说明该方法有足够的灵敏度分析干血点中的芬太尼及其代谢物。
4.5 毛发
由于血样、尿样以及唾液在采样及保存中易造成假阴性的结果,而且他们的检出时间较短,因此有时需要用毛发来进行鉴定。 毛发具有易采集、稳定、易保存及检测窗口长、可以反映长时间内用药史等优点,可作为血、尿等体液检材的补充,甚至成为提供法庭证据的唯一手段。 首创于1954 年的毛发分析,经过十几年的发展,从样品的采集、去污、水解、提取、分析到相关结果解释,已逐步系统化、规范化,分析结果可以作为法庭的参考依据。 但毛发中药物含量受到多种因素影响,含量较低,因此对分析方法的灵敏度要求较高。
MOORE 等[37]先采用免疫法筛选毛发样品中的芬太尼,再用GC-MS 进行确认。 免疫筛选部分是将毛发先用丙酮清洗,干燥,将其分段置于玻璃瓶中,加入0.025 mol/L的磷酸盐缓冲溶液0.5 mL,于75 ℃超声3 h, 取上清液0.1 mL, 加牛血清蛋白0.4 mL 稀释,选择酶联免疫吸附(ELISA)试剂盒进行筛选。接着对样品进行确认。取毛发10 mg,用丙酮清洗,弃去丙酮,加入0.025 mol/L 的磷酸盐缓冲溶液(pH=2.7)1.5 mL,于75 ℃超声3 h,移取上清液,加0.1mol/L 的磷酸盐缓冲溶液(pH=6.0)1mL。 固相萃取采用在线固相萃取,先将固相柱用乙酸乙酯2 mL,甲醇2 mL和0.1 mol/L 的磷酸盐缓冲溶液(pH=6.0)2 mL 预处理, 样品以1 mL/min 的流速上样,接着用去离子水2 mL,0.1 mol/L 的盐酸溶液1 mL 净化固相柱,干燥1 min,甲醇2 mL 和乙酸乙酯1 mL,干燥5 min。 最后用2 mL 乙酸乙酯∶氢氧化铵(98 ∶2,V/V)洗脱,将洗脱液挥干,残渣加乙酸乙酯40 μL复溶。
4.6 组织
在一些死亡案件中,尸体解剖后一些血液和尿液样品无法使用,需要将组织作为替代基质进行分析。
MIRIAM 等[38]通过LC-MS 在牙齿组织中检测到芬太尼。 其处理方法如下,取牙齿粉末适量,加内标10 μL,加甲醇0.5 mL,超声20 min,提取3 次,将上清液转移至玻璃管中,40 ℃下氮气流吹干,残渣加25 μL 流动相复溶。
5 分析方法
目前芬太尼、芬太尼类似物及其代谢物的分析方法多样,可采用免疫分析对生物样品进行初步筛选,以确定芬太尼类物质的存在,也可采用GCMS、LC-MS 和LC-HRMS 方法进行分析。
5.1 免疫分析
免疫分析提供了一种快速高效的筛选方法,可实现自动化和高通量。 免疫分析是利用抗原(靶标)和抗体的特异性结合来进行测定的一种方法。 不同的免疫分析法对芬太尼类似物的交叉反应具有局限性,且某些交叉反应是未知的。 免疫分析的检测限约为0.25 ng/mL 到2 ng/mL,并且由于交叉反应能够检测到一些其他芬太尼的存在[39-41]。
WANG 等[42]采用自动均相酶联免疫测定法检测到两种主要的芬太尼代谢物羟基芬太尼和丙酸芬太尼,未检测出去甲芬太尼,随后,WANG 等[40]又采用该方法检测出乙酰芬太尼。 值得注意的是,具有N-烷基化哌嗪相关结构的化合物也有可能发生类似的免疫反应,如利培酮和9-羟基利培酮(帕潘立酮)。
5.2 气相色谱-质谱(GC-MS)
在引入自动免疫测定法之前,临床和法医实验室主要依靠质谱法检测芬太尼类物质。 GC-MS 方法不能直接测定非挥发性,极性或热不稳定性的物质,需要对样品进行前处理,不适合在生物样品中进行常规快速检测。
SABINA 等[43]用GC-MS 对尿液中的芬太尼、舒芬太尼、阿芬太尼和去甲芬太尼进行筛查,其中阿芬太尼检测限为2 ng/mL,芬太尼和舒芬太尼为5 ng/mL,该方法检测限过高,无法检测到毒性大、浓度低的芬太尼类物质。
5.3 液相色谱-质谱(LC-MS)
目前LC-MS 作为最常用的检测手段,相比较于GC-MS 来说,它的灵敏度更高,更加稳定,而且适用范围更广。 用于同时检测芬太尼类物质的LCMS 方法在2009 年首次发表[44-45],而且随后该方法被不断优化。 表2 总结了自2000 年以来公布的检测3 种或更多芬太尼类物质的方法。
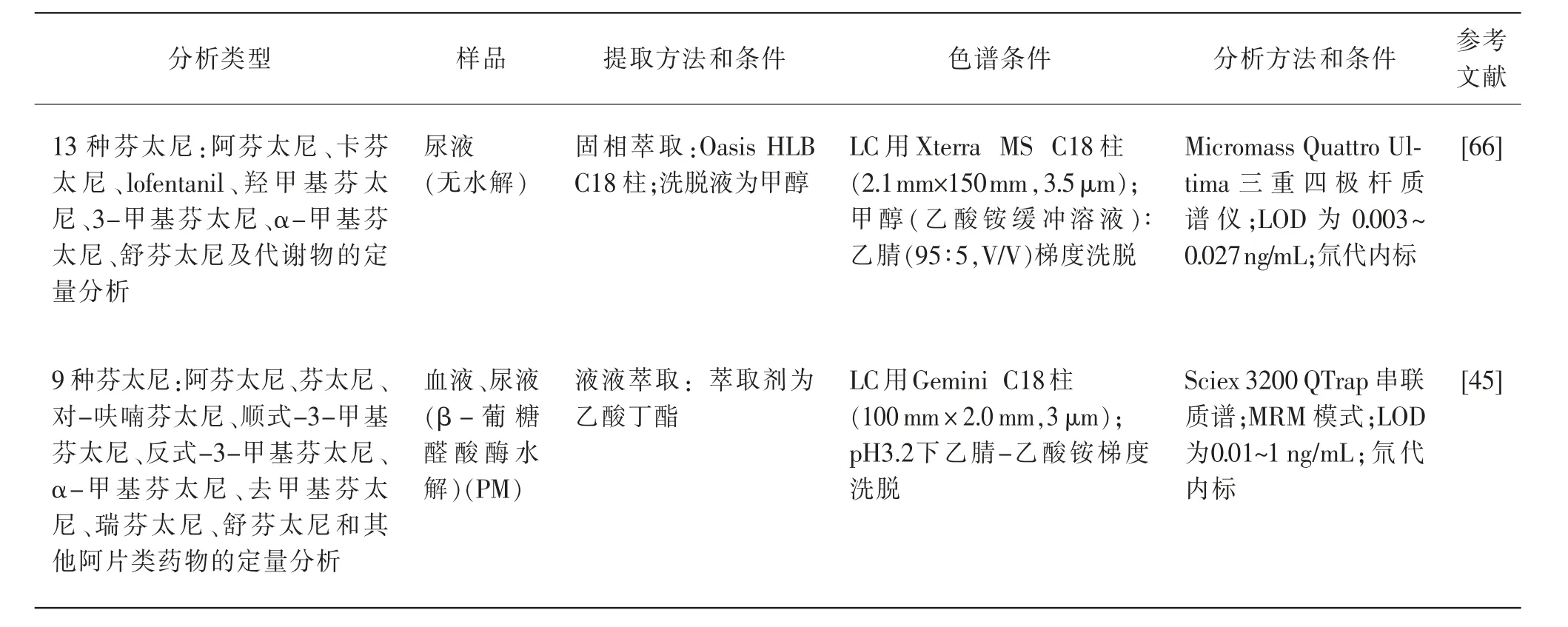
表2 同时检测多种芬太尼的分析方法
5.4 液相色谱-高分辨质谱(LC-HRMS)
使用GC-MS 和LC-MS 对芬太尼类化合物进行分析,往往需要预先建立质谱库,但鉴于目前新型芬太尼类化合物的不断出现,这些方法无法对其进行鉴别。LC-HRMS 在这方面具有巨大优势,而且它也可用于阐述其代谢途径。 但由于仪器设备昂贵,这种技术在大多数临床和实验室不易获得。ELISA 等[70]采用LC-HRMS 定性鉴别了44 种阿片类化合物,其中芬太尼类化合物的检出限均在0.5ng/mL以下。
6 讨论
自20 世纪90 年代初以来,出现了大量关于芬太尼及其类似物滥用的报道,并且报道有大量的死亡案例。 这可能与阿富汗危机期间海洛因的供应量急剧减少有关,此外,芬太尼及其类似物的非法合成很大程度上也导致了芬太尼类物质的滥用,以及芬太尼掺杂海洛因和芬太尼透皮贴剂的使用也使芬太尼滥用成为可能。
在大多数死亡案例中,芬太尼类物质会和其他类药物一起检出, 这些药物通常为其他阿片类药物、酒精、可卡因或苯二氮卓类药物等。 这些药物的存在会使芬太尼的致死量降低至约0.2 ng/mL,而外周血浓度通常为10~20 ng/mL[46-47]。 而且由于耐受性不同,对于芬太尼类物质,无法给出一个明确的最低致死量。
由于大部分芬太尼类物质为脂溶性,这使得对于芬太尼类物质死后再分布的解释成为难点。 有文献报道,解剖一天后血液中芬太尼的浓度已有增加[48],此外还有文献报道,芬太尼类物质在死后一小时就存在再分布[49]。
综上,芬太尼类物质滥用对公众健康和安全造成严重威胁,尤其是新型芬太尼类物质的出现使得分析检测变得更加困难。 而且目前对于芬太尼类物质的药代动力学研究还比较少,因此,建立可靠、稳定的分析检测方法,并将其应用于解决实际问题至关重要。

