酶法辅助提取小米多酚的工艺研究
魏春红 何丽娜 丁闻浩 鹿保鑫 曹龙奎
(黑龙江八一农垦大学食品学院1,大庆 163319)(国家杂粮工程技术研究中心2,大庆 163319)
小米(Setariaitalica),亦称作谷子,是一类小种可食用禾本科植物的总称,主要种植于干燥带边缘、温带、亚热带和热带地区,是全球第六大重要谷物[1]。小米是我国一种主要食用的杂粮,产于东北、华北地区。小米富含蛋白质、氨基酸、维生素及优质的不饱和脂肪酸,具有防止动脉硬化、减少心脑血管疾病、降血压和抗癌等重要作用[2],这些功能主要是由许多微量营养元素和小米中的植物化学物质,包括抗性淀粉、抗氧化剂如酚酸和类黄酮,以及激素活性化合物,如木脂素和植物甾醇[3],相比于其他的杂粮物质,小米中多酚的含量与种类更加的丰富[4]。
近年来,多酚类物质成为国内外食品界研究的重点之一,大量的实验与研究表明多酚类物质具有独特的生理功效与药用价值,市场前景广阔。其可以广泛应用于食品的抗氧化、防腐与澄清等方面;在农业生产中,可与多种微量元素螯合物处理苹果树和银杏树,使苹果增产19.8%~25.4%,银杏叶增产25.5%[5];而在医药领域,还可作为抗菌、抗病毒、抗癌的天然药物[6]。尽管多酚有诸多作用,但国内多酚的提取率相对较低[7],而且提取方法的差异对提取率的影响非常大。为了有效获取小米中的多酚,研究者们已通过多种途径提取。最常用的方法是溶剂提取法[8],此法处理时间长、提取效率低,虽然通过一些辅助的提取方法如微波[9]、超声波[10]等可以适当的提高多酚的得率[11-12],但始终无法避免大量有机试剂如乙醇的使用,造成了不可避免的环境污染和能源浪费。近几年,一些研究人员利用酶法来辅助多酚的提取,取得了理想的效果[13-15],如利用木瓜蛋白酶酶解核桃粕蛋白产物[16],利用α-淀粉酶水解制备银杏抗性淀粉[17]。与其他方法相比,酶处理方法具有快速、高效、温和、专一性强等诸多优点,并且在成本和使用上更加简便,对设备和工艺的要求也较少[18]。但目前,利用酶法提取小米多酚还鲜见报道。
本研究利用小米作为原料,采取单因素与响应面为研究手段,将酶法引入到小米中多酚的提取工艺中,以期提高小米中多酚的得率,为小米资源的进一步开发利用提供参考。
1 材料与方法
1.1 原料
武安小米:产于河北省邯郸市武安市,蛋白质质量分数约为9.2%~14.3%,粗脂肪质量分数3.0%~4.6%。
没食子酸:上海一研生物科技有限公司;福林酚:北京华迈科生物技术有限责任公司;木瓜蛋白酶(6 000 U/g):滕州市天水生物科技有限公司;α-淀粉酶(40 000 U/g):邢台万达生物工程有限公司;DPPH、TPTZ:美国Sigma公司。
1.2 主要仪器设备
WKF-20BZ高速万能粉碎机:北京格瑞德曼仪器设备有限公司; SP-752/752PC紫外可见分光光度计:上海光谱仪器有限公司; CTK120C离心机:湘仪离心机仪器有限公司。
1.3 方法
1.3.1 酶法辅助提取工艺流程及操作要点
小米→40 ℃烘箱处理5 h→粉碎筛分→称取定量样品按0.8%添加酶液→设定酶解条件→过滤→离心→上清液→定容→检测多酚含量。
将小米去杂、磨碎、过筛,准确称取一定量的小米粉,加入石油醚索式抽提得到小米脱脂产物,4 ℃下储藏备用。精密称取一定质量脱脂小米粉放入锥形瓶中,调整其pH至5.0,随后加入1%的木瓜蛋白酶与α-淀粉酶,二者比例为1∶1(m/m),分别调整不同的酶的添加量、酶解时间跟酶解温度,过滤,收集滤液,将滤液离心得到上清液,减压蒸馏得到浓缩液,取浓缩液1 mL定容至10 mL,测吸光度并计算多酚得率。
1.3.2 多酚含量测定方法
1.3.2.1 总酚标准曲线绘制
精确称取没食子酸标准品25 mg,去离子水溶解后定容于250 mL容量瓶中,得0.1 mg/mL的对照品标准溶液。精密吸取对照样品溶液0.1、0.2、0.3、0.4、0.5 mL于10 mL容量瓶中,再加入1 mL Folin-Cio-calteau试剂,摇匀后加入2 mL 15%Na2CO3溶液定容10 mL,常温下让其反应2 h,在760 nm处测定其吸光值。得回归方程为:y=12.861x+0.0829,R2=0.999 0。Y为吸光度值,X为没食子酸含量(mg)。
1.3.2.2 总多酚含量的测定
以Foiri-Ciocalteu法[19]测定总多酚含量,以没食子酸作为标准物。
用移液枪移取1mL待测样品,添加Foiri-Ciocalteu溶液,随后,添加2 mL 15%的Na2CO3溶液,将其充分摇匀后,常温放置2 h,随后在760 nm处测定其吸光值。
1.3.3 抗氧化性测定
1.3.3.1 DPPH自由基消除能力测定
取0.5 mL样品,加入2.5 mL含100 μmol/L DPPH的乙醇溶液,混匀,室温放置30 min后,5 000 r/min离心5 min,在517 nm处测定吸光值(A样),以5 000 r/min离心5 min过后的上清液调仪器零点;同时检测2.5 mL含 100 μmol/L DPPH 的乙醇溶液与0.5 mL蒸馏水的吸光值(A0)。对DPPH自由基的清除率=[(A0-A样)/A0]×100%。
1.3.3.2 FRAP法测定抗氧化能力
配制不同质量浓度的FeSO4溶液50 μL,各加入3.0 mL TPTZ工作液,37 ℃水浴30 min,测定595 nm处的吸光度。以蒸馏水为空白样调零。以吸光度为纵坐标,FeSO4质量浓度为横坐标绘制标准曲线。取1.0 mL样品,以蒸馏水定容到10 mL,准确吸取稀释液50 μL,加入3.0 mL TPTZ工作液,37 ℃水浴30 min,测定595 nm处的吸光度。抗氧化能力用FeSO4标准溶液的浓度来表示。
1.3.4 单因素实验
为获得小米中的多酚含量,分别对液料比10 ∶1、12∶1、14∶1、16∶1、18∶1(V/m)、双酶添加量为0.3%、0.6%、0.9%、1.2%、1.5%,酶解时间1、1.5、2、2.5、3 h,酶解温度20、30、40、50、60 ℃做单因素实验,以确定各因素的最佳水平。
1.3.5 响应面优化工艺参数
为了确定最优酶法辅助提取小米多酚工艺条件,以单因素实验为基础,利用响应曲面法对其进行优化处理,即以液料比、双酶添加量、酶解时间、酶解温度为自变量,多酚得率为响应值,设计四因素三水平优化实验。其实验因素水平如表1所示。

表1 Box-Behnken 实验因素水平表
1.4 数据处理
所有数据通过3次测定后取得平均值,用Origin9.1作图,SPSS V19.0分析其显著性,响应面分析采用Box-Behnken模型。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 液料比对小米多酚得率的影响
由图1可见,随着料液比的不断上升,小米中的多酚得率呈现出先快速上升,后缓慢下降的趋势。在液料比为14∶1时,其多酚的得率最高,为4.80 mg/g。这是因为伴随着液料比的不断增加,溶剂和小米之间的接触面增大,从而有利于小米多酚的溶出[20],但当液料比的比值过高时,由于酶与底物的接触会由于稀释过度而受限,酶的作用受到抑制,进而影响了多酚的提取率。不仅如此,过大的料液比在实际的生产过程中不仅增加了水的消耗,并且增加后续的浓缩成本,对后续加工造成困难因此,选择液料比为14∶1做为最适宜液料比。
2.1.2 双酶添加量对小米多酚得率的影响
从图1中可以发现,随着复合酶用量增加,多酚含量明显上升。这是因为淀粉酶在适宜的介质中可以水解小米中的淀粉,有助于与淀粉结合的部分多酚释放,这与吕俊丽等[21]研究莜麦中多酚的提取的结果相一致,但当双酶的添加量超过0.9%时,多酚的含量却呈现出下降的趋势。虽然适量木瓜蛋白酶可以通过破壁改变细胞壁的通透性,使得细胞壁破裂增加有效成分的溶出,提高多酚的提取率,但是多酚的分子可以与蛋白质和氨基酸发生很强的络合反应,而酶是具有催化活性的蛋白质,当酶过量时就会与多酚络合[22],而且当继续增加酶量,酶与底物的接触面积过剩,会降低反应速率,不仅总酚溶出会降低,而且会增加投入,进而减少了溶液中可提取的多酚的含量。
2.1.3 酶解时间对小米多酚得率的影响
从图1能发现,伴随着酶解时间的不断延长,小米多酚得率也不断的上升,在2 h时便达到最大值,随着酶解时间的继续延长,其多酚得率趋于稳定。这是由于随着酶解时间的不断变化,小米细胞壁与细胞间层的纤维素的隔层被有效破坏,多酚便可以更容易地从细胞内流出,但当达到适宜的时间后,其多酚类物质在细胞内外处于平衡的状态,更长的酶解时间对其作用影响不大,反而会由于更长时间的酶解使得小米中的多酚产生不必要的损失,甚至于发生氧化反应,导致酚类的含量有所降低[23]。因此,考虑到时间与生产成本等因素,选择酶解时间2 h为宜。
2.1.4 酶解温度对小米多酚得率的影响
图1中,在适宜的温度范围内,温度升高,小麦中多酚得率也有所增加,在40 ℃ 时其多酚的得率达到了最大值。这是因为:一方面木瓜蛋白酶与α-淀粉酶酶解活力随温度升高而增强,使反应速率加快;另一方面,在加热过程中,淀粉本身可发生膨胀并释放直链淀粉,随着加热的进行,淀粉颗粒破裂,使得多酚物质得以从笼形包含物中释放出来,因此,多酚得率随之增加[24]。有研究表明,酶解作用是促进小麦粉中多酚释放的主要原因[25]。当温度进一步提高过程中,多酚得率反而降低。这是因为温度持续升高,导致酶活力减弱,稳定性降低,且高温还可能会破坏已提取出来的多酚结构[10],故选取40 ℃为最佳酶解温度。

图1 液料比、复合酶用量、 酶解时间、 酶解温度对小米多酚得率的影响
2.2 响应面法对小米多酚提取工艺的优化
在单因素实验的基础上,选取液料比、双酶添加量、酶解时间、酶解温度为4个影响因素,将响应R值确定为多酚得率,其实验方案与设计见表2。

表2 实验方案及结果
通过统计分析软件Design-Expert进行数据分析,得到关于R的方程为:
R=4.81+0.045A+0.043B-0.022C-5.833E-003D+0.13AB+0.022AC+2.500E-003AD+0.040BC-0.14BD+5.000E-003CD-0.98A2-0.70B2-0.54C2-0.41D2


表3 方差分析
由回归系数的显著性检验可知,液料比与双酶添加量、双酶添加量与酶解温度的交互作用达到显著水平(P<0.05)。响应面越陡,各因素之间的两两交互作用越显著。液料比在 13∶1~15∶1、 双酶添加量0.8%~1%的范围内存在极值,即两者之间存在较好的交互作用。在液料比为13∶1~14∶1之间时,随着双酶添加量的增大,总多酚得率增加,在液料比为14∶1~15∶1之间时,随着双酶添加量的增大,总多酚得率减少。双酶添加量在0.8%~1.0%,酶解温度在39~41 ℃之间存在极值,在双酶添加量0.8%~0.9%之间,随着酶解温度的增加,总多酚得率增加,在双酶添加量0.9%~1.0%之间,随着酶解温度的增加,总多酚得率降低。
通过模型得到的结果为:液料比为14.05∶1、双酶添加量为0.91%、酶解时间为1.99 h、酶解温度为39.94 ℃,所能提取到的多酚得率为4.81 mg/g。结合实际生产中的工艺水平,调整到:液料比为14∶1、双酶添加量为0.9%、酶解时间为2 h、酶解温度为40 ℃。
为了验证更为可靠的数据,采用工艺条件进行3次实际提取,结果见表5,所得到的多酚得率平均值为4.83 mg/g,与理论预测值相差0.02 mg/g。所以,通过本方法优化的工艺条件准确可靠。
由表4对比实验结果可知,在不加酶条件下提取小米中多酚得率为3.95 mg/g,比加酶提取工艺低0.88 mg/g。由此可见,在小米多酚的提取工艺中,通过添加木瓜蛋白酶与α-淀粉酶可以调高小米多酚的含量。
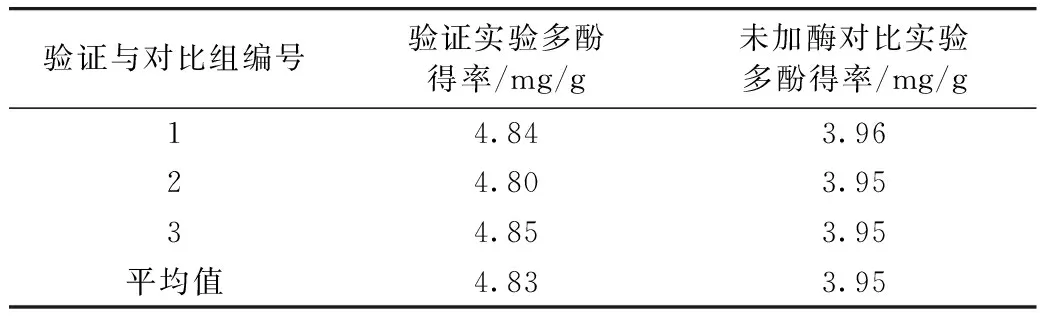
表4 验证和对比实验结果
2.3 抗氧化能力的对比
由表5可见,在木瓜蛋白酶与α-淀粉酶作用后,样品的自由基消除能力有所增加,从未处理样品的76.51%提高到83.42%,提升了9.03%,抗氧化能力也有所提高,未处理样品为2.96,处理后样品为3.67,提升力23.99%,因此,通过双酶法提取小米多酚不仅可以提升其多酚的含量,也可以提升小米的抗氧化能力。

表5 抗氧化能力的对比
3 结论
以单因素实验为基础,考察了液料比、双酶添加量、酶解时间、酶解温度对小米多酚得率的影响。由响应面分析实验得出,液料比、双酶添加量是影响小米多酚得率的主要因素,其中液料比的影响最为显著。通过回归分析确定小米多酚提取的最佳工艺液料比为14∶1、双酶添加量为0.9%、酶解时间为2 h、酶解温度为40 ℃。这种处理条件下,小米多酚得率可达4.83 mg/g,比未添加酶处理的样品高0.95 mg/g。不仅如此,还可以提升小米的抗氧化能力。由验证实验结果可以发现,利用响应曲面优化小米多酚的提取工艺条件在实践上具有可操作性。而酶法辅助提取小米多酚具有条件简便、耗时较短、反应条件温和、经济成本低与高效率的优势,其研究价值值得肯定。

