基于聚乳酸及其共聚物的生物可吸收支架研究进展
姜凯迪 王春仁 刘丽 韩倩倩 赵丹妹 薛彬 中国食品药品检定研究院 (北京 102600)
内容提要: 由于冠状动脉疾病的发病率越来越高,心血管支架的应用正不断增加。生物可吸收支架(BRS)代表了30年介入心脏病史中的一种新型范例。BRS有生物相容性好,植入人体后异物反应、血栓形成、新生内膜增生少,内皮化更完全等优点,这项技术克服了金属支架的局限性,并处于迅速发展阶段。文章就几种基于聚乳酸及其共聚物的新型生物可吸收支架的特点、临床试验、应用情况、未来发展方向作一简要综述。
由于人口老龄化和饮食习惯的改变,冠状动脉疾病的发病率正不断增加,缺血性心脏病已成为世界上最常见的致死性疾病之一。心血管疾病的治疗也在不断发展,其中,经皮冠状动脉介入治疗(Percutaneous Coronary Intervention,PCI)特别是心血管支架的植入在过去30年中已有了较大的发展[1]。1986年首例裸金属冠状动脉支架植入人体,但裸金属支架(Bare Metal Stent,BMS)易导致支架内再狭窄(In-Stent Restenosis,ISR),新生内膜增生和支架内血栓形成(Stent Thrombosis,ST)等不良事件,且患者必须接受BMS长期留存在体内[2,3]。
随着材料学的发展,一种全新的可吸收材料支架应运而生,即在一定时间内完成对血管的力学支撑后不留存在人体内,同时调节促进血管的再生,该类生物可吸收支架(Bioresorbable Scaffold,BRS)已成为极具前景的产品。有研究显示,使用BRS植入ISR或晚期ST发生率较低,且BRS最终降解为无害的分子,被认为是PCI技术的第四次革命[4]。现有的BRS主要包括多聚物可降解支架和金属合金可吸收支架,目前聚乳酸在多聚物可降解支架中应用最为广泛。聚乳酸(Polylacticacid,PLA)及其共聚物是一类可生物降解的高分子聚合材料,通过水解反应逐渐降解,最终产物为水和二氧化碳,具有良好的可吸收性与生物相容性。本文主要就基于聚乳酸及其共聚物的新型BRS的最新实验进展及相关临床研究加以综述。
1.生物可吸收聚合物支架的临床研究进展
1.1 DESolve支架
DESolve是采用Novolimus药物涂层的PLLA聚合物支架,约85%的药物4周内在体内释放完成[5]。DESolve系列中DESolve Nx厚度150μm,DESolve Cx厚度降低为120μm。支架可用直径范围2.5~3.5mm,长度14~28mm,尽管与Absorb相比降低了扩张期间支架断裂的风险,但仍不推荐使用超出标准规定的尺寸[6]。该支架具有自我校正特性,植入后可能会矫正支架与血管接触时的轻微贴壁不良[7]。支架在关键的3~4个月血管愈合期可保持必要的径向支撑强度,完全降解约需2~3年[8,9]。
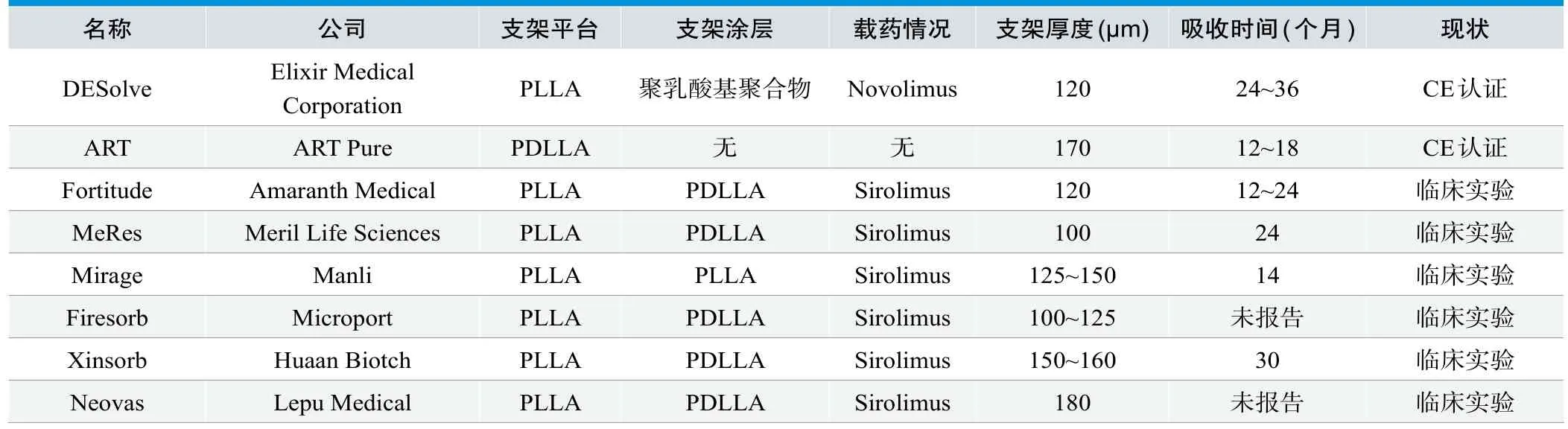
表1. 基于聚乳酸及其共聚物的生物可吸收支架研究概况
DESolve Nx临床试验纳入126例患者,在1、2、3、4年主要不良心血管事件发生率分别为5.7%、7.4%、8.2%、9.0%,支架ST形成率为0.8%。定量冠状动脉造影分析显示,6、18个月时晚期管腔丢失(Late Lumen Loss,LLL)为(0.20±0.32)mm、(0.29±0.34)mm,6个月时ISR率为3.5%。38例患者光学相干断层扫描技术(Optical Coherence Tomography,OCT)分析显示,6个月时支架覆盖率为98.79%,18个月后达到了99.98%。40例患者血管超声显示有5.13%±4.19%的堵塞率,6个月随访仅1例患者需再次血管重建,综上,该支架显示出了良好的安全性和有效性。
目前DESolve NTx支架100例患者的临床研究正在进行中,支架改进了血管嵌入性增强了球囊力的传递,旨在优化支架病变部位的扩张,血管造影时支架能见度也有所增强[10]。
1.2 Art支架
Art支架的主体材料是一种非晶体的高分子聚合物聚乳酸,无抗增生类药物涂层,5~7个月内能维持结构完整性,18个月内完全吸收。临床前研究报告无主要不良心血管事件,9个月的血管超声随访证实增加平均管腔面积和外弹力膜面积[11,12]。ARTDIVA临床研究中首次纳入30例患者,6个月报告了3例重复血运重建,无心脏死亡或心肌梗死。支架于2015年5月获得CE认证,目前尚无其他临床结果可供参考,制造商已宣布计划开发药物洗脱版本的支架。
1.3 Fortitude支架
Fortitude支架是由Sirolimus洗脱的BRS,支架由具有无定形结构的超高分子量树脂制成,可增加其断裂伸长率[13]。另外支架在X射线下完全可视。支架的径向支撑力可与金属支架相媲美,在治疗期间约8~10个月可提供足够的径向支撑,在1~2年完全吸收。
在猪模型的临床前研究中,4年后进行OCT评估,BRS的内腔和支架面积明显高于BMS对照组(13.19±1.50)mm2,(7.69±2.41)mm2,P<0.05;(15.62±1.95)mm2,(8.65±2.37)mm2,P<0.05),组内新生内膜增殖程度相当[14]。
RENASCENT-Ⅱ临床实验中患者植入了115μm的支架,9个月临床结果显示了高成功率(98.3%)和低主要不良心血管事件率(3.4%),无ISR或ST。RENASCENT-Ⅲ试验将讨论100μm以下支架的实验结果[15]。
1.4 MeRes支架
MeRes是Sirolimus洗脱的PLLA支架,表面涂覆PDLLA。其独特之处在于支架的几何形状能产生较高的径向强度,三轴不透射线标记便于操作,较细的支架(100μm)更利于侧支血管的进入。
支架在猪动物模型中显示出较低的ST和良好的力学稳定性。支架首次人体内实验MeRes-1在印度招募了108名患者,6个月LLL为(0.14±0.22)mm,未出现ISR,随访期间未发生TLF或ST。1年OCT显示所有支架清晰可见,只有轻微的血管狭窄。血管超声显示新生内膜增生面积(0.14±0.16)mm2,支架覆盖率99.3%。12个月时仅1例患者(0.93%)发生主要不良心脏事件,无ST形成[16]。目前MeRes100正计划开展包括大约2000名患者的随机临床试验。
1.5 Mirage支架
Mirage支架是Sirolimus洗脱的PLLA支架。支架厚度随支架直径变化(≤3mm,125μm;≥3.5mm,150μm),螺旋线圈式的设计使支架具有良好的灵活性,其吸收时间为14个月。
支架在猪模型的临床前研究显示出了较好前景。未观察到ISR,6个月的随访中,99%的支架被覆盖,平均NIH厚度为(0.08±0.03)mm,LLL为(0.21±0.20)mm,只有1例支架错位,未出现支架断裂或ISR[17]。
Mirage与Absorb的临床对照实验中,12个月随访显示LLL分别为0.37mm和0.23mm,无统计学差异(P=0.2)。在OCT中,Mirage术后直径狭窄程度为11.2%±7.1%,6个月时增加至27.4%±12.4%,1年时保持稳定(31.8%±12.9%)。作者称该研究还未达到最佳技术水平,考虑到新颖的机械性能,在未来支架研究中需要OCT指导植入,使支架得到最佳植入效果和合理评估[18]。
1.6 Firesorb支架
Firesorb PLLA支架由中国上海微创医疗研制,与Absorb相比支架较薄,药物剂量较低,以达到更快的支架覆盖和吸收。支架尺寸2.5~2.75mm,壁厚100μm;尺寸3.0~4.0mm,壁厚125μm。
临床试验由FUTURE-Ⅰ、FUTURE-Ⅱ和FUTURE-Ⅲ三部分组成。FUTURE-Ⅰ招募了45名患者,随访结果显示6个月后支架覆盖率为99%,定量冠状动脉造影显示LLL约为(0.15±0.11)mm,无ISR,出现1例心肌梗塞和1例血运重建,但1年内无死亡或ST[19]。患者术后两年主要终点事件发生率均为0%,面向患者的复合次要终点PoCE(包括死亡、心肌梗死及血运重建)发生率为2.2%,全因死亡、靶血管心肌梗塞及ST发生率均为0%。目前关键的随机对照试验FUTURE-Ⅱ已启动。
1.7 Xinsorb支架
Xinsorb是Sirolimus洗脱的PLLA支架,厚度150μm,截面直径3~3.5mm,支架两端有金属标记,由中国华安生物技术公司研发。
支架临床前实验在猪体内完成,植入后未出现ST并能有效防止血管弹性回缩造成的ST,支架内皮化完全所需时间为30~90d[20]。在XINSORB与金属Firebird2™支架的对照实验中,14、28、90、180d随访显示,XINSORB支架的LLL分别为(0.26±0.13)、(0.50±0.16)、(0.88±0.29)和(0.43±0.24)mm,相应直径狭窄(DS)分别为(7.3±4.7)%、(12.0±9.5)%、(22.1±8.0)%和(16.0±9.5)%,与Firebird2支架相比均无显著性差异。OCT显示两种支架间未检测到管腔面积、装置面积、内膜增生和面积狭窄的差异,均显示出低损伤与血管壁炎症。XINSORB支架28d内可实现早期新生内膜覆盖,180d随访中能像Firebird2一样有效抑制新生内膜增生[21]。
临床实验中对30例患者采用了大小分别为3.0mm×12mm、3.0mm×15mm和3.0mm×18mm的Xinsorb支架,手术成功率100%。6个月时27名患者接受血管造影随访结果显示无主要不良心血管事件和ST。支架内和节段内LLL分别为(0.176±0.12)mm和(0.136±0.24)mm。血管超声显示随访时管腔、支架和新内膜的平均面积分别为(6.27±0.69)、(6.48±0.70)和(0.20±0.09)mm2,而装置内狭窄为3.1%±1.3%。OCT显示所有支架在6个月内都清晰可辨,新生内膜覆盖为95.9%[22]。
1.8 NeoVas支架
NeoVas支架是我国乐普医疗生产的表面喷涂PDLLA,涂层药物为Sirolimus的PLLA支架。
NeoVas临床研究共纳入了31名患者,在1年的随访中,只有1例(3.2%)TLF,未观察到心脏死亡或ST形成。MSCT分析显示了优秀的血管通畅性,中位支架内腔面积为10.6mm2,最小内腔直径为2.7mm[23]。
NeoVas支架与EES支架的临床对照试验共纳入560例患者,患者随机分配接受NeoVas(n=278)与CoCr-EES(n=282)治疗。NeoVas与CoCr-EES 1年内LLL分别为(0.14±0.36)mm和(0.11±0.34)mm,无显著性差异(P=0.36)。1年时OCT显示支架覆盖率较高(98.7%,96.2%,P<0.001),并有较少的支架贴壁不良(0%,0.6%,P<0.001)和较小的最小管腔面积((4.71±1.64)mm2,(6.00±2.15)mm2,P<0.001),两者有显著性差异。以上1年期随访显示NeoVas支架达到非劣效性,但仍需长期随访进一步证实其安全性有效性[24]。
2.总结及展望
就现有的临床试验而言,一般都在一定程度上证实了多聚物可降解支架的有效性和安全性,但仍存在一定的局限性。去年9月雅培宣布第一代生物可吸收支架退市,血管修复治疗也遭遇了全球性低潮。有些多聚物可降解支架材料制作过程复杂、制作成本高、早期ST形成风险高,且径向支撑力和抗压能力均不如金属支架,支架吸收过程和机械支撑需求难以平衡。
针对这些缺点许多公司正研发新型支架加以克服,如开发更好的药物,研究高分子材料的降解过程,合成性能更优越的材料,开发更优异的支架结构使支架力学性能达到或超越金属支架等。针对支架的安全性和有效性问题,今后还需要更完善的临床前研究、更大规模的随机对照和更长期的随访观察进行充分评价。期待更多成果问世,使冠状动脉介入的第四次技术革命成果早日广泛应用于临床,造福患者。

