FOXC2对结肠癌细胞增殖、侵袭、迁移的影响及机制
张洋 张磊 吴慧丽 李琨琨
(郑州大学附属郑州中心医院消化内科,河南 郑州 450007)
结肠癌发病早期超过90%的患者可以通过手术治疗治愈,但由于结肠癌早期临床症状不明显,大多数患者在确诊时已经处于结肠癌的中晚期,耽误了最佳的治疗时机〔1〕。探讨结肠癌的发病机制,寻找有效的靶基因治疗结肠癌是目前研究的热点。叉头框(FOX)C2是一种转录因子,能够调控小鼠胚胎发育和淋巴发育,在食管癌、大肠癌等中表达上调,并且与癌症的预后、转移等有关〔2~4〕。研究显示,FOXC2在肿瘤细胞迁移、侵袭、上皮细胞间充质化(EMT)、血管生成等过程中均具有调控作用,是肿瘤发生和发展的重要调控基因〔5〕。本研究旨在探讨FOXC2对结肠癌细胞生长、迁移和侵袭能力的影响,明确FOXC2在结肠癌转移中的作用。
1 材料与方法
1.1材料 结肠癌细胞SW620购于中国科学院上海细胞生物研究所细胞库;shRNA对照、FOXC2 shRNA为圣克鲁斯生物技术产品;Lipofectamine 2000转染试剂为美国 Invitrogen公司产品;FOXC2、甘油醛-3-磷酸脱氢酶(GAPDH)引物由上海生工合成;FOXC2一抗、钙黏蛋白E(E-cadherin)一抗均为美国Abcam公司产品;基质金属蛋白酶(MMP)-2一抗、MMP-9一抗均为美国Santa Cruz公司产品;二喹啉甲酸(BCA)蛋白浓度检测试剂盒、RNA提取试剂盒、蛋白提取试剂盒均购于美国Thermo。
1.2细胞培养 结肠癌细胞SW620从液氮中取出放在37℃融化后,加入含有10%胎牛血清的RPMI1640细胞培养液混合后,种植到细胞瓶中,放在37℃,5% CO2培养箱中培养。观察细胞融合度达到90%时,加入0.25%的胰蛋白酶消化细胞,1 000 r/min离心10 min,弃酶消化液,加入细胞培养液重悬细胞,按照实验要求不同比例接种到细胞瓶中继续培养。
1.3细胞转染 取培养至对数生长期的SW620细胞,胰蛋白酶消化细胞后,1 000 r/min离心10 min,加入细胞培养液悬浮细胞,种植到6孔细胞培养板中培养。倒置显微镜下观察细胞融合度达到80%时,将FOXC2 shRNA和shRNA对照按照Lipofectamine 2000转染试剂说明书转染至SW620细胞中并依次命名为:FOXC2 shRNA组和shRNA-NC组,同时设置对照组,对照组细胞不予处理正常培养。培养48 h,Real time-PCR和Western印迹检测细胞中FOXC2水平。
1.4Real time-PCR检测E-cadherin水平 取1.3中对照组、shRNA-NC组、FOXC2 shRNA组细胞,加入胰蛋白酶消化后,提取细胞中的RNA,加入14 μl的焦碳酸二乙酯(DEPC)水溶解后,紫外分光光度计检测浓度和纯度。取2 μg的RNA逆转录合成cDNA。Real time-PCR,以GAPDH为内参,2-△△Ct法分析FOXC2水平。FOXC2上游引物为5′-TTCAGAAGGTGGCTCAATGC-3′,下游引物5′-GGAGTGTTGGAGAAGTCATATTAC-3′。GAPDH上游引物为5′-TGACTTCAACAGCGACACCCA-3′,下游引物5′-GGAGTGTTGGAGAAGTCATATAC-3′。实验重复3次,取均值。
1.5Western印迹检测FOXC2、MMP-2、MMP-9和E-cadherin蛋白水平 取1.3中对照组、shRNA-NC组、FOXC2 shRNA组细胞,提取细胞总蛋白,BCA蛋白浓度检测试剂盒检测蛋白浓度。按照每孔40 μg蛋白样品进行电泳,将蛋白与加样缓冲液在振荡器上混合后,放在100℃煮沸5 min,保存在4℃。用10%的分离胶和4%的浓缩胶进行电泳,在分离胶中的电压为120 V,在浓缩胶中的电压为80 V。半干法在4℃,0.8 mA/cm2把蛋白转移到聚偏氟乙烯(PVDF)膜上。取出PVDF膜,用5%的脱脂奶粉在室温封闭1 h后,放在1∶800稀释的一抗中4℃过夜反应,在1∶1 500稀释的二抗中室温反应1 h。显色,曝光,以GAPDH为内参,分析蛋白水平。实验重复3次,取均值。
1.6MTT检测细胞增殖 对照组、shRNA-NC组、FOXC2 shRNA组细胞接种到96孔细胞培养板,细胞浓度为3×105个/ml,37℃,5% CO2培养48 h。每孔中加入50 μl的浓度为5 mg/ml噻唑蓝(MTT)溶液,37℃静置反应4 h。以不加细胞的孔为空白调零组。将培养液上清吸除后,每孔加150 μl的二甲基亚砜溶液,震荡反应10 min,酶标仪检测各孔A值,每组设置4个复孔。实验重复3次,取均值。
1.7平板克隆检测细胞克隆形成能力 对照组、shRNA-NC组、FOXC2 shRNA组细胞用胰蛋白酶消化后,种植到6孔细胞培养板中,每孔中加入200个细胞,培养14 d以后,用肉眼观察细胞克隆数目。用磷酸盐缓冲液(PBS)洗涤后,甲醇固定,吉姆萨染色后,计数细胞克隆形成数目,实验重复3次,取均值。
1.8Transwell小室检测迁移和侵袭能力 对照组、shRNA-NC组、FOXC2 shRNA组细胞经胰蛋白酶消化后,用不含血清的细胞培养液把细胞浓度调整为1×105个/ml。在实验前3 h,取基质胶加入到Transwell小室中,放置于37℃环境中孵育湿化3 h,待基质胶凝固以后,在小室中加入不含有胎牛血清的细胞培养液继续孵育40 min。取适量的细胞悬浮液加入Transwell小室中,放在24孔板中。小室外侧加入细胞培养液。37℃孵育48 h后,用PBS洗涤Transwell小室,把没有穿膜的细胞用棉签擦掉,多聚甲醛固定,结晶紫染色,在显微镜下观察侵袭细胞数目。细胞迁移能力检测时Transwell小室不用基质胶包被,其他步骤同侵袭实验。
1.9数据分析 采用SPSS22.0软件进行独立样本t检验、单因素方差、LSD-t检验。
2 结 果
2.1各组FOXC2表达水平比较 shRNA-NC组细胞中FOXC2 mRNA和蛋白水平与对照组相比差异无统计学意义(P>0.05)。FOXC2 shRNA组细胞FOXC2 mRNA和蛋白水平显著低于对照组(P<0.05)。见图1,表1。

1:对照组;2:shRNA-NC组;3:FOXC2 shRNA组图1 Western印迹检测转染后细胞中FOXC2水平

组别mRNA蛋白对照组1.00±0.110.69±0.09shRNA-NC组1.01±0.080.68±0.06FOXC2 shRNA组0.47±0.091)0.14±0.031)
与对照组比较:1)P<0.05;表2同
2.2各组细胞增殖和克隆形成能力、迁移数目、侵袭数目及MMP-2、MMP-9及E-cadherin水平比较 shRNA-NC组细胞A值、克隆形成数目、迁移数目、侵袭数目及MMP-2、MMP-9和E-cadherin水平与对照相比差异无统计学意义(P>0.05)。FOXC2 shRNA组细胞A值和克隆形成数目、迁移数目、侵袭数目及MMP-2、MMP-9水平均显著低于对照组,E-cadherin水平显著高于对照组(P<0.05)。见图2、表2。
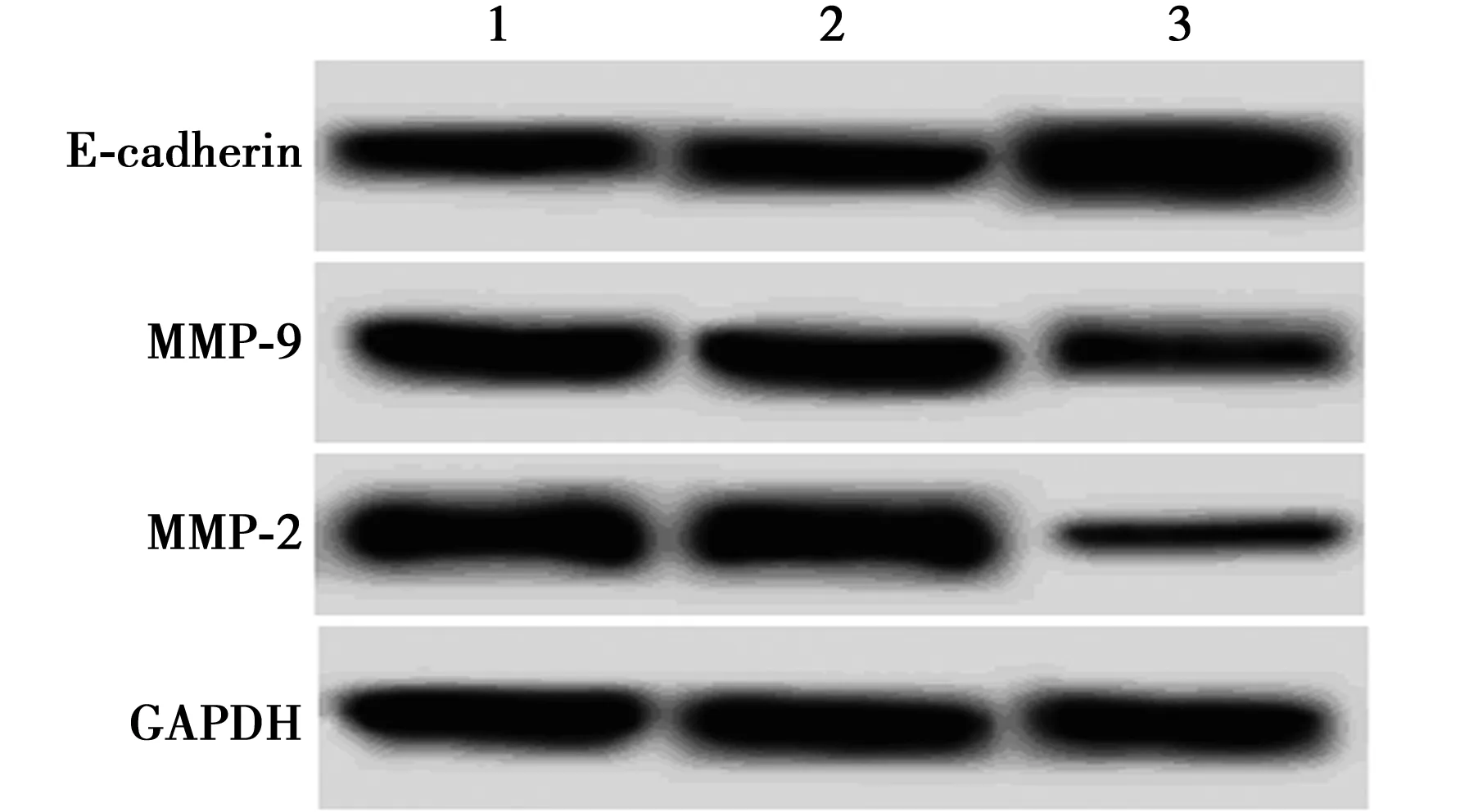
1:对照组;2:shRNA-NC组;3:FOXC2 shRNA组图2 Western印迹检测 MMP-2、MMP-9和E-cadherin水平

组别A值克隆形成数目(个)迁移数目(个)侵袭数目(个)MMP-2MMP-9E-cadherin对照组0.75±0.0727.33±2.64186.75±16.97162.84±15.681.17±0.101.06±0.110.84±0.08shRNA-NC组0.76±0.0425.91±3.12188.26±17.34166.47±12.741.15±0.131.03±0.120.87±0.04FOXC2 shRNA组0.52±0.061)14.80±1.751)125.08±11.821)114.56±13.621)0.41±0.061)0.58±0.061)1.36±0.161)
3 讨 论
FOXC2基因最初分离至小鼠脑组织中,因其含有FOX结构而命名〔6〕。人FOXC2基因定位在16q22~16q24,不含有内含子,只有一个单独的外显子,其编码的蛋白质由494个氨基酸组成,含有一个forkhead结构,对于肿瘤的转移具有促进作用〔7,8〕。FOXC2对肿瘤的作用机制与血管生成、血管生成因子、EMT等有关〔9〕。FOXC2在黑色素瘤中可以通过调控血管生成影响肿瘤的转移过程,皮下注射黑色素瘤细胞后,FOXC2杂合突变的小鼠肿瘤血管生成能力低于野生型的小鼠,并且杂合突变小鼠MMP-2和MMP-9的水平也下降〔10〕。研究显示,FOXC2能够通过调控其他相关基因的表达和转录间接降低肿瘤细胞中E-cadherin的表达〔11〕。
FOXC2在卵巢癌、胶质瘤、宫颈癌、食管鳞癌等肿瘤组织中表达上调,并且与肿瘤的分期和转移有关〔12~14〕。王静苗等〔15〕研究表明,在70例结肠癌患者中有52例FOXC2表达阳性,而在30例癌旁组织中只有6例FOXC2表达阳性,并且其表达水平与结肠癌的淋巴结转移、TNM分期及浸润深度等有关。权原〔16〕研究表明,下调FOXC2对于卵巢癌细胞的侵袭、迁移具有抑制作用,并且对卵巢癌细胞的裸鼠成瘤能力也具有抑制作用。本研究结果显示,下调FOXC2表达后的结肠癌细胞的生长和克隆形成能力下降,细胞的侵袭和迁移能力也下降,FOXC2下调后抑制结肠癌细胞生长、迁移和侵袭能力,这与上述实验报道相符合,FOXC2在肿瘤转移过程中可能发挥促进作用。
肿瘤的转移过程较为复杂,癌细胞侵袭是发生癌症转移的前提条件,而随着癌细胞侵袭的发生,癌细胞发生转移〔17〕。癌细胞从原来的病发灶扩散进入到邻近的正常组织器官中必须通过癌细胞的黏附作用才能实现,癌细胞到达血管内皮下基底膜,进入血液中,并且随着血液的扩散达到其他组织中,在靶器官内皮细胞上黏附以后,克隆生长,形成转移灶〔18〕。细胞的黏附作用有两种:细胞与细胞之间的黏附和细胞与基质之间的黏附,E-cadherin是细胞间黏附作用的关键因子,属于钙依赖的跨膜糖蛋白〔19〕。研究显示,E-cadherin在癌症组织中低表达,E-cadherin水平还与癌症的预后有关〔20〕。肿瘤细胞在侵袭和迁移发生时,需要通过MMPs降解相邻的细胞外基质才能完成〔21〕。MMP-2、MMP-9在肿瘤细胞中表达上调,与肿瘤转移呈正相关,是目前研究的与肿瘤转移关系最为密切的MMPs家族成员。本研究结果显示,FOXC2表达下调后的结肠癌细胞中MMP-2、MMP-9表达下降,而E-cadherin表达水平升高,说明FOXC2通过作用于MMP-2、MMP-9、E-cadherin影响结肠癌细胞的迁移和侵袭过程。
综上,FOXC2表达下调抑制结肠癌细胞生长、迁移和侵袭能力,下调MMP-2、MMP-9蛋白水平,促进E-cadherin蛋白表达,FOXC2表达下调抑制结肠癌的转移,对于其具体的作用机制仍然需要进一步探讨。

