CD133与HDAC1在老年晚期胃癌患者组织中的表达及临床意义
席红利 黄文瑾 尚彦彦
(广州医科大学附属肿瘤医院 1检验科,广东 广州 510095;2放疗四科)
外科手术切除并辅以放化疗是临床上常用的胃癌治疗方案〔1,2〕,然而,术后复发是导致患者生存率低的主要因素,晚期胃癌患者术后5年生存率低于30%〔3〕,其中老年患者由于全身多器官明显衰退,身体耐受力较差,其5年生存率通常低于平均值。肿瘤干细胞(CSCs)具有自我更新复制和多向分化等特性,是肿瘤复发的源头〔4〕。分化抗原簇蛋白(CD)133是造血干细胞的表面标志物,同时也是乳腺癌〔5〕等肿瘤干细胞的重要标志物。表观遗传修饰在CSCs分化为肿瘤细胞的过程中扮演重要角色,组蛋白去乙酰化酶(HDACs)是表观遗传修饰的关键酶,在众多基因转录调控中发挥作用〔6,7〕。研究证实,HDACs抑制剂能够诱导肿瘤细胞发生周期阻滞,促进肿瘤细胞分化和凋亡,具有抗肿瘤功能〔8〕。本研究探讨与CSCs密切相关的CD133和HDACs在术后复发的老年晚期胃癌患者的治疗和预后评估中的临床意义。
1 对象与方法
1.1研究对象 选取广州医科大学附属肿瘤医院2009年1月至2014年12月收集的老年晚期胃癌患者原发部位肿瘤组织标本75例,所有标本经苏木素-伊红(HE)染色后,经3名有经验的病理医师确诊。患者均存在术后复发,其中,男49例,女26例,年龄60~87〔平均(71.32±6.58)〕岁;肿瘤分期:T3~T4a期27例,T4b期48例;淋巴转移:N0~N2期31例,N3期44例;无肝脏转移(H0)23例,有肝脏转移(H1)52例;无腹膜转移(P0)19例,有腹膜转移(P1)56例;无远处转移(M0)11例,有远处转移(M1)64例;分化程度:分化21例,未分化54例。患者均有完整的临床资料,患者及其家属对本研究知情同意。本研究符合医院伦理委员会的相关规定,且已通过委员会的审核。
1.2试剂与方法 兔抗人CD133多克隆抗体(ab19898,美国Abcam公司),兔抗人HDAC1多克隆抗体(ab19845,美国Abcam公司),SP试剂盒(上海康朗生物科技有限公司);3,3-二氨基联苯胺(DAB)显色试剂盒(北京索莱宝科技有限公司)。采用免疫组织化学法(IHC)检测CD133和HDAC1蛋白在癌组织中的表达水平。癌组织标本均采用4%中性甲醛固定,后进行常规的石蜡包埋、切片。取石蜡切片,进行常规的脱蜡至水,置入3%的过氧化氢(H2O2)中,室温孵育10 min,磷酸盐缓冲液(PBS)洗涤,采用微波炉进行抗原热修复,滴加正常山羊血清,在室温下封闭20 min,弃去血清,滴加稀释好的一抗(CD133,HDAC1的稀释比例均为1∶100),在37℃的环境下孵育2 h,PBS洗涤,滴加生物素二抗(稀释比例1∶200),在室温下孵育30 min,PBS洗涤,DAB显色,反复冲洗,苏木素复染,中性树脂封片。
1.3结果判定 癌组织标本均选择10个含有阳性细胞的高倍视野(×400)分别计数100个细胞,取其平均值计算阳性细胞百分率。阳性细胞百分率得分标准如下:<5%为0分;5%~24%为1分;25%~49%为2分;50%~74%为3分;≥75%为4分。染色程度的得分标准如下:无阳性着色为0分;浅黄色为1分;深黄色为2分;棕黄色为3分。最终得分为阳性细胞百分率得分与染色强度得分的乘积:分值为0~12分,若最终得分≥6分则判定为阳性,<6分则判定为阴性。
1.4统计分析 应用SPSS13.0软件进行χ2检验、Kaplan-Meier生存曲线法、Log Rank检验、受试者工作特征(ROC)曲线分析。
2 结 果
2.1CD133和HDAC1蛋白在晚期胃癌组织中的表达 CD133蛋白的表达主要定位在细胞质,HDAC1蛋白主要定位在细胞核。CD133蛋白在晚期胃癌组织中的阳性表达率为76.00%(57/75),而HDAC1蛋白在晚期胃癌组织中的阳性表达率为53.33%(40/75),晚期胃癌组织中CD133蛋白阳性表达率显著高于HDAC1蛋白(χ2=3.014,P=0.015),见图1。

图1 晚期胃癌组织中CD133和HDAC1蛋白表达(×400,IHC)
2.2CD133和HDAC1蛋白表达与老年晚期胃癌患者的临床病理特征的关系 老年晚期胃癌患者组织中,CD133蛋白表达与肿瘤分期、局部淋巴结转移、肝脏转移及腹膜侵袭均显著相关(均P<0.05),而与有无远处转移和肿瘤分化程度无显著相关性(均P>0.05);HDAC1蛋白表达与肿瘤分期、局部淋巴结转移、肝脏转移、腹膜侵袭及远处转移均无显著相关性(均P>0.05),与肿瘤分化程度显著相关(P<0.05),见表1。
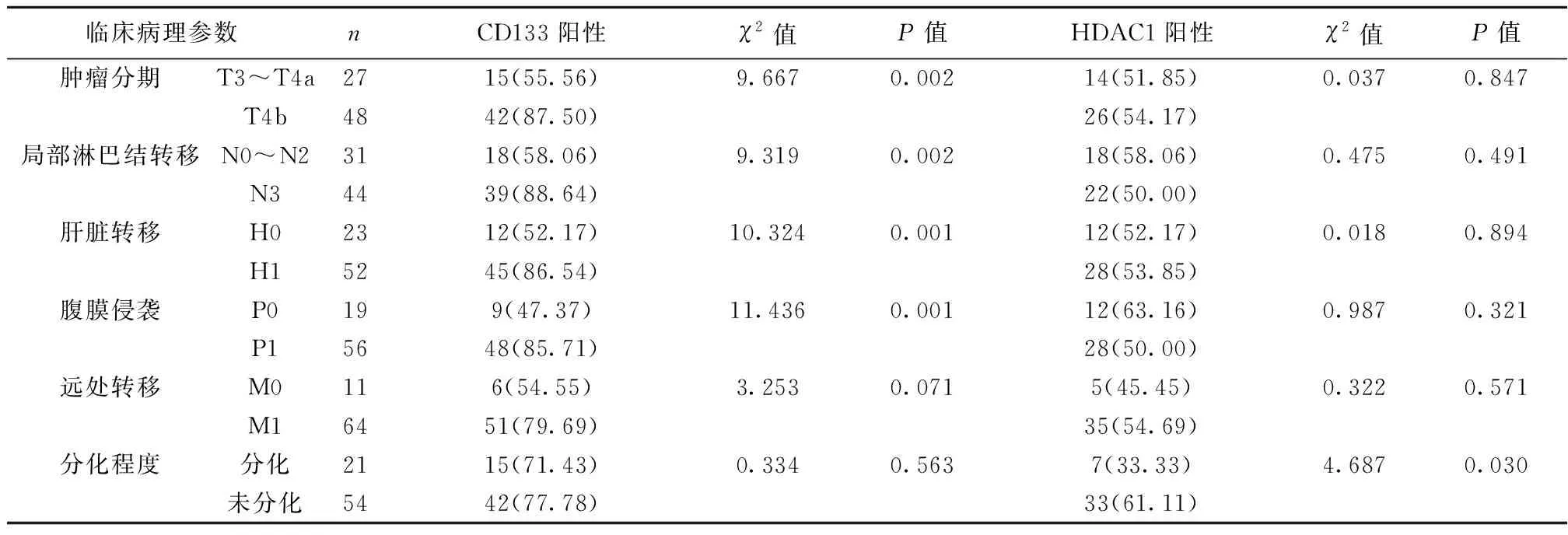
表1 晚期胃癌组织中CD133和HDAC1阳性表达与临床病理特征的关系〔n(%)〕
2.3晚期胃癌组织中CD133和HDAC1蛋白表达与患者生存预后的关系 以生存资料绘制Kaplan-Meier生存曲线,结果显示:CD133阳性表达组(57例)平均术后生存时间为(17.21±1.04)个月,CD133阴性表达组(18例)的平均术后生存时间为(25.83±4.38)个月,两组平均术后生存时间比较差异有统计学意义(χ2=8.614,P=0.030);HDAC1阳性表达组(40例)的平均术后生存时间为(30.89±2.94)个月,HDAC1阴性表达组(35例)的平均术后生存时间为(26.675±2.52)个月,两组平均术后生存时间比较差异无统计学意义(χ2=1.909,P=0.167),见图2。
2.4CD133和HDAC1蛋白表达水平对生存预后的ROC曲线分析 以生存12个月作为预后判断因变量,将75例样本按CD133和HDAC1蛋白的染色指数分别分成0、1~2、3~5、6~8、9~12等5个组段,进行ROC曲线分析。结果显示,预后判断阈值点为:CD133蛋白染色指数=3(理论阈值=2.9,敏感度0.742,特异度0.763)、HDAC1蛋白的染色指数=4(理论阈值=4.6,敏感度0.525,特异度0.513)。提示:胃癌患者CD133蛋白和HDAC1蛋白的染色指数分别高于3和4之后,其12个月生存概率将明显下降。CD133、HDAC1指标的ROC曲线的曲线下面积(AUC)分别为0.784,0.557,提示可能有一定的生存预后价值,但HDAC1蛋白的生存预测价值较低。见图3。
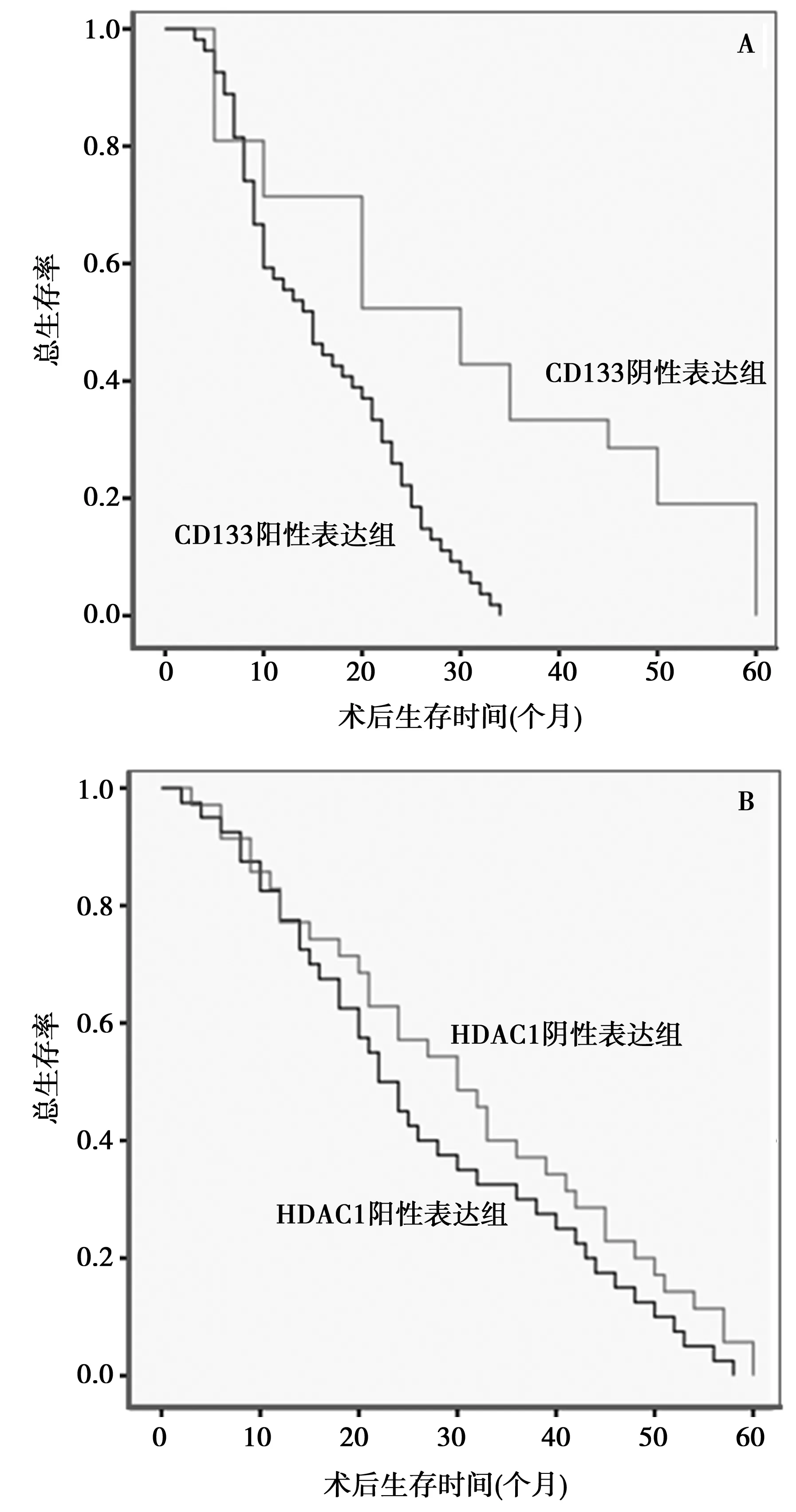
图2 CD133和HDAC1蛋白表达与患者术后生存时间的关系

图3 CD133和HDAC1蛋白的染色指数对胃癌患者生存12个月的预测价值分析(ROC曲线)
3 讨 论
胃癌是发病率最高的消化道肿瘤,死亡率仅次于肺癌,好发于50岁以上人群,近年来随着我国老龄化进程加快,胃癌患病率呈上升趋势〔9〕。近年来,我国胃癌的整体治疗效果已取得突破性进展,其中胃癌根治切除术,已经成为胃癌患者的标准术式〔10〕,然而胃癌患者的术后预后并不乐观,尤其是晚期胃癌患者,术后复发是导致晚期胃癌患者不良预后甚至死亡的主要原因。CSCs与正常干细胞相似,具有自我更新复制、潜在多向分化及归巢功能等,是导致肿瘤发生、转移及复发的根源。近几十年来,针对CSCs的研究进展迅速,探究CSCs表面标记分子在肿瘤形成、侵袭转移及化疗耐药中的作用,是目前的研究热点〔11〕。
CD133又名Prominin-4,是由PROM1基因编码的含有5次跨膜结构的糖蛋白。研究表明,CD133特异性表达于多种肿瘤的CSCs表面,且CD133过表达常常与肿瘤患者的不良预后相关〔12〕。本研究发现CD133高表达可能与胃癌患者的术后复发相关,Liu等〔13〕研究也发现,局部诱导CD133表达,能够促使肝细胞癌复发。本研究结果提示CD133可能参与并且增强了胃癌细胞的侵袭迁移能力,促进胃癌的恶性进展,与Ishiwata〔14〕在肝癌细胞中的研究结果一致,CD133阳性表达细胞比CD133阴性细胞具有更强的侵袭能力。本研究提示CD133表达阳性,术后生存时间更短,预示着患者的不良预后,Lu等〔15〕在胃癌中的研究结果也发现,CD133阳性表达胃癌患者的预后明显较CD133阴性患者差。
CSCs分化成为肿瘤细胞的过程中,表观遗传修饰(如DNA甲基化,组蛋白修饰等)发挥极其重要的作用。甲基化和乙酰化是组蛋白最主要的两种表观遗传修饰方式,组蛋白乙酰化是一种高度动态可逆的共价修饰,HDACs与蛋白乙酰转移酶(HAT)协同参与维持组蛋白乙酰化平〔16〕。在前列腺癌中,HDAC1过表达是预示肿瘤复发、增殖和基因组不稳定的独立指标〔17〕,在胃癌细胞中,HDAC1能够抑制p21转录翻译,进而促进胃癌细胞增殖〔18〕,对HDAC1表达水平的检测,有助于对胃癌患者进行预后评估〔19〕。Sudo等〔19〕在胃癌中关于HDAC1的研究结果显示,HDAC1高表达与胃癌高恶性程度密切相关,可以作为患者预后预测的靶标,而本研究与其结论并不一致,可能是样本例数较少、研究对象为术后复发的老年晚期胃癌患者等因素的限制,后期研究将增加样本数量,进行大样本分析,以得到更为可靠的结论。
综上所述,CD133蛋白在晚期胃癌中异常高表达,检测其表达水平对老年晚期胃癌患者的术后治疗和预后判断具有一定的意义。

