地昔帕明对兔动脉斑块细胞凋亡及内质网应激的影响
赵 敏,游柏阳, 潘 玮,黄 金,李荣华,李新辉,张国刚
(中南大学湘雅医院1. 核医学科、2. 心血管内科,湖南 长沙 410008)
动脉粥样硬化(atherosclerosis,AS)易损斑块是急性心脑血管事件发生的病理基础,包括薄而大的脂质中心、偏心性纤维帽、大量的炎细胞浸润、细胞凋亡等,易损斑块容易破裂和血栓形成是导致急性心脑血管事件的主要原因。目前,临床稳定易损斑块的药物主要为降脂抗炎类药物(如他汀类),但仅能减少死亡率30%~40%[1]。因此,研发新型抗AS药物具有重要临床意义。
细胞凋亡是影响AS斑块稳定性的一个重要的病理过程, 凋亡后形成的细胞碎片使得斑块内炎症加重,促进泡沫细胞的形成,泡沫细胞在斑块肩部聚集增多,释放基质金属蛋白酶和组织蛋白酶,降解斑块内的胶原成分,减少纤维帽的厚度,促使斑块趋于不稳定[2]。内质网应激是新近发现的一种细胞凋亡的途径,表现为各种刺激引起的内质网腔大量蛋白质蓄积,引发未折叠蛋白质应答。既往研究表明,多种因素诱发的内质网应激可促进巨噬细胞凋亡,是导致斑块不稳定的重要原因[3]。
酸性鞘磷脂酶(acid sphingomyelinase,ASM)是鞘磷脂代谢关键酶,在人和动物的AS斑块中有高表达,并且参与氧化修饰及低密度脂蛋白(low-density lipid,LDL)聚集,促进泡沫细胞形成[4]。课题组前期研究发现,急性冠脉综合征患者的血浆ASM活性明显高于稳定性心绞痛患者,提示ASM与斑块易损性有关[5]。之后我们在体外实验发现,在氧化型低密度脂蛋白(ox-LDL)诱导作用下,ASM水解引起巨噬细胞内神经酰胺增加,诱发内质网应激,激活下游促凋亡因子CHOP,最终导致巨噬细胞凋亡,而ASM抑制剂地昔帕明(desipramine,DES)可明显抑制巨噬细胞凋亡[6]。本研究通过体内实验,进一步探讨DES能否对AS斑块内细胞凋亡及内质网应激产生影响。
1 材料
1.1实验动物♂新西兰大白兔,体质量(3.0±0.2)kg,由长沙市天勤生物技术有限公司提供,许可证号:SYXK(湘)2012-003。
1.2试剂高脂饲料(质量分数为1%胆固醇+5%猪油+10%蛋黄粉+84%普通饲料),购自上海福贝世亨生物医药公司;DES、兔抗葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)抗体(美国Sigma公司);ox-LDL ELISA试剂盒(美国Cloud-Clone公司);鼠抗GAPDH抗体(美国Abcam公司);鼠抗CHOP抗体(美国Santa Cruz公司);辣根过氧化物酶标记的羊抗兔、抗鼠IgG,购自中杉金桥公司;BCA蛋白定量试剂盒、DAB显色试剂盒,购自江苏碧云天生物有限公司;细胞凋亡原位检测试剂盒,购自德国罗氏公司。
1.3仪器AU680全自动生化分析仪(Beckman公司);凝胶电泳仪和凝胶显像分析系统(Bio-Rad公司);超压液相色谱仪(UPLC)及色谱柱(Waters公司)。
2 方法
2.1AS斑块兔模型的建立实验兔适应性喂养1周后,给予高脂饲料喂养2周,行腹主动脉球囊损伤术,具体方法为:戊巴比妥钠(1 mL·kg-1)耳缘静脉麻醉后,经耳缘静脉注射肝素钠200 U·kg-1,固定。沿左股动脉走行方向纵行逐层切开皮肤.钝性分离肌肉,游离股动脉,通过4F导管将球囊(3.5 mm×15 mm)送入降主动脉约20 cm。球囊加压,保持压力为10~14标准大气压,反复回拉5次,之后减压退出导管,造成腹主动脉内皮损伤。之后继续给予高脂饲料喂养10周,共喂养12周。
2.2实验分组实验最后4周,随机分为高脂喂养组(high-fat diet,HFD, 8只)和HFD+DES组(8只),同时设立普通饲料喂养的正常对照组(normal control,NC,10只)和DES组(9只),将DES粉末溶于生理盐水中,按照兔质量给予4 mg·kg-1不同体积的DES溶液灌胃治疗,NC组和HFD组给予生理盐水,每天1次,共计4周。所有动物均自由饮水及进食。
2.3标本采集与指标检测
2.3.1样本采集 各组兔在12周末处死前禁食6 h,不禁水,测体质量后,取耳缘静脉血, 一部分留取血清,检测血清总胆固醇(total cholesterol, TC)、甘油三脂(triglycerides, TG)、高密度脂蛋白(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白(low-density lipoprotein cholesterol, LDL-C);另一部分用肝素抗凝管留取血浆,-80 ℃保存,待测ox-LDL、ASM和神经酰胺水平。实验兔处死后,取腹主动脉组织,一部分用质量分数为4%多聚甲醛固定做石蜡包埋,用于苏木精-伊红(HE)染色和TUNEL染色;另一部分-80 ℃保存待测ASM、神经酰胺含量及GRP78、CHOP蛋白表达。
2.3.2血脂检测 血清TC、TG、HDL-C、LDL-C由湘雅医院检验科全自动生化仪测定完成;血浆ox-LDL测定采用双抗夹心ELISA法,按试剂盒说明书操作。
2.3.3ASM和神经酰胺测定 参考本课题组前期研究方法[6],采用UPLC法测定血浆及组织内的ASM活性及神经酰胺水平。
2.3.4HE染色 石蜡切片脱蜡后,按HE染色常规方法,苏木素溶液中染色,70%~100%浓度梯度乙醇脱水;二甲苯透明,封片干燥后,光镜下观察。
2.3.5TUNEL法检测细胞凋亡 石蜡切片脱蜡后,按照TUNEL试剂盒操作步骤进行染色,测定斑块细胞凋亡率。采用图像分析软件Image-Pro Plus 6.0,每张切片随机取3个高倍镜下视野,计算200个细胞。DAB染色,细胞核呈深棕色为阳性,正常细胞核为蓝色。计算凋亡细胞占总细胞的比例。
2.3.6Western blot检测蛋白表达 提取兔腹主动脉,采用BCA蛋白测定试剂盒测定组织蛋白含量。一抗稀释浓度分别为:GRP78(1 ∶800)、CHOP(1 ∶100)、GAPDH(1 ∶10 000)。用凝胶图像处理系统测定目标蛋白和GAPDH灰度值,将两者比值作为目标蛋白的半定量相对含量。

3 结果
3.1DES对兔体质量和血脂的影响如Tab 1所示,高脂饲料喂养前,各组兔的TC、TG、LDL-C、HDL-C、ox-LDL差异均无统计学意义(P>0.05)。第12周末,高脂喂养兔(HFD及HFD+DES组)的各项血脂指标水平明显增高,均高于NC组(P<0.01);HFD组和HFD+DES组之间比较,各项血脂指标差异无统计学意义(P>0.05),提示DES干预对血脂影响无显著性。

Tab 1 Comparison of weight and lipid profiles in each group of
**P<0.01vsNC

Tab 2 Effects of DES on ASM and ceramide in each group of
*P<0.05,**P<0.01vsNC;#P<0.05,##P<0.01vsHFD
3.2DES对ASM活性和神经酰胺水平的影响如Tab 2所示,在普通饲料喂养兔中,DES干预降低血浆ASM活性(P<0.05),但对主动脉ASM、血浆和主动脉内神经酰胺水平无明显影响;在高脂喂养兔中,DES干预能降低血浆及主动脉的ASM活性和神经酰胺水平,差异均有统计学意义(P<0.05,P<0.01)。
3.3DES对腹主动脉AS斑块的影响Fig 1 的HE染色结果显示,NC组(Fig 1A)和DES组(Fig 1B)腹主动脉内膜光滑。HFD组腹主动脉内膜增厚,血管壁3层结构紊乱不清,内膜下可见AS斑块形成,其内大量泡沫细胞增生,中层平滑肌细胞排列紊乱,胞质嗜酸性染色减弱,并可见纤维帽变薄或中断及血栓形成,其斑块占血管内膜面积比为(79.96±7.57)%(Fig 1C),而HFD+DES组AS斑块面积较HFD组缩小为(55.44±10.76)%(P<0.01,Fig 1D)。
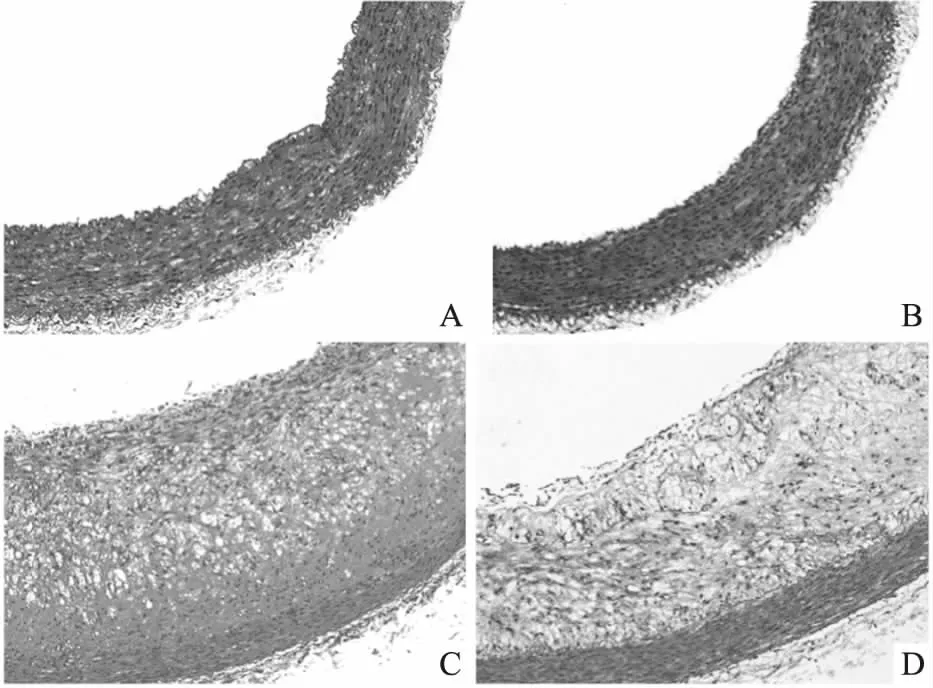
Fig 1 HE staining in abdominal aorta of rabbits(×100)
A:NC; B:DES; C:HFD; D:HFD+DES.
3.4DES对腹主动脉组织细胞凋亡的影响Fig 2的TUNEL染色结果显示,NC组(Fig 2A)和DES组(Fig 2B)血管壁未见明显凋亡细胞,HFD组斑块的脂质核心及纤维帽内可见凋亡细胞明显增加,并形成凋亡细胞聚集区域(Fig 2C),而HFD+DES组可见斑块内的凋亡细胞明显减少(Fig 2D)。定量分析显示,HFD对照组及HFD+DES组斑块内细胞凋亡率分别为(15.09±5.15)%和(7.04±3.61)%,两者比较差异有统计学意义(P<0.01)。
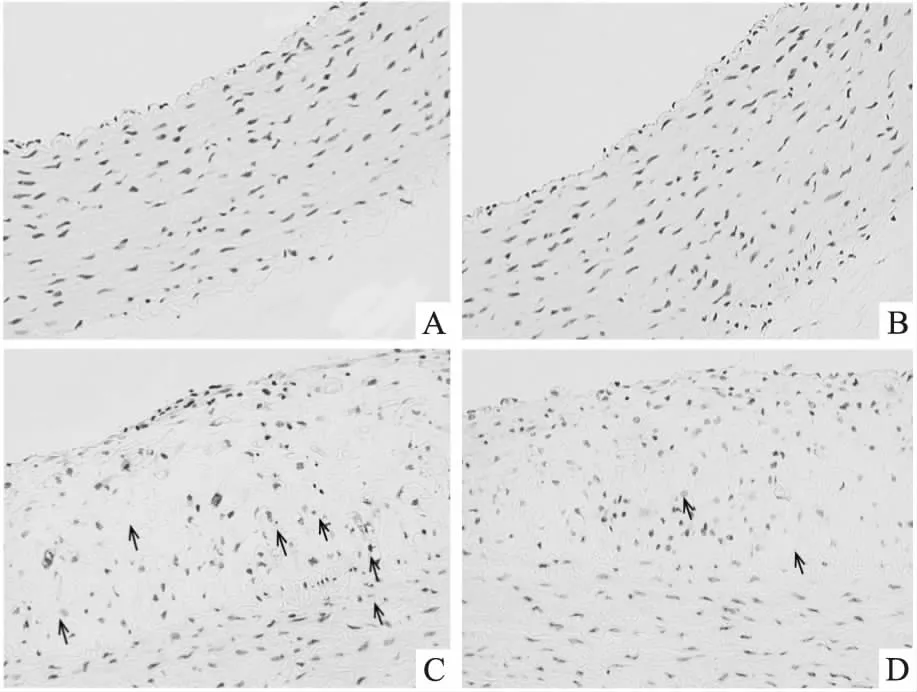
Fig 2 TUNEL staining in abdominal aorta of rabbits(×200)
A:NC; B:DES; C:HFD; D:HFD+DES. Arrow indicated apoptotic cells.
3.5DES对腹主动脉组织GRP78、CHOP蛋白表达的影响如Fig 3 所示,与正常对照组比较,HFD组组织内的GRP78和CHOP蛋白表达明显升高(P<0.05,P<0.01);与HFD组比较,HFD+DES组降低了组织内GRP78、CHOP蛋白表达,差异有统计学意义(P<0.05,P<0.01)。
4 讨论
鞘磷脂是一类参与脂蛋白与生物膜形成的重要磷脂成分,也是组成AS斑块的重要成分,并参与AS的发生、发展。神经酰胺是鞘磷脂代谢最关键的第二信使。已知的神经酰胺代谢途径主要包括从头合成途径、鞘磷脂酶催化释放途径以及神经酰胺酶水解途径。已有研究表明,从头合成途径抑制神经酰胺水平可减小高脂喂养的ApoE-/-小鼠的斑块面积,减轻斑块的炎症反应及组织坏死[7-8]。而在鞘磷脂酶催化释放途径方面,有研究发现,ASM可促进LDL聚集及动脉管壁的泡沫细胞的形成,而抑制ASM可减轻内皮细胞对ox-LDL的胞吞作用,缓解动脉管壁内皮的脂质沉积[9]。敲除ASM基因可使高脂喂养的ApoE-/-或LDL-/-小鼠的血浆神经酰胺水平降低,斑块面积缩小40%~50%,脂质沉积减少81%~87%,并且该作用独立于胆固醇及脂蛋白[10]。DES是一种三环类抗抑郁药,有明显的抑制ASM作用[11],我们既往研究证实,DES可明显降低巨噬细胞内ASM活性和神经酰胺水平[6]。根据文献[12]及《药理实验方法学》实验动物药物剂量换算,我们选择中等剂量(4 mg·kg-1·d-1)的DES干预4周,与未干预组比较,可明显观察到血浆和主动脉的神经酰胺水平的降低,提示中等剂量DES可抑制AS兔斑块内ASM活性,并下调神经酰胺水平。

Fig 3 Expression of GRP78 andCHOP protein in abdominal aorta of rabbits
*P<0.05,**P<0.01vsNC;#P<0.05,##P<0.01vsHFD
细胞凋亡贯穿了AS发生发展全过程。在晚期斑块中,平滑肌细胞和巨噬细胞均存在着细胞凋亡, 其中平滑肌细胞的丢失会加速斑块纤维帽的破裂,而未清除的凋亡的巨噬细胞会促进细胞残骸在粥样斑块中的脂质池中聚集, 从而加速斑块的形成和破裂。正常血管的全层及粥样硬化的血管中膜、外膜均存在少量凋亡细胞,但发生率远低于粥样硬化斑块病灶。有文献分析心源性猝死患者的冠状动脉显示, 在斑块破裂部位有广泛的细胞凋亡, 而在远离斑块破裂部位, 凋亡则不明显;巨噬细胞比平滑肌细胞更容易出现凋亡,减少巨噬细胞的凋亡能够降低斑块内坏死核心的范围[13]。内质网应激是由各种刺激引起的内质网腔内错误折叠、未折叠蛋白质聚集,以及细胞内钙平衡紊乱,是引起凋亡的主要途径之一,通过糖调节蛋白GRP78,激活下游特异性转录因子CHOP,诱导细胞凋亡。近年研究发现,内质网应激诱导的细胞凋亡是导致AS斑块不稳定的重要因素:在人冠状动脉AS斑块标本中发现,有易损斑块的内质网应激激活改变,而稳定斑块没有,并且不稳定性心绞痛患者循环中的内质网应激指标明显高于稳定性心绞痛患者[14],提示内质网应激导致的细胞凋亡可以促进AS斑块的易损性。我们的既往研究发现,DES抑制ASM活性后,可降低神经酰胺水平,缓解ox-LDL诱导的巨噬细胞内质网应激及凋亡,相反,外源性的ASM可以明显激活内质网应激,提示ASM-神经酰胺途径在ox-LDL诱导的巨噬细胞凋亡中有重要作用[6]。本研究进一步通过体内实验发现,抑制ASM可以减少AS斑块内的内质网应激指标GRP78和CHOP表达,结合以上研究结果表明,ASM升高可能通过增加斑块内内质网应激及细胞凋亡水平,促进AS斑块的发生发展。
脂质沉积是AS斑块形成的主要因素,其主要成分为胆固醇。临床常用于稳定斑块的他汀类药物的作用机制主要是降低脂质(胆固醇为主)和减轻炎症。本研究发现DES对血脂水平无明显影响,其机制可能是由于ASM水解生成的神经酰胺主要聚集在斑块内的LDL,而与循环中的LDL无关。
综上所述,DES可明显降低高脂喂养兔的血浆和主动脉组织的ASM和神经酰胺水平,但对血脂无明显影响;DES可明显降低斑块内的细胞凋亡及内质网应激,从而减少泡沫细胞的聚集,减少AS斑块面积,这为理解鞘磷脂代谢通路在AS发生、发展中的作用开拓了全新的思路。
(致谢:本实验在中南大学高血压研究所完成。感谢美国西奈山医学院何兴轩教授赠送的部分试剂及实验操作指导。)

