金纳米颗粒作用下全α型蛋白质构象转变过程研究
游 乐,姜舟婷
(中国计量大学 理学院,浙江 杭州 310018)
生物体系是一个复杂开放的体系,与环境进行着物质交换,其中包括纳米颗粒通过呼吸系统、消化道、皮肤等组织,进入到人体血液循环系统,从而到达全身[1]。当纳米颗粒与蛋白质发生相互作用后,不仅可以诱导蛋白质的构象以及功能的改变[2-3],也可以引起纳米材料的电荷性质、表面亲疏水性等物理化学性质的变化,影响纳米粒子在机体内产生的生物效应[4-5]。因此深入研究分子水平下纳米颗粒与蛋白质的相互作用以及纳米颗粒作用下蛋白质的结构特征和动力学行为,对于充分认识生命现象,控制生物过程乃至发明新型药物和诊疗方法,都具有重要的意义。
金属型纳米颗粒是极其重要的一类纳米材料,它具有较大的比表面积,较高的表面能和表面晶体缺陷等特点,体现出金属材料和纳米材料的双重特性,这些特性使得金属型纳米颗粒在分子造影、生物靶向、磁性分离、药物输运等诸多生物医药领域具有广泛的应用[4-6]。譬如金纳米颗粒能够引起包含蛋白质在内的生物分子的弹性、形态、运动、黏附及入侵等性能的改变,并对干细胞的增殖分化产生影响[7]。将金纳米粒子作为药物的载体,可以提高药物局部浓度[8-9]。但无论通过何种途径进入血液中的纳米颗粒表面会迅速被血液蛋白包裹,形成纳米颗粒-蛋白质冠,它是纳米颗粒在生命体内的真实身份,因此对纳米颗粒-蛋白质复合体的整体研究显得尤为重要。
计算机模拟方法直接基于原子水平对纳米颗粒与蛋白质相互作用方式进行研究,已被越来越多的科学家所采纳。如CHARCHAR等[10]用模拟的方法研究纳米Au颗粒和生物表面的相互影响。LIN等[11]采用Monte Carlo模拟纳米Au颗粒在辐射医疗过程中作为放射致敏剂与辐射源的关系。国内相关领域的研究工作也有所进展。南京大学的马余强教授带领的课题组模拟细胞膜上纳米颗粒输运蛋白质过程[12]。南京大学王炜教授课题组利用粗粒化和全原子模型研究了蛋白质吸附在纳米颗粒上的构型相变及去折叠过程[13-14]。复旦大学的左光宏采用分子动力学模拟研究纳米颗粒对于蛋白质构象与功能的影响以及由此带来的生物纳米毒性[15]。这些工作加深了对生物分子与纳米颗粒结合、解离过程的理解,也推动了整个研究的进展。但同时我们也看到该领域还存在许多争议的问题,如蛋白质和纳米颗粒之间存在广泛的能量交换和几何影响,这些因素是如何相互竞争最终获得稳定的构型,蛋白质与金属型纳米颗粒的结合和解离过程与自然拓扑结构的异质度有很大的统计相关,但组态系综的物理图景并不清晰,因此对蛋白质和纳米颗粒的相互作用体系,金属型纳米颗粒涉及的转化机制和影响因素有待进一步研究。
在蛋白质结构的研究中,往往根据其基本组成单位氨基酸的排列顺序和空间结构,将蛋白质分子的结构分为四个层次:一级结构、二级结构、三级结构、四级结构。其中α螺旋结构(α-helix)、β折叠结构(β-sheet)、转角结构(turn)和无规线团结构(coil)是蛋白质二级结构的最基本形式[16]。在本研究中,我们采用分子动力学模拟的方法研究全α型蛋白质1 BBL在不同粒径的金纳米颗粒影响下,其结构特征及构象转变的动力学过程,探索纳米颗粒与蛋白质的结合方式和作用机理,从分子水平了解纳米颗粒与生命体系的相互影响,为拓宽纳米颗粒在医学诊断、药物输运、基因治疗、生物仿生等方面的应用提供理论依据。
1 模型及计算方法
以大肠杆菌二氢脂酰胺脱氢酶(E3)为蛋白质样品(PDB code:1 BBL),它由37个氨基酸组成,二级结构中存在2个α螺旋片段(No.15-23氨基酸和No.41-47氨基酸)。模拟盒子大小约为5.3 nm×5.3 nm×5.3 nm,添加4 413个TIP3P水分子体现溶剂效应。1 BBL本身带有一个单位正电荷,需在水盒子中加入1个氯离子使系统呈中性。金纳米颗粒的构建在金晶胞的基础上扩展,采用4种不同大小的纳米颗粒和1 BBL蛋白质进行相互作用,用NP4、NP32、NP108、NP256来表示不同尺寸的纳米颗粒,其中下标数字表示组成纳米颗粒的金原子数目。采用CHARMM27力场并利用NAMD2.6软件对蛋白质-纳米颗粒复合体系执行分子动力学模拟[17]。整个体系首先进行能量最小化,然后在恒温恒压下(压强和温度分别为1 atm(1 atm=101.3 kPa)和310 K)进行12 ns的分子动力学模拟。非键相互作用的截断半径距离为1.2 nm。为了比较纳米颗粒对蛋白质的作用,我们也模拟了不加纳米颗粒情况下蛋白质的动力学过程。模拟采用周期性边界条件,并用Langevin算法控制温度和压强[18-19]。
蛋白质的均方根偏差(root mean square deviation, RMSD)通常被用来描述其结构的稳定性,其定义为
(1)
其中,N为组成蛋白质的原子数目,rfinal(i)和rinitial(i)分别是第i个原子在模拟过程中的当前结构和初始结构坐标。均方根偏差体现了蛋白质构象相对变化程度,它可以作为衡量体系是否达到动态平衡的重要指标。
结构参量回转半径(radius of gyration,Rg)描述蛋白质分子的整体尺寸,标志着蛋白质分子的疏松程度。回转半径值越大说明体系越松散。回转半径Rg的定义为
(2)
其中N是体系中蛋白质原子的数量,r(i)和rcenter分别是第i原子的坐标和质心的坐标。
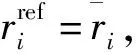
(3)
其中,ttotal为总模拟时间。在本文中主要研究蛋白质骨架碳原子的涨落情况,由此判断蛋白质分子运动的自由程度。
本文中,我们将对蛋白质1 BBL在不同大小的金纳米颗粒作用下的结构稳定性、松散程度和蛋白质骨架碳原子的自由程度进行分析。采用STRIDE算法研究蛋白质1 BBL的二级结构转变过程。除了结构参数以外,蛋白质体系的各部分能量及蛋白质内部、蛋白质和水分子的氢键数目也将作统计分析。这些研究结果将为理解蛋白质在纳米颗粒作用下的结构特征和动力学行为提供了理论支持。
2 结果与讨论
2.1 体系能量分析
本文选取了五个不同的模拟体系研究纳米颗粒的大小对蛋白质结构的影响。在分子动力学模拟中,势能部分包含了所有分子内和分子间相互作用的全部信息。这里构成蛋白质体系的势能包括键能和非键能。其中键能包括键伸缩能、键弯曲能、二面角扭转能等,非键能包括范德华能和静电能。计算各个原子的势能梯度,即可得出该原子在分子力场中所受到的力,进一步分析出原子的运动行为。表1为不同的模拟体系在平衡后的各部分能量数据。

表1 蛋白质-金纳米颗粒相互作用体系平衡态各部分能量
从表1中的数据,我们看到不同大小的纳米颗粒与蛋白质1 BBL作用,蛋白质的键能随着纳米颗粒尺寸的增加而增加,这主要来源于键扭转能的贡献。纳米颗粒大小的改变对蛋白质分子键伸缩能和键弯曲能的影响相对较小。键扭转能的增加,说明蛋白质分子形成更为松散的结构。纳米颗粒大小的改变对蛋白质能量影响最大的是范德华能,随着原子数目的增加,更多的原子—原子对之间形成两两相互作用,使得范德华能随着纳米颗粒尺寸增加而显著下降。而这部分能量是影响体系总势能下降的根本原因,这说明非键相互作用对稳定蛋白质结构起到关键的因素。
2.2 结构参数分析
对于全原子的分子动力学模拟,在体系能量达到动态平衡后,对蛋白质结构数据进行采集分析。其中均方根偏差(RMSD)用于衡量原子振动幅度的大小,从而体现蛋白质分子的结构稳定性。图1为不同的模拟体系的均方根偏差值随模拟时间的变化。从图1中,我们发现当小纳米颗粒和蛋白质相互作用时,蛋白质的RMSD值稍稍减小,但随着组成纳米颗粒的金原子数目增加,RMSD的值略微增加。当组成纳米颗粒的金原子数目小于32,即纳米颗粒的尺寸在0.61 nm以下时,纳米颗粒的大小对蛋白质的稳定性影响不大,RMSD的平均值大小为0.26 nm。随着组成纳米颗粒的原子数目进一步增加,纳米颗粒尺寸增大,RMSD也急剧增大,在NP256金纳米颗粒的作用下,蛋白质1 BBL的RMSD增加到0.59 nm。此外,在较大金纳米颗粒的作用下,RMSD达到稳定值所需的特征时间更短。

图1 不同大小的金纳米颗粒作用下蛋白质1 BBL的均方根偏差(RMSD)随模拟时间的变化
我们同时研究了蛋白质的回转半径随模拟时间的变化,见图2(a)。回转半径体现了蛋白质分子的松散程度。从图中我们得到与RMSD变化趋势接近的规律。在蛋白质体系中加入小纳米颗粒NP4,蛋白质的回转半径基本不变;随着纳米颗粒尺寸的增加,蛋白质回转半径明显增加。当纳米颗粒NP256和蛋白质相互作用体系中,蛋白质的回转半径从不加纳米颗粒的0.93 nm增加到1.33 nm。氢键对稳定蛋白质的二级结构的起了重要的作用。图2(b)给出了不同模拟体系中的氢键数目的平均值,包括蛋白质分子内的氢键数目,蛋白质分子和水分子间的氢键数目以及体系总的氢键数目,并和蛋白质的回转半径平均值进行比较。从图2(b)中我们看出,蛋白质和水分子之间的氢键数目大约是蛋白质分子内部的氢键数目的6~10倍。随着纳米颗粒尺寸的增加,不管是蛋白质内部的氢键还是蛋白质与水分子之间的氢键数目都在下降,其中蛋白质内部氢键数目的下降更为明显,在NP256纳米颗粒的作用下,蛋白质内部的氢键数目仅为不加纳米颗粒时的1/3。这和蛋白质回转半径的大小随纳米颗粒尺寸的变化规律恰恰相反,即随着体系中纳米颗粒的增加,蛋白质变得更松散,同时,起到稳定结构作用的氢键数目在减少,蛋白质结构也变得更不稳定。图2(b)中还同时给出了蛋白质1BBL在不加纳米颗粒以及与纳米颗粒NP32和NP256相互作用时平衡态的典型构型图。图2(b)中,我们发现在不加纳米颗粒时,蛋白质2个双螺旋结构保持得很好;加了小纳米颗粒时,一个双螺旋结构比较明显,蛋白质回转半径在增加;当蛋白质和大纳米颗粒作用时,回转半径进一步增大,2个双螺旋结构都被破坏。

图2 不同大小的金纳米颗粒作用下蛋白质1BBL的回转半径(Rg)随模拟时间的变化以及平均氢键数目与平均回转半径的比较
蛋白质在不同大小的纳米颗粒作用下,其均方根偏差和回转半径的变化规律说明纳米颗粒的大小对体系的结构及稳定性有影响。这种影响在大尺寸的纳米颗粒中更明显,原因在于随着组成大纳米颗粒的原子数目增加,更多的原子-原子对参与到和蛋白质分子的两两相互作用,范德华势能对稳定体系起到关键因素。也正因为纳米颗粒外层原子对蛋白质的吸引作用,使得蛋白质的回转半径随着纳米颗粒尺寸的增加而增加,形成更为松散的结构。此外,从均方根涨落的数据中,我们还能发现是哪几个氨基酸残基最容易受到纳米颗粒的影响(见图3)。在图3中,蛋白质1BBL在NP32纳米颗粒的作用下,氨基酸序列为21-31片段的均方根涨落值有增加,其他片段和不加纳米颗粒的情况下基本相同,甚至更低。但在NP256纳米颗粒的影响下,几乎组成整条蛋白质链的氨基酸残基的方根涨落值都比体系不存在纳米颗粒的情况下要大。氨基酸序列15-23及31-44片段增加得特别明显,这基本对应了蛋白质1BBL的两个α螺旋片段,说明其二级结构受到纳米颗粒的影响,发生转变。下面将对蛋白质1BBL在不同纳米颗粒作用下的二级结构演变作一详细讨论。

图3 组成蛋白质的不同氨基酸中心碳原子的均方根波动值
2.3 二级结构分析
蛋白质1 BBL的初始结构中包括2个α螺旋片段,分别是氨基酸序列号No.15-23和No.41-47的氨基酸残基构成。蛋白质二级结构分析可以用来监测蛋白质的折叠过程与突变造成蛋白质结构的变化以及配体的结合对蛋白质结构的影响等。利用VMD软件中STRIDE算法可以得出蛋白质的二级结构,这是一个基于知识学习法则,它考虑氢键能量并统计蛋白质扭转角,把蛋白质的三维空间结构信息归纳到氨基酸序列的不同二级结构。为了便于比较,我们选取NP0、NP32、NP256三种纳米颗粒作用下蛋白质二级结构随模拟时间的演变过程,如图4。在没有加入纳米颗粒的单链蛋白质1BBL模拟体系中,整个模拟时间内,两个α螺旋二级结构还被保持得很好,没有解旋的现象。当模拟体系中加入纳米颗粒NP32之后,氨基酸序列No.15-23片段的α螺旋二级结构基本还能保持,仅仅偶尔出现螺旋结构长度减小的情况;但是总体螺旋结构没有破坏,而氨基酸序列No.41-47片段原本的α螺旋结构会演变成转角结构,并在转角结构和α螺旋结构之间反复变换。因此相比较而言后者的螺旋结构更不稳定,容易受到纳米颗粒的影响。当纳米颗粒的尺寸进一步增加,蛋白质1BBL在NP256的作用下,2个螺旋结构都被解旋,形成转角或者无规线团的松散结构,这些结构的稳定性将大大降低。因此,从二级结构演变的角度,我们也可以得到相同的结论,即纳米颗粒尺寸越大,对蛋白质的相互作用越明显,蛋白质形成更为松散的结构,结构的稳定性进一步减弱。

图4 蛋白质1 BBL二级结构在NP0和NP32以及NP256三种纳米颗粒作用下随模拟时间的变化
3 结 语
文中采用分子动力学模拟的方法研究不同尺寸的金纳米颗粒对蛋白质1BBL的结构稳定性、整体尺寸及骨架碳原子的运动自由程度的影响,以及其二级构象在纳米颗粒作用下的转变过程,并结合体系的势能(特别是范德华能)和氢键数目的变化,从能量角度分析结构变化的原因。结果表明,组成纳米颗粒的原子数目增加,会使得模拟体系中的原子-原子相互作用对增多,范德华能量锐减,这是体系总势能减少的根本原因。此外,纳米颗粒尺寸的增加,会使蛋白质形成更为松散的结构,结构稳定性减弱。氢键数目随着纳米颗粒尺寸的增加而呈下降的趋势,特别是蛋白质分子内部的氢键数目下降明显,这同样说明了在纳米颗粒的作用下,蛋白质的结构稳定性在降低,纳米颗粒的尺寸越大,蛋白质的结构稳定性越差。从蛋白质1BBL的二级结构分析中,我们还发现氨基酸序列No.41-47片段的α螺旋结构比No.15-23的α螺旋结构更容易受到外部纳米颗粒的影响解旋为转角或者无规线团的结构,这个结论在蛋白质骨架碳原子的均方根涨落规律中同样获得体现。这些研究结果为理解全α型蛋白质在纳米颗粒作用下结构特征和动力学行为提供了基本的解释。接下来,我们还会继续研究其他类型的蛋白质在纳米颗粒作用下的结构变化情况,希望这些从分子水平的研究结果能为人们利用纳米颗粒在生物医药方面的应用提供理论支持。

