磁化水处理对镉胁迫下欧美杨幼苗光合及生长特性的影响*
张 瑛, 刘秀梅, 张志浩, 孟诗原, 王 倩, 韦 业,王华田**, 陈淑英, 丛桂芝, 唐 金, 秦德明
磁化水处理对镉胁迫下欧美杨幼苗光合及生长特性的影响*
张 瑛1,2, 刘秀梅1,2, 张志浩1,2, 孟诗原1,2, 王 倩1,2, 韦 业1,2,王华田1,2**, 陈淑英3, 丛桂芝3, 唐 金3, 秦德明3
(1. 山东农业大学林学院 泰安 271018; 2. 黄河下游森林培育国家林业局重点实验室 泰安 271018; 3. 伊犁州林业科学研究院 伊宁 835000)
为探讨磁化水灌溉处理在促进植物生长、提高植株重金属耐受性方面的作用机制, 本研究采用随机区组试验设计, 研究了镉胁迫(0 μmol·L-1、50 μmol·L-1、100 μmol·L-1)下磁化水灌溉处理对1 a生欧美杨‘I-107’光合特性、叶绿素荧光动力学参数及生长特性的影响。结果表明: 1)镉胁迫会显著降低植株高生长和根茎叶干物质量; 低浓度(50 μmol·L-1)镉处理促进根系直径及体积增大(<0.05), 高浓度(100 μmol·L-1)则会抑制根系各形态参数; 镉胁迫下欧美杨叶绿素b和类胡萝卜素含量分别降低12.50%、43.24%和19.27%、46.37%(<0.05), 净光合速率(n)、蒸腾速率(r)、胞间二氧化碳(i)分别降低13.68%和33.68%、8.07%和27.81%、5.00%和14.99%(<0.05), 同时, PSⅡ潜在活性(v/m)、最大光化学速率(v/o)、光合性能指数(PIabs)和量子产额(Eo)均有不同程度降低。2)磁化水灌溉提高镉胁迫植株高生长及根茎叶干物质量, 增加植株根系长度及表面积; 同时, 叶绿素a、叶绿素b和类胡萝卜素含量在0 μmol·L-1和100 μmol·L-1镉胁迫下分别提高16.99%、40.20%, 8.67%、39.10%和17.32%、50.52%(<0.05);s、i及WUE显著升高,r则降低24.20%、23.33%、12.06%(<0.05); 另外,vm、vo、PIabs显著升高(<0.05)。综上所述, 磁化水灌溉处理有助于提高镉胁迫下欧美杨幼苗光合色素含量, 维持光合机构功能, 增强光合碳同化速率, 减轻镉胁迫对植株生长发育的抑制。
镉胁迫; 磁化水灌溉; 欧美杨I-107; 光合; 生长
由于金属矿山冶炼、污水灌溉、工业废气排放和农药化肥使用等活动, 土壤中镉等重金属污染越来越严重[1]。据2014年“全国土壤污染状况调查公报”显示, 镉污染物位点超标率位列8种无机污染物之首[2]。目前, 镉污染遍及我国11省市25个地区, 且呈不断增加趋势, 因此, 镉污染问题变得日趋严峻[3]。镉具有较强的毒性和移动性[4], 土壤中过量的镉必然会严重影响植物的生理代谢和生长发育进而影响农产品质量[5]。研究表明, 镉胁迫会抑制叶绿素的生物合成, 破坏叶绿体结构[6]; 影响水分平衡、养分吸收, 损坏光合机构[7]; 损伤捕光色素蛋白复合体(LHCⅡ)、降低PSⅡ反应中心活性和光合电子传递量子效率[8], 并且, 还会降低酶活性, 阻碍植株体内糖及蛋白质的合成[9], 从而导致植株体内一系列生理活动紊乱, 最终抑制植株生长。因此, 土壤镉污染的生态修复问题亟待解决。目前国内外镉污染土壤的修复方法主要有物理、化学和生物3大类[10], 但以客土法和电动修复法为代表的物理修复技术以及化学治理等均因技术、经济或者二次污染的原因在实际生产生活中难以应用, 生物措施中的植物修复是修复镉污染土壤最常用的方法。
磁化水处理技术作为一种新型生物磁技术, 具有简便、高效的特点, 目前已经被广泛应用于农林等各个领域, 其基本原理是液态水以一定流速经过一定强度的磁场后, 受洛伦兹力的影响, 水的物理结构和化学性质等发生一系列变化[11], 如水分子之间氢键弱化, 水分子活性增强, 溶氧量、电导率等都会发生变化。研究发现, 磁化水灌溉可以提高雪豌豆(L.)和鹰嘴豆(L.)幼苗的发芽率和生物量[12], 增加小麦(L.)体内光合色素含量[13]; 此外, 刘秀梅等[14]研究发现磁化水灌溉可以调节盐胁迫下欧美杨(×)对离子的选择性吸收, 有助于维持离子稳态、增强植株的光合特性、促进植株生长。但目前磁化水处理对镉胁迫下植物光合特性和生长的影响尚鲜见报道。
欧美杨I-107(בNeva’)是杨柳科速生乔木, 在我国东北、华北和长江流域等地区广泛种植, 是速生丰产林建设的重要树种之一, 对重金属有一定的富集作用[15]。但研究发现50 μmol·L-1、100 μmol·L-1镉处理严重影响了欧美杂交杨无性系XMH-4、MH-8、XMH-10的光合速率[16], 并且, 当叶片中镉含量达到3~10 mg·kg-1时, 就会导致生物产量显著下降[17], 这严重限制了该树种的栽培范围。本文通过对欧美杨I-107生长参数、生物量累积、气体交换参数以及叶绿素荧光等指标的测定, 研究外源镉胁迫下磁化水处理对欧美杨I-107生长和光合特性的影响, 以探讨磁化水灌溉在植物修复重金属污染土壤中的应用前景, 同时为重金属污染地区的生态修复提供理论依据。
1 材料与方法
1.1 试验材料
试验于2017年3月在山东农业大学林学实验站(117°08′E, 36°11′N)进行。选取直径为(1.52±0.11) cm、长度为12 cm的1 a生欧美杨I-107插穗为试材, 3月下旬将插穗扦插于装有12.5 kg壤质土(无镉污染)的陶土盆(直径25 cm×高20 cm)中, 每盆扦插两株。前期进行统一栽培管理。待扦插植株生长稳定后, 每盆保留1株生长势一致的植株, 于5月进行外源镉胁迫处理。
1.2 试验设计
外源镉为Cd(NO3)2·4H2O, 设置3个镉浓度梯度灌溉水: 对照(0 μmol·L-1)、低浓度(50 μmol·L-1)、高浓度(100 μmol·L-1), 并分别进行磁化和非磁化处理, 其中磁化处理中所选磁化器型号为U050(长度160 mm, 内径21 mm, 出水量4~6 m3×h-1)。试验共形成6个处理: 磁化+0 μmol·L-1镉灌溉处理(M0)、磁化+ 50 μmol·L-1镉灌溉处理(M50)、磁化+100 μmol·L-1镉灌溉处理(M100)、非磁化+0 μmol·L-1镉灌溉处理(NM0)、非磁化+50 μmol·L-1镉灌溉处理(NM50)、非磁化+100 μmol·L-1灌溉处理(NM100)。随机区组试验设计, 每个处理重复3次, 每5 d饱和灌溉一次, 以确保栽培基质中保持相对恒定的浓度。处理30 d时测定植株的光合色素含量、叶片气体交换参数和叶绿素荧光动力学特征。于9月收获时调查植株生物量和根系特征参数。
1.3 测定分析方法
1.3.1 光合参数测定
试验处理30 d时, 于晴天的上午9:00—11:00, 在不同处理植株上选取并标记3片功能叶用CIRAS-2型便携式光合测定系统(LED外接光源), 测定叶片的净光合速率(n)、细胞间CO2浓度(i)、气孔导度(s)以及蒸腾速率(r), 每个叶片重复3次。根据公式计算水分利用效率: WUE=n/r
1.3.2 叶绿素荧光参数测定
在镉胁迫处理第30 d时, 在不同处理植株上标记3片功能叶, 利用植物效率分析仪(Handy PEA, Hansatech, UK)测定功能叶的PSⅡ原初光能转换效率(v/m)、PSⅡ的潜在活性(v/o)、量子产额(Eo)和光合性能指数(PIabs), 测定前叶片先暗适应30 min, 每个叶片重复3次。
1.3.3 光合色素含量测定
镉胁迫处理30 d采集植株上部功能叶, 洗净擦干, 取0.1 g用95%的乙醇研磨提取, 待叶片组织发白, 采用双光束紫外可见分光光度计(TU-1900)分别测定在663 nm、645 nm、470 nm处的OD值, 计算叶绿素a、叶绿素b、类胡萝卜素和总叶绿素c的含量[18]。
1.3.4 生长参数测定
试验结束时, 调查杨树幼苗的株高和基径; 收获时分别用清水和去离子水冲洗植株的根茎叶, 擦干后分别称其鲜重, 然后将各植株的根、茎、叶在105 ℃下杀青, 30 min后85 ℃下烘至恒重, 称其干重并记录。利用根系分析系统(Win Rhizo ProSTD4800)分析各处理根系平均长度、平均直径、根系表面积等特征。
1.4 数据处理与统计分析方法
运用Microsoft Excel 2013进行数据整理和表格绘制; SPSS 20.0软件对数据进行方差分析, 检查显著性(=0.01, 0.05)。
2 结果与分析
2.1 磁化水处理对镉胁迫下欧美杨光合色素含量的影响
由表1可以看出, 外源镉胁迫对杨树叶片叶绿素a、叶绿素b及类胡萝卜素含量均有抑制作用, 且随着镉浓度的增加抑制作用显著加强(<0.05)。非磁化水处理中, 与NM0相比, 叶绿素a、叶绿素b、类胡萝卜素含量在NM50中分别下降9.60%、12.50%、19.27%, 在NM100中分别下降40.90%、43.24%、46.37%。磁化水处理中, 与M0相比, 叶绿素a、叶绿素b、类胡萝卜素含量在M50中分别下降17.66%、14.08%、17.86%, 在M100中分别下降29.18%、27.35%、31.19%; 与非磁化水处理(NM0、NM50和NM100)相比, 磁化水处理(M0、M50和M100)后叶绿素a含量分别提高16.99%、6.55%和40.20%, 叶绿素b含量分别提高8.67%、6.71%和39.10%, 类胡萝卜素含量分别提高17.32%、19.38%和50.52%, 其中M0与NM0、M100与 NM100差异分别达到显著水平(<0.05), M50与NM50差异则不显著。磁化水处理后欧美杨色素总浓度分别为3.503 mg×g-1、2.950 mg×g-1和2.488 mg×g-1, M0、M100显著高于NM0、NM100(<0.05), M50与NM50差异不显著。
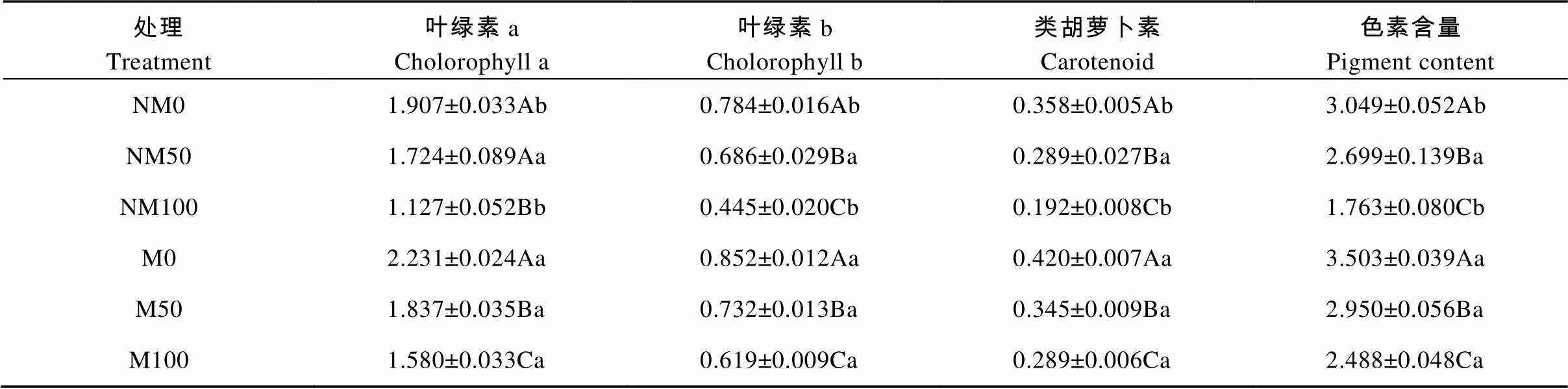
表1 磁化水处理对镉胁迫下欧美杨光合色素含量的影响
NM: 非磁化水处理; M: 磁化水处理; 0、50、100分别表示镉浓度为0 μmol×L-1、50 μmol×L-1、100 μmol×L-1。表中数据为3次测定的平均值±标准误。不同大写字母表示同一磁化水处理不同镉浓度间差异显著(0.05), 不同小写字母表示相同镉浓度不同磁化水处理间差异显著(0.05)。NM: non-magnetic treatment of water; M: magnetic treatment of water. 0, 50 and 100 represent 0 μmol·L-1, 50 μmol·L-1and 100 μmol·L-1cadmium concentrations, respectively. Data in the table are the means ± SE of three replicates. Different capital letters indicate significant differences among cadmium concentrations for the same magnetic treatment of water at 0.05 level. Different lowercase letters indicate significant differences between magnetic treatments of water for the same cadmium concentration at 0.05 level.
2.2 磁化水处理对镉胁迫下欧美杨叶片气体交换参数的影响
通过对叶片气体交换参数的测定分析可知(表2), 在非磁化水处理中, 叶片的净光合速率(n)、蒸腾速率(r)和胞间CO2浓度(i)在NM50和NM100中分别显著下降13.68%和33.68%、8.07%和27.81%、5.00%和14.99%(<0.05), 气孔导度(s)则在NM100中显著降低35.29%(<0.05), 在NM50中差异不显著; 水分利用效率(WUE)在NM50和NM100差异均不显著。在磁化水处理中,r、s、i在M50和M100中均显著降低(<0.05),n、WUE仅在M100中显著下降43.06%、31.96%(<0.05), 在M50中差异均不显著; 但与非磁化水处理相比(NM0、NM50、NM100), 磁化水处理后(M0、M50、M100)n分别提高28.77%、28.90%、10.00%, 其中M50与NM50显著差异(<0.05), 但M0与NM0、M100与NM100差异不显著;s、i、WUE分别显著提高39.40%、11.71%、29.48%, 5.80%、4.52%、6.12%, 68.81%、70.90%、25.41%(<0.05);r则显著降低24.20%、23.33%、12.06%(<0.05)。
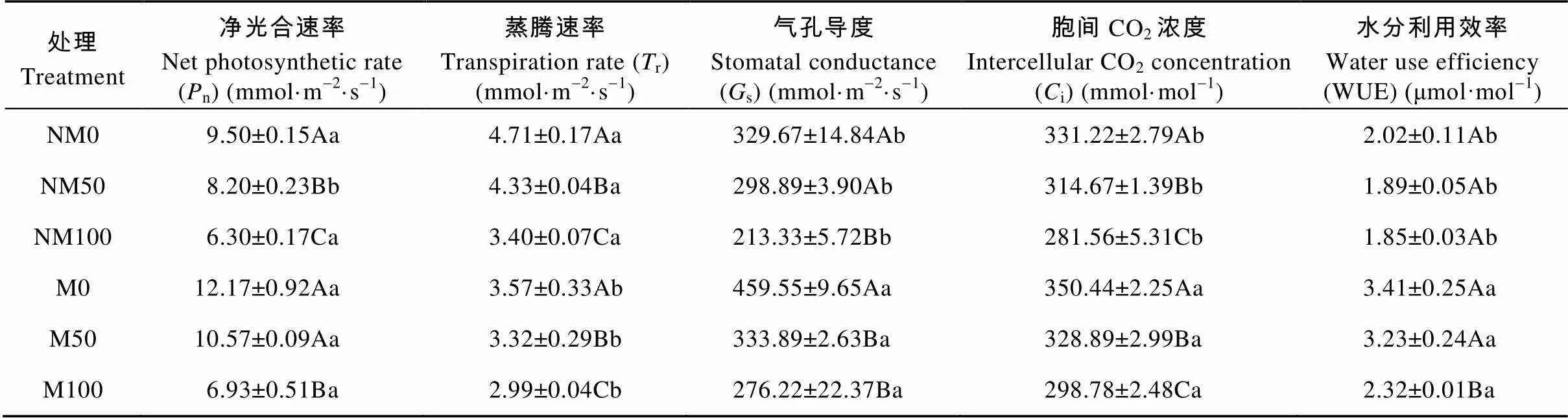
表2 磁化水处理对镉胁迫下欧美杨叶片气体交换参数的影响
NM: 非磁化水处理; M: 磁化水处理; 0、50、100分别表示镉浓度为0 μmol×L-1、50 μmol×L-1、100 μmol×L-1。表中数据为3次测定的平均值±标准误, 不同大写字母表示同一磁化水处理不同镉浓度间差异显著(0.05), 不同小写字母表示相同镉浓度不同磁化水处理间差异显著(0.05)。NM: non-magnetic treatment of water; M: magnetic treatment of water. 0, 50 and 100 represent 0 μmol·L-1, 50 μmol·L-1and 100 μmol·L-1cadmium concentrations, respectively. Data in the table are the means ± SE of three replicates. Different capital letters indicate significant differences among cadmium concentrations for the same magnetic treatment of water at 0.05 level. Different lowercase letters indicate significant differences between magnetic treatments of water for the same cadmium concentration at 0.05 level.
2.3 磁化水处理对镉胁迫下欧美杨叶绿素荧光参数的影响
由表3可知, 镉胁迫条件下, 非磁化水处理中, 最大光化学速率(v/m)及PSⅡ潜在活性(v/o)、量子产额(Eo)在NM50中分别降低0.48%、2.37%、1.14%, 但差异并不显著, 在NM100中则显著降低1.68%、9.04%、5.88%(<0.05); 光化学性能指数(PIabs)在NM50和NM100中显著降低14.11%和27.21%(<0.05)。磁化水处理中, M50和M100处理的v/m、v/o、PIabs分别显著降低0.72%、4.07%、12.20%和0.95%、5.91%、19.14%(<0.05),Eo降低0.92%、1.47%, 但与非磁化水处理(NM0、NM50、NM100)相比, 磁化水处理后(M0、M50、M100)欧美杨叶片vm、vo、PIabs和Eo均有不同程度提高,v/m和F/F分别显著提高0.84%、0.60%、1.59%和5.72%、3.89%、1.59%(0.05); PIabs显著提高18.01%、20.64%、31.09%(0.05);Eo分别提高3.23%、3.45%、8.06%, 但仅在M100与NM100之间差异达到显著水平。
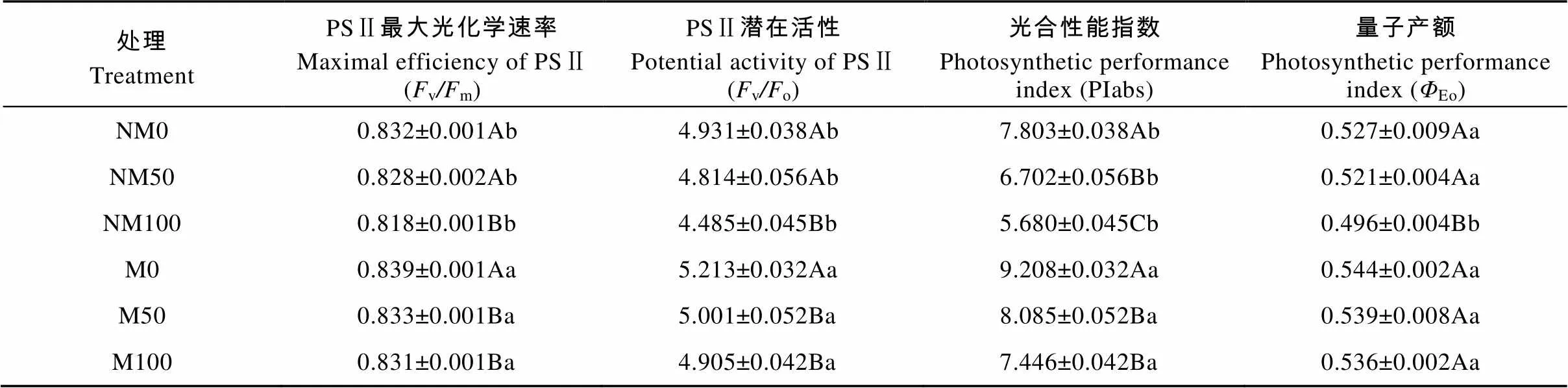
表3 磁化水处理对镉胁迫下欧美杨叶绿素荧光参数的影响
NM: 非磁化水处理; M: 磁化水处理; 0、50、100分别表示镉浓度为0 μmol×L-1、50 μmol×L-1、100 μmol×L-1。表中数据为3次测定的平均值±标准误, 不同大写字母表示同一磁化水处理不同镉浓度间差异显著(0.05), 不同小写字母表示相同镉浓度不同磁化水处理间差异显著(0.05)。NM: non-magnetic treatment of water; M: magnetic treatment of water. 0, 50 and 100 represent 0 μmol·L-1, 50 μmol·L-1and 100 μmol·L-1cadmium concentrations, respectively. Data in the table are the means ± SE of three replicates. Different capital letters indicate significant differences among cadmium concentrations for the same magnetic treatment of water at 0.05 level. Different lowercase letters indicate significant differences between magnetic treatments of water for the same cadmium concentration at 0.05 level.
2.4 磁化水处理对镉胁迫下欧美杨生长参数和生物量的影响
外源镉胁迫条件下(表4), 与NM0相比, NM50、NM100株高显著下降5.81%、6.66%(0.05), 基茎分别下降1.53%、2.30%。与M0相比, M50、M100株高显著下降4.54%、6.47%(0.05), 基茎下降5.77%、6.33%, 但与非磁化水处理(NM0、NM50、NM100)相比, 磁化水处理(M0、M50、M100)后欧美杨株高分别提高1.27%、2.64%、1.47%, 且M0与NM0、M50与NM50差异达显著水平(0.05); 基茎分别提高6.21%、1.64%、1.83%, 但差异不显著。对根、茎、叶生物量分析发现, 非磁化水处理中, NM50和NM100均呈降低趋势, 降幅分别为12.56%、8.10%、13.77%和15.70%、19.73%、23.08%, 且除NM50叶生物量外均达显著水平(0.05)。磁化水处理中, M50和M100根、茎、叶生物量显著下降10.54%、11.15%、8.80%和20.72%、13.28%、15.05%, 与非磁化水处理(NM0、NM50、NM100)相比, 磁化水处理(M0、M50、M100)植株根、茎、叶生物量均有不同程度增加, 其中根和叶生物量分别增加14.07%、16.72%、7.29%和21.77%、28.80%、34.49%, 且M0与NM0、M50与NM50差异显著(0.05); 茎提高比例分别为4.27%、0.81%、12.66%, 但差异不显著。
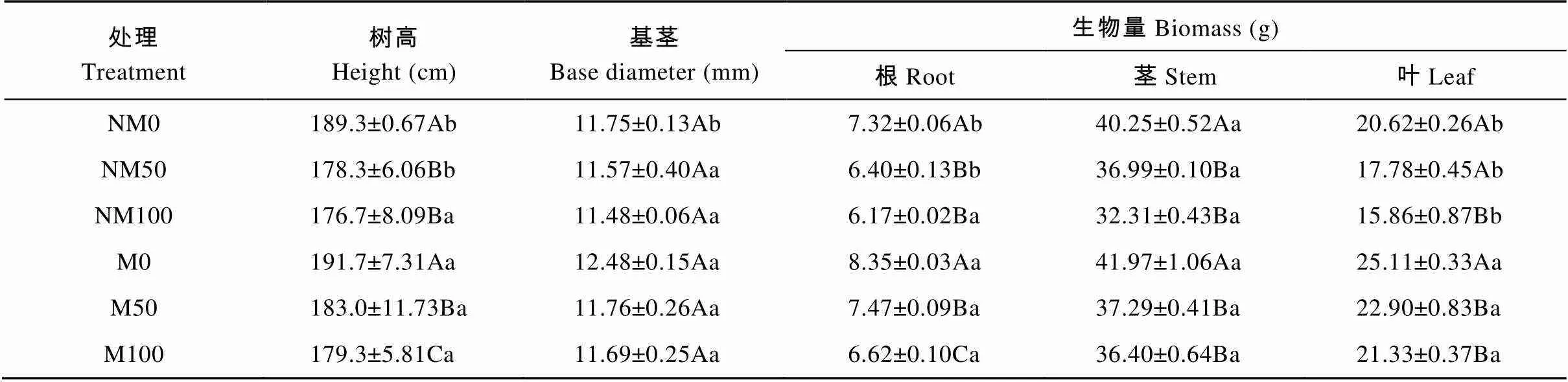
表4 磁化水处理对镉胁迫下欧美杨生长及生物量的影响
NM: 非磁化水处理; M: 磁化水处理; 0、50、100分别表示镉浓度为0 μmol×L-1、50 μmol×L-1、100 μmol×L-1。表中数据为3次测定的平均值±标准误, 不同大写字母表示同一磁化水处理不同镉浓度间差异显著(0.05), 不同小写字母表示相同镉浓度不同磁化水处理间差异显著(0.05)。NM: non-magnetic treatment of water; M: magnetic treatment of water. 0, 50 and 100 represent 0 μmol·L-1, 50 μmol·L-1and 100 μmol·L-1cadmium concentrations, respectively. Data in the table are the means ± SE of three replicates. Different capital letters indicate significant differences among cadmium concentrations for the same magnetic treatment of water at 0.05 level. Different lowercase letters indicate significant differences between magnetic treatments of water for the same cadmium concentration at 0.05 level.
2.5 磁化水处理对镉胁迫下欧美杨根系形态特征的影响
由表5分析可知, 与NM0相比, NM50、NM100中植株根系长度呈下降趋势, 分别降低5.14%、16.73%, 而根系平均直径、表面积和体积则呈先升高后降低的趋势。在磁化水处理中,各根系参数与非磁化水处理表现相同规律。与非磁化水处理(NM0、NM50、NM100)相比, 磁化水处理(M0、M50、M100)植株根系长度分别提高9.40%、8.35%、10.33%, 且M0与NM0、M50与NM50差异均达显著水平(0.05); 根表面积和根体积分别提高54.12%、0.38%、8.56%和49.28%、13.91%、14.06%, 且M0与NM0差异显著(<0.05)。
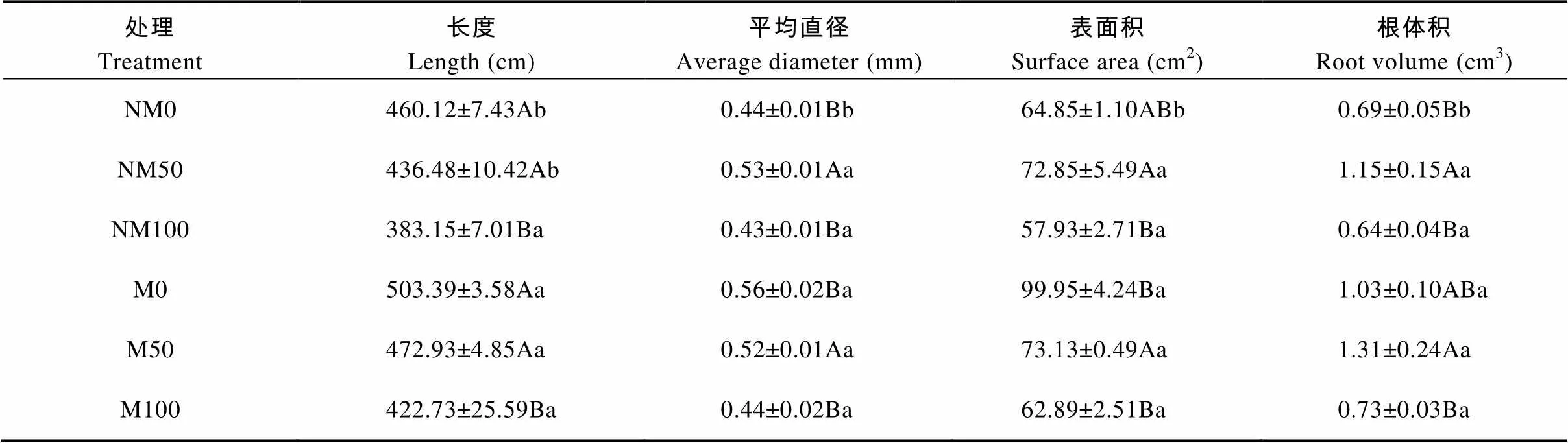
表5 磁化水处理对镉胁迫下欧美杨根系参数的影响
NM: 非磁化水处理; M: 磁化水处理; 0、50、100分别表示镉浓度为0 μmol×L-1、50 μmol×L-1、100 μmol×L-1。表中数据为3次测定的平均值±标准误, 不同大写字母表示同一磁化水处理不同镉浓度间差异显著(0.05), 不同小写字母表示相同镉浓度不同磁化水处理间差异显著(0.05)。NM: non-magnetic treatment of water; M: magnetic treatment of water. 0, 50 and 100 represent 0 μmol·L-1, 50 μmol·L-1and 100 μmol·L-1cadmium concentrations, respectively. Data in the table are the means ± SE of three replicates. Different capital letters indicate significant differences among cadmium concentrations for the same magnetic treatment of water at 0.05 level. Different lowercase letters indicate significant differences between magnetic treatments of water for the same cadmium concentration at 0.05 level.
3 讨论
3.1 磁化作用对镉胁迫下植株光合性能的影响
光合色素是光合作用的基础, 其含量与光合速率呈正相关[19]。本研究发现, 在50 μmol·L-1和100 μmol·L-1镉处理下, 杨树叶片光合色素含量显著降低, 这与万雪琴等[16]发现镉胁迫使欧美杂交杨无性系XMH-4、MH-8、XMH-10总叶绿素含量显著下降的研究结果一致, 说明镉胁迫会抑制叶绿素酸酯还原酶(protochlophyllide reductase)活性, 破坏光合色素的动态平衡[20]。而外源镉胁迫下, 磁化水灌溉明显提高了杨树叶片光合色素的含量, 这与张帆等[21]利用磁化水灌溉提高杨树叶绿素含量研究结果相似, 说明磁化水处理可以通过提高叶绿素含量来增强光合作用以适应外源镉胁迫; 与之不同的是, 本研究磁化水处理大幅提高了镉胁迫下欧美杨叶片中类胡萝卜素含量, 这可能是由于磁化水处理活化或者诱导了合成酶基因的表达, 从而促进类胡萝卜素的合成[22], 镉胁迫下磁化水处理杨树体内较高的类胡萝卜素含量有助于活性氧的猝灭和过剩激发能的消除, 降低镉引起的膜脂过氧化水平, 稳定植株细胞内活性氧平衡[23]。
镉离子进入细胞内会破坏光合系统的电子传递, 抑制电子供体DPC活性, 损伤光合反应中心, 使光合速率下降[24]。本研究发现, 镉胁迫导致叶片的n、s、i下降, 与戴前莉等[25]、贾中民等[26]研究结果一致, 这说明杨树体内过量的镉增加了叶片气孔阻力, 气孔导度和细胞间CO2浓度降低, RuBP(核酮糖-1,5-二磷酸)羧化反应受阻, 导致净光合速率下降[27-28]。同时, 镉胁迫降低了杨树幼苗的vm、vo、PIabs、Eo, 这说明植株对镉的摄入降低了光合反应中心的活性。本研究发现磁化水灌溉处理显著提高了镉胁迫下欧美杨的WUE、s和i, 说明磁化水处理可以通过提高镉胁迫下杨树幼苗的水分利用效率和气孔调节能力来协调CO2供应和水分利用效率的关系, 提高欧美杨光合速率[29], 这与万晓等[30]研究发现高矿化度磁化水灌溉可以提高绒毛白蜡()光合速率的结果一致; 而且磁化水处理能使镉胁迫下杨树幼苗维持较高且稳定的叶绿素荧光参数, 这表明磁化作用在降低镉胁迫对光合机构影响[31]的同时还能提高PSⅡ受体侧电子传递速率, 维持稳定的跨膜质子梯度, 利于偶联ATP形成光合磷酸化同化力, 加之稳定的PSⅡ反应中心活性, 则利于光合碳同化进行[32], 缓解镉离子对植株的毒害。
3.2 磁化水处理对镉胁迫下植株生长发育及生物量积累的影响
镉胁迫会抑制植株生长发育, 生物量的变化是植株对镉胁迫的综合反映。研究发现, 镉胁迫抑制植株高生长、降低生物量累积, 与贾中民等[33]发现镉胁迫显著抑制垂柳(L.)株高增长量的研究结果相似。但是, 磁化水灌溉能够促进镉胁迫下欧美杨地上部分的生长以及干物质量的累积, 减轻镉胁迫对植株的生长抑制, 这可能是因为磁化水处理可以提高抗氧化酶活性, 减轻外源镉胁迫引起的膜脂过氧化, 保持细胞膜的透性[34], 从而减小镉富集对植株生长的影响; 另一方面, 磁场效应可以提高胁迫生境中植株体内养分有效态含量, 改变碳氮磷的分配格局, 促进养分迁移[35], 从而对植株生长发育及生物量累积产生显著影响。其作用机理有待进一步研究。
植株根系是与外界土壤接触最紧密的器官, 最能反映物质吸收能力。研究表明, 镉胁迫会抑制细胞分裂, 影响根系对养分的吸收[36]。在本研究中, 50 μmol·L-1低浓度镉处理刺激根系直径和体积的增大, 而100 μmol·L-1高浓度镉处理则明显抑制欧美杨根系长度及表面积的生长, 而镉胁迫下磁化水灌溉能提高植株的根系长度等各形态参数, 这必然增加根系对养分的吸收, 说明磁化作用可以促进镉胁迫下杨树根系形态的建成, 增加根系对养分的选择性吸收[37], 植株养分含量的增多反过来又会促进根系的生长[38], 使根系表面积及体积明显增大。因此, 磁化水处理镉胁迫植株的根系生长有刺激或改善作用。
4 结论
本研究认为, 镉胁迫导致光合色素含量降低, 杨树光能利用效率下降, 影响光合机构功能和碳同化速率, 抑制植株的生长发育。而磁化水处理可以缓解镉累积对杨树幼苗生长发育的抑制, 增加杨树幼苗中光合色素的含量, 维持较高且稳定的叶绿素荧光参数及PSⅡ反应中心活性, 减轻镉胁迫对光合机构的伤害, 提高光合碳同化速率, 从而有助于植株对光能的吸收利用, 提高植株高生长及根茎叶生物量的累积, 增强杨树对镉的耐受程度。
[1] 周建军, 周桔, 冯仁国. 我国土壤重金属污染现状及治理战略[J]. 中国科学院院刊, 2014, 29(3): 315–320 ZHOU J J, ZHOU J, FENG R G. Status of China’s heavy metal contamination in soil and its remediation strategy[J]. Bulletin of Chinese Academy of Sciences, 2014, 29(3): 315–320
[2] 周垂帆, 李莹, 殷丹阳, 等. 林地重金属污染来源解析[J]. 世界林业研究, 2015, 28(5): 15–21 ZHOU C F, LI Y, YIN D Y, et al. A review on heavy metal contamination on forest land[J]. World Forestry Research, 2015, 28(5): 15–21
[3] 李玉浸. 集约化农业的环境问题与对策[M]. 北京: 中国农业科技出版社, 2001: 57–82 LI Y J. Environmental Issues and Countermeasures for Intensive Agriculture[M]. Beijing: China Agricultural Science and Technology Press, 2001: 57–82
[4] 时萌, 王芙蓉, 王棚涛. 植物响应重金属镉胁迫的耐性机理研究进展[J]. 生命科学, 2016, 28(4): 504–512 SHI M, WANG F R, WANG P T. Research advances in the tolerance mechanism of plant response to heavy metal cadmium stress[J]. Chinese Bulletin of Life Sciences, 2016, 28(4): 504–512
[5] LIU Z L, CHEN W, HE X Y. Influence of Cd2+on growth and chlorophyll fluorescence in a hyperaccumulator:Thunb[J]. Journal of Plant Growth Regulation, 2015, 34(3): 672–676
[6] FILEK M, GZYL-MALCHER B, ZEMBALA M, et al. Effect of selenium on characteristics of rape chloroplasts modified by cadmium[J]. Journal of Plant Physiology, 2010, 167(1): 28–33
[7] DALCORSO G. Heavy metal toxicity in plants[M]//FURINI A. Plants and Heavy Metals. Dordrecht: Springer, 2012: 1–25
[8] 邓培雁, 刘威, 韩博平. 宝山堇菜()镉胁迫下的光合作用[J]. 生态学报, 2007, 27(5): 1858–1862 DENG P Y, LIU W, HAN B P. Photosynthesis ofunder Cd stress[J]. Acta Ecologica Sinica, 2007, 27(5): 1858–1862
[9] 张然然, 张鹏, 都韶婷. 镉毒害下植物氧化胁迫发生及其信号调控机制的研究进展[J]. 应用生态学报, 2016, 27(3): 981–992 ZHANG R R, ZHANG P, DU S T. Oxidative stress-related signals and their regulation under Cd stress: A review[J]. Chinese Journal of Applied Ecology, 2016, 27(3): 981–992
[10] 高宇, 程潜, 张梦君, 等. 镉污染土壤修复技术研究[J]. 生物技术通报, 2017, 33(10): 103–110 GAO Y, CHENG Q, ZHANG M J, et al. Research advance on remediation technology of cadmium contaminated soil[J]. Biotechnology Bulletin, 2017, 33(10): 103–110
[11] 王洪波, 王成福, 吴旭, 等. 磁化水滴灌对土壤盐分及玉米产量品质的影响[J]. 土壤, 2018, 50(4): 762–768 WANG H B, WANG F C, WU X, et al. Effects of drip irrigation with different magnetic water on soil salinity, maize yield and quality[J]. Soils, 2018, 50(4): 762–768
[12] GREWAL H S, MAHESHWARI B L. Magnetic treatment of irrigation water and snow pea and chickpea seeds enhances early growth and nutrient contents of seedlings[J]. Bioelectromagnetics, 2011, 32(1): 58–65
[13] HOZAYN M, QADOS A M S A. Magnetic water application for improving wheat (L.) crop production[J]. Agriculture and Biology Journal North America, 2010, 1(4): 677–682
[14] 刘秀梅, 郭建曜, 朱红, 等. 磁化微咸水灌溉对欧美杨I-107离子稳态的影响[J]. 应用生态学报, 2016, 27(8): 2438–2444
LIU X M, GUO J Y, ZHU H, et al. Ionic homeostasis of‘Neva’influenced by irrigation with magnetized brackish water[J]. Chinese Journal of Applied Ecology, 2016, 27(8): 2438–2444
[15] 李金花, 何燕, 段建平, 等. 107杨对土壤重金属的吸收和富集[J]. 林业科学研究, 2012, 25(1): 65–70 LI J H, HE Y, DUAN J P, et al. Absorption and accumulation of heavy metal from soil by leaves ofcv. ‘Neva’ plantation[J]. Forest Research, 2012, 25(1): 65–70
[16] 万雪琴, 张帆, 夏新莉, 等. 镉处理对杨树光合作用及叶绿素荧光参数的影响[J]. 林业科学, 2008, 44(6): 73–78 WAN X Q, ZHANG F, XIA X L, et al. Effects of cadmium on photosynthesis and chlorophyll fluorescence parameters of solution-cultured poplar plants[J]. Scientia Silvae Sinicae, 2008, 44(6): 73–78
[17] ABDEL-LATIF A. Cadmium induced changes in pigment content, ion uptake, proline content and phosphoenolpyruvate carboxylase activity inseedlings[J]. Australian Journal of Basic and Applied Sciences, 2008, 2(1): 57–62
[18] 孔祥生, 易现峰. 植物生理学实验技术[M]. 北京: 中国农业出版社, 2008: 77–79 KONG X S, YI X F. Experimental Technique of Plant Physiology[M]. Beijing: China Agriculture Press, 2008: 77–79
[19] SAIRAM R K, SRIVASTAVA G C. Changes in antioxidant activity in sub-cellular fractions of tolerant and susceptible wheat genotypes in response to long term salt stress[J]. Plant Science, 2002, 162(6): 897–904
[20] 薛永, 王苑螈, 姚泉洪, 等. 植物对土壤重金属镉抗性的研究进展[J]. 生态环境学报, 2014, 23(3): 528–534 XUE Y, WANG Y Y, YAO Q H, et al. Research progress of plants resistance to heavy metal Cd in soil[J]. Ecology and Environmental Sciences, 2014, 23(3): 528–534
[21] 张帆, 万雪琴, 王长亮, 等. 镉胁迫下增施氮对杨树生长和光合特性的影响[J]. 四川农业大学学报, 2011, 29(3): 317–321 ZHANG F, WAN X Q, WANG C L, et al. Effects of nitrogen supplement on photosynthetic characteristic and growth rate of poplar plants under cadmium stress[J]. Journal of Sichuan Agricultural University, 2011, 29(3): 317–321
[22] 何士敏, 李盛贤, 王鑫. 磁化水对甜菜种子萌发期和幼苗期体内几种酶活性的影响[J]. 中国甜菜糖业, 2000, (2): 5–7 HE S M, LI S X, WANG X. The affection of magnetic water to beet seeds enzymatic activities in germination and seedling stage[J]. China Beet & Sugar, 2000, (2): 5–7
[23] SAKAKI T, KONDO N, SUGAHARA K. Breakdown of photosynthetic pigments and lipids in spinach leaves with ozone fumigation: Role of active oxygens[J]. Physiologia Plantarum, 1983, 59(1): 28–34
[24] 段晨雪, 张宝玉, 伍松翠, 等. 重金属镉对斜生栅藻光合作用的影响[J]. 海洋与湖沼, 2015, 46(2): 351–356 DUAN C X, ZHANG B Y, WU S C, et al. Effect of cadmium on photosynthesis of[J]. Oceanologia et Limnologia Sinica, 2015, 46(2): 351–356
[25] 戴前莉, 李金花, 胡建军, 等. 增施铁对镉胁迫下柳树生长及光合生理性能的改善[J]. 南京林业大学学报: 自然科学版, 2017, 41(2): 63–72 DAI Q L, LI J H, HU J J, et al. Improvement on growth and photosynthetic physiological performance of three willow clones or cultivar under Cd treatments and supplying Fe[J]. Journal of Nanjing Forestry University: Natural Sciences Edition, 2017, 41(2): 63–72
[26] 贾中民, 冯汉茹, 魏虹. 镉对枫杨幼苗生长和光合特性的影响[J]. 西南大学学报: 自然科学版, 2014, 36(8): 27–35
JIA Z M, FENG H R, WEI H. Effects of cadmium on the growth and photosynthetic characteristics ofseedlings[J]. Journal of Southwest University: Natural Science Edition, 2014, 36(8): 27–35
[27] MOBIN M, KHAN N A. Photosynthetic activity, pigment composition and antioxidative response of two mustard () cultivars differing in photosynthetic capacity subjected to cadmium stress[J]. Journal of Plant Physiology, 2007, 164(5): 601–610
[28] VECCHIA F D, LA ROCCA N, MORO I, et al. Morphogenetic, ultrastructural and physiological damages suffered by submerged leaves ofexposed to cadmium[J]. Plant Science, 2005, 168(2): 329–338
[29] 王文明, 姜益娟, 郑德明, 等. 磁化水滴灌对枣树光合作用与蒸腾作用的影响[J]. 新疆农业科学, 2010, 47(12): 2421–2425 WANG W M, JIANG Y J, ZHENG D M, et al. Influence of magnetization water irrigation on photosynthesis and transpiration of jujube tree[J]. Xinjiang Agricultural Sciences, 2010, 47(12): 2421–2425
[30] 万晓, 刘秀梅, 王华田, 等. 高矿化度灌溉水磁化处理对绒毛白蜡生理特性及生长的影响[J]. 林业科学, 2016, 52(2): 120–126 WAN X, LIU X P, WANG H T, et al. Effect of magnetic treatment of salty irrigation water on physiological and growth characteristics of pottedseedlings[J]. Scientia Silvae Sinicae, 2016, 52(2): 120–126
[31] APPENROTH K J, STÖCKEL J, SRIVASTAVA A, et al. Multiple effects of chromate on the photosynthetic apparatus ofas probed by OJIP chlorophyll a fluorescence measurements[J]. Environmental Pollution, 2001, 115(1): 49–64
[32] 李鹏民, 高辉远, STRASSER R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J]. 植物生理与分子生物学学报, 2005, 31(6): 559–566 LI P M, GAO H Y, STRASSER R J. Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study[J]. Journal of Plant Physiology and Molecular Biology, 2005, 31(6): 559–566
[33] 贾中民, 王力, 魏虹, 等. 垂柳和旱柳对镉的积累及生长光合响应比较分析[J]. 林业科学, 2013, 49(11): 51–59 JIA Z M, WANG L, WEI H, et al. Comparative analysis ofandfor their cadmium accumulation, growth and photosynthesis in response to cadmium contamination[J]. Scientia Silvae Sinicae, 2013, 49(11): 51–59
[34] 刘璇, 张婷婷, 黄馨瑶, 等. 磁化水对玉米耐受重金属镉的影响[J]. 厦门大学学报: 自然科学版, 2008, 47(S2): 278–281 LIU X, ZHANG T T, HUANG X Y, et al. Magnetic water improve the tolerance of corn to Cd ion[J]. Journal of Xiamen University: Natural Science, 2008, 47(S2): 278–281
[35] 刘秀梅, 毕思圣, 张新宇, 等. 磁化微咸水灌溉对欧美杨I-107微量元素和碳氮磷养分特征的影响[J]. 生态学报, 2017, 37(20): 6691–6699 LIU X M, BI S S, ZHANG X Y, et al. Effects of magnetized brackish water on the absorption and distribution of microelements, carbon, nitrogen and phosphorus in‘Neva’[J]. Acta Ecologica Sinica, 2017, 37(20): 6691–6699
[36] LING T, JUN R, FANGKE Y. Effect of cadmium supply levels to cadmium accumulation by[J]. International Journal of Environmental Science & Technology, 2011, 8(3): 493–500
[37] 张佳, 李海平, 李灵芝, 等. 磁化水灌溉对番茄生长及生理特性的影响[J]. 农业工程, 2018, 8(1): 108–112 ZHANG J, LI H P, LI L Z, et al. Effects of magnetized water irrigation on growth and physiological characteristics of tomato[J]. Agricultural Engineering, 2018, 8(1): 108–112
[38] 张新宇, 董玉峰, 刘佩迎, 等. 磁化处理对绒毛白蜡嫩枝扦插生根的影响[J]. 浙江农林学学报, 2017, 34(5): 949–954ZHANG X Y, DONG Y F, LIU P Y, et al. Magnetic treatment on rootings of semi lignified twigs of[J]. Journal of Zhejiang A&F University, 2017, 34(5): 949–954
Effect of magnetized water treatment on photosynthetic and growth characteristics of´‘Neva’ seedlingsunder exogenous cadmium stress*
ZHANG Ying1,2, LIU Xiumei1,2, ZHANG Zhihao1,2, MENG Shiyuan1,2, WANG Qian1,2, WEI Ye1,2, WANG Huatian1,2**, CHEN Shuying3, CONG Guizhi3, TANG Jin3, QIN Deming3
(1. College of Forestry, Shandong Agricultural University, Tai’an 271018, China; 2. Key Laboratory of State Forestry Administration for Silviculture in Lower Yellow River, Tai’an 271018, China; 3. Yili Academy of Forestry, Yining 835000, China)
In order to investigate the effect of magnetized water irrigation on plant growth and tolerance to heavy metals, a randomized block experiment was designed to explore the photosynthetic characteristics, chlorophyll fluorescence kinetic parameters and growth characteristics of 1-year-oldבNeva’ under three cadmium concentrations (0 μmol·L-1, 50 μmol·L-1, 100 μmol·L-1) of magnetized water solution. The results showed that: 1) plant height, stem growth and dry matter weights of roots,leaves and stems significantly dropped under cadmium stress. While root diameter and volume were enhanced under low cadmium concentration (50 μmol·L-1,< 0.05), root morphology parameters were inhibited under high concentration (100 μmol·L-1). Compared with 0 μmol·L-1cadmium treatment, chlorophyll b and carotenoid contents decreased respectively by 12.50% and 19.27% under 50 μmol·L-1cadmium treatment, and 43.24% and 46.37% under 100 μmol·L-1cadmium treatment (< 0.05). Net photosynthetic rate (n), transpiration rate (r) and intercellular carbon dioxide concentration (i) respectively decreased by 13.68%, 8.07% and 5.00% under 50 μmol·L-1cadmium treatment, and by 33.68%, 27.81% and 14.99% (< 0.05) under 100 μmol·L-1cadmium treatment. PSⅡ potential activity (vm), maximum photo-chemical rate (vo), photosynthetic performance index (PIabs) and quantum yield (Eo) also dropped to varying degrees.2) Compared with non-magnetic water treatment, magnetic water treatment enhanced the growth of plants under cadmium stress in terms of height and stem, increased dry weight of roots and leaves and also root length and surface area of the plant. The contents of chlorophyll a increased by 16.99%, 6.55% and 4.02%, and carotenoid content increased by 17.32%, 19.38% and 50.52% (< 0.05), respectively, under 0, 50 and 100 μmol·L-1cadmium treatments. Whilen,s,iand WUE increased, the differences were not significant. However,rreduced respectively by 24.20%, 23.33% and 12.06% (< 0.05). In addition,vm,voandEoremained stable whereas PIabs increased respectively by 8.01%, 20.63% and 31.09% (< 0.05). In summary, magnetic treatment of water increased the contents of photosynthetic pigments, maintained the function of photosynthetic apparatus, heightened the rate of photosynthetic carbon assimilation and subsequently relieved the inhibition of plant growth by cadmium stress.
Cadmium stress; Magnetic treatment of water;´‘Neva’; Photosynthesis; Plant growth
, E-mail: wanght@sdau.edu.cn
Jun. 28, 2018;
Sep. 17, 2018
X53; S792.11
A
2096-6237(2019)02-0305-09
10.13930/j.cnki.cjea.180602
* 山东省农业重大应用技术创新项目[鲁财农指(2016)36号]和新疆维吾尔自治区高层次人才引进工程-柔性人才项目资助
王华田, 主要研究方向为森林培育和森林生理生态。E-mail: wanght@sdau.edu.cn
张瑛, 主要研究方向为森林培育。E-mail: cherrycedar@163.com
2018-06-28
2018-09-17
* This work was supported by the Agriculture Major Application Technology Innovation Program of Shandong Province [Financial and Agriculture Indicator (2016) No. 36] and the Introduction Project of High-level Talents in Xinjiang Uygur Autonomous Region.
张瑛, 刘秀梅, 张志浩, 孟诗原, 王倩, 韦业, 王华田, 陈淑英, 丛桂芝, 唐金, 秦德明. 磁化水处理对镉胁迫下欧美杨幼苗光合及生长特性的影响[J]. 中国生态农业学报(中英文), 2019, 27(2): 305-313
ZHANG Y, LIU X M, ZHANG Z H, MENG S Y, WANG Q, WEI Y, WANG H T, CHEN S Y, CONG G Z, TANG J, QIN D M.Effect of magnetized water treatment on photosynthetic and growth characteristics of´‘Neva’ seedlings under exogenous cadmium stress[J]. Chinese Journal of Eco-Agriculture, 2019, 27(2): 305-313

