香蕉-甘蔗轮作模式防控香蕉枯萎病的持续效果与土壤微生态机理(Ⅰ)*
曾莉莎, 林威鹏, 吕 顺, 王 芳, 夏 玲, 刘文清, 伍朝荣, 周建坤, 杜彩娴, 蔡昆争, 刘建平
香蕉-甘蔗轮作模式防控香蕉枯萎病的持续效果与土壤微生态机理(Ⅰ)*
曾莉莎1†, 林威鹏1,2,3†, 吕 顺1**, 王 芳1, 夏 玲1, 刘文清1, 伍朝荣2, 周建坤1, 杜彩娴1, 蔡昆争2, 刘建平1
(1. 东莞市香蕉蔬菜研究所 东莞 523061; 2. 华南农业大学资源环境学院 广州 510642; 3. 广东省农业科学院茶叶研究所 广州 510642)
近年来, 珠三角部分蕉农采用香蕉和甘蔗轮作防控香蕉枯萎病, 并取得一定成效, 我国古籍《广东新语》也有香蕉-甘蔗轮作的记载, 但是关于该轮作模式的作用、效果及控病机理尚不明确。本文研究了连作香蕉地轮作不同年限甘蔗对香蕉枯萎病的控制作用, 并从土壤微生态角度探讨其作用机理。试验设置4个处理: 连作香蕉11年(CK)、香蕉连作地—甘蔗1年—香蕉1年(GZ1)、香蕉连作地—甘蔗2年—香蕉1年(GZ2)和香蕉连作地—甘蔗3年—香蕉1年(GZ3)。研究轮作甘蔗不同年限对后茬香蕉枯萎病发病率的影响, 同时通过测定土壤可培养微生物数量, 并利用高通量测序技术分析土壤微生物结构, 揭示轮作甘蔗影响后茬香蕉枯萎病发生的土壤微生态机制。结果表明, 连作蕉地香蕉枯萎病发病率为49.15%, 而轮作甘蔗1年后茬香蕉枯萎病发病率降至17.86%, 轮作2年和3年甘蔗后茬香蕉枯萎病发病率仅为1.79%。土壤可培养细菌总数随着轮作甘蔗年限的增加而显著增加, 可培养放线菌总数和尖孢镰刀菌则呈逐渐减少的趋势, 真菌总数无显著变化。土壤细菌多样性指数随轮作甘蔗年限的增加而降低。假单胞菌目(Pseudomonadales)、浮霉菌目(Planctomycetales)、酸微菌目(Acidimicrobiales)和土壤红杆菌目(Solirubrobacterales)的细菌丰度呈随甘蔗种植年限增加而逐年增加的趋势, 并与香蕉枯萎病发病率呈显著负相关关系。酸杆菌目(Acidobacteriales)、红螺菌目(Rhodospirillales)和军团菌目(Legionellales)的细菌丰度则呈随甘蔗种植年限逐年降低趋势, 并与香蕉枯萎病发病率呈显著正相关。连作香蕉地轮作甘蔗, 能够显著降低后茬香蕉枯萎病的发病率, 并且随着甘蔗轮作时间年限的增加, 发病率逐年降低。轮作甘蔗通过改变土壤微生物群落结构而间接影响尖孢镰刀菌的生存环境, 从而降低香蕉枯萎病发病率, 轮作2年甘蔗, 即可达到显著控病效果。此结果与《广东新语》中关于香蕉-甘蔗轮作年限的记载一致。
香蕉连作; 香蕉-甘蔗轮作; 香蕉枯萎病; 尖孢镰刀菌; 土壤微生物
香蕉枯萎病是由尖孢镰刀菌古巴专化型[f. sp.(FOC)]侵染所引起的维管束类疾病, 是危害世界香蕉(spp.)种植的严重病害。该病害传播途径广泛, 可通过水、土壤、种苗等介质传播, 香蕉枯萎病疫情所到之处, 蕉园尽毁, 造成巨大经济损失。由于气候条件的限制, 我国可种植香蕉的耕地面积原本就小, 若再不采取有效的防治措施, 我国香蕉产业将面临严峻危机。在面临枯萎病危害的同时, 我国的香蕉存在超长时间连作的问题, 部分蕉地连作时间长达20年, 造成土壤微生物环境的失衡与恶化, 主要体现在有益微生物的种类和数量减少、有害生物增多等连作障碍, 最终导致香蕉生长缓慢, 生育期延长, 产量降低。轮作、间作等种植模式是我国传统农业的精华, 对持续控制枯萎病等土传病害和克服连作障碍有显著的作用。大量试验证明, 轮作可以协调不同作物之间养分吸收的局限性, 增加土壤中养分的有效性[1-2], 改善根围微生物群落结构[3-4], 减少土传病虫害的发生[5-6]。目前, 部分学者开展了轮作对缓解香蕉枯萎病的研究。香蕉与水稻()[7]、木薯()[8]、玉米()[5]、菠萝()[5]、韭菜()[9]轮作, 均能不同程度降低后茬香蕉枯萎病发病率, 其中尤以韭菜轮作效果最佳, 后茬发病率仅为2%, 而其他轮作模式后茬香蕉枯萎病的发病率介于20%~40%。以上模式除了韭菜-香蕉模式效果最好, 其他模式效果一般, 但是, 韭菜市场需求量较小, 栽培模式与香蕉差异大, 香蕉与韭菜轮作模式难以满足香蕉连片大规模生产, 阻碍其大面积推广。我们在清代屈大均所著文献《广东新语》草语篇中(成书于康熙17年左右)找到有关香蕉与甘蔗()轮作的记载[10]。“增城之西洲, 人多种蕉, 种至三四年, 即尽伐以种白蔗。白蔗得种蕉地, 益繁盛甜美, 而白蔗种至二年, 又复种蕉”。文中记载的香蕉与甘蔗轮作模式, 为种植香蕉3~4年后再轮作甘蔗2年再复种香蕉, 周而复始。但是文中并没有描述该模式在病害防控方面的作用。甘蔗是中国九大优势作物之一, 也是华南地区大面积种植的农作物之一, 种植技术简单, 种植效益好。近年, 珠三角地区部分农户采用香蕉和甘蔗轮作来防控香蕉枯萎病取得了一定的成效, 但是香蕉甘蔗轮作技术及控制病害的原理并不明确。我们企图再现古人的模式, 研究香蕉-甘蔗轮作对香蕉生长及枯萎病的控制效果, 并通过测定土壤可培养微生物, 以及利用高通量测序技术研究轮作甘蔗后土壤微生物群落结构的变化, 探明香蕉-甘蔗轮作模式影响后茬香蕉枯萎病发病率的可能机制。从古文献中寻找古代农业文化遗产的精华, 并将其应用于现代农业, 可为建立合理的香蕉轮作体系提供科学的理论依据。
1 材料与方法
1.1 试验设计
试验地位于广东省东莞市沙田镇中围村, 地处东莞市西南部和珠江三角洲的几何中心地带, 光照充足, 热量丰富, 气候温暖, 温度变幅小, 雨量充沛。多年平均降水量为1 802.5 mm, 年平均气温22.2 ℃, 年日照时数1 959.5 h。试验开始于2003年, 试验田块为同一农户耕种、平坦的同一幅多年连作的香蕉地, 该田块2003年个别植株出现香蕉枯萎病, 至2007年枯萎病发病率达80%以上, 2008年开始改种中抗病品种‘农科1号’香蕉, 当年‘农科1号’枯萎病发病率达30%以上。供试土壤为轻黏壤土, 土层深厚、土质疏松、有机质丰富。起始时土壤耕层含有机质12.30 g∙kg-1、全氮164.9 mg∙kg-1、碱解氮29.1 mg∙kg-1、有效磷213.0 mg∙kg-1、速效钾256 mg∙kg-1, pH=5.2。
试验设4个处理: 连作香蕉11年(CK)、香蕉连作地—甘蔗1年—香蕉1年(GZ1)、香蕉连作地—甘蔗2年—香蕉1年(GZ2)、香蕉连作地—甘蔗3年—香蕉1年(GZ3)。轮作甘蔗不同年限后(2013年10月14日)统一采集土壤样本, 用于可培养微生物及土壤微生物群落的测定; 轮作甘蔗后回种香蕉第1年调查香蕉的长势、产量及枯萎病发病率。每个处理3个重复, 随机区组排列, 每个处理小区长50 m, 宽5.0 m, 面积250 m2, 小区之间由畦沟分隔开。
种植的香蕉品种为‘农科1号’, 采用高畦深沟、双行种植的栽培方式。每公顷种植1 650株, 行距为2.60 m, 株距为2.40 m; 畦面宽4.5 m, 畦间沟宽0.5 m、深0.7 m。每年4月定植香蕉二级苗, 翌年3月收获, 采用常规方法进行种植管理。种植的甘蔗品种为‘广东黄皮果蔗’, 每米植蔗沟约种12个芽, 有效茎约75 000条∙hm-2。种茎以品字形或双轨窄幅排放, 两行种茎之间距离10 cm左右, 种茎与土壤紧贴, 芽排向两侧。种前施足基肥, 采用常规方法进行种植管理, 每年2—3月种植, 当年11月开始采收。
1.2 土壤样品的采集
定位试验11年, 统一于2013年10月14日(此时大部分蕉株处于孕蕾期), 在香蕉及甘蔗地采集土壤样品。于试验地每个小区内采用5点取样法取样, 去掉0~5 cm的表土, 采距植株30~40 cm的根围土壤, 深约20 cm, 每个处理采集3个重复小区共15个土壤样品, 将所采每个处理的土样混匀后分成 2份, 一份于-20 ℃冷冻保存用于土壤DNA提取, 一份用于测定土壤中可培养微生物数量。
1.3 测定指标与方法
1.3.1 发病率及相对防效
于香蕉收获期调查不同处理香蕉枯萎病的发病率, 及对照连作香蕉地(CK处理)枯萎病的发病率, 计算相对防效。
枯萎病发病率(%)=发病植株数×100/供试植株总数 (1)
相对防效(%)=(对照的发病率-处理的发病率)×100/对照的发病率 (2)
1.3.2 植株性状
2014年11月3日, 香蕉抽蕾期调查香蕉株高、茎粗、叶面积、单株产量等性状, 测定株高、茎粗、叶片长度与宽度。叶面积采用估测法测量, 单叶面积估测公式为:
=0.8××(3)
式中:为叶片面积,为叶长,为叶宽。单株产量用果穗质量表示, 将果轴两端沿果梳基部截平, 称取整穗果的质量。
1.3.3 可培养微生物
土壤微生物的测定参照林先贵[11]方法, 用平板培养法测定土壤中的微生物数量。细菌测定用牛肉汁蛋白胨琼脂, 真菌用马丁氏琼脂, 放线菌用高氏1号琼脂, 尖孢镰刀菌采用Komada改良培养基[12-13]。
1.4 土壤细菌群落结构的检测方法及测序流程
1.4.1 土壤DNA的提取
称取0.5 g新鲜根围土, 使用FastDNA SPIN土壤DNA提取试剂盒(MP Biomedical, USA), 按照说明进行提取。使用微量分光光度计(Nanodrop 1000, Thermo Scientific, USA)测定DNA浓度, 并用超纯水稀释至10 ng∙μL-1待用。
1.4.2 基因扩增与纯化
选用引物27F(5¢-AGAGTTTGATCCTGGCTCAG-3¢)和533R(5¢-TTACCGCGGCTGCT-GGCAC-3¢)[14]对原核生物16s片段的V1-V3片区进行扩增。用2%琼脂糖对PCR产物进行电泳检测, 使用AMPure Beads胶回收试剂盒对PCR产物进行回收, 建库, 质检合格的文库用Roche 454 FLX+系统进行测序。
1.4.3 结果分析
对测序得到的原始数据进行拼接、过滤, 得到有效序列和优质序列。基于优质序列进行OTUs(operational taxonomic units)聚类和物种分类分析, 并将OTUs和物种注释结合, 从而得到每个样品的OTUs和分类谱系的基本分析结果。再对OTUs进行丰度、多样性指数等分析, 同时对物种注释在各个分类水平上进行群落结构的统计分析。由上海派森诺生物科技有限公司完成测序及初步分析, 由广州基迪奥生物科技有限公司完成进一步分析。
1.5 数据分析
采用Microsoft Excel 2016进行数据的整理, 使用SPSS 21.0进行数据的统计分析, 统计前对数据进行正态性检验和组件方差齐性检验, 如果无法满足以上两个条件, 则对数据进行log10转化, 然后对数据进行方差分析(one-way ANOVA), 采用最小显著极差法(LSD法)进行数据的多重比较。
2 结果与分析
2.1 蕉地轮作不同年限甘蔗对后茬香蕉枯萎病发病率的影响
轮作甘蔗1、2、3年后, 重新种植‘农科1号’香蕉品种, 各处理香蕉枯萎病发病率如图1所示。GZ1(17.86%)、GZ2(1.79%)及GZ3(1.79%)处理与CK(49.15%)相比发病率差异均达显著水平, 其中, GZ1与其他处理的枯萎病发病率差异显著, GZ2处理与GZ3处理差异不显著。GZ1处理相比于CK, 相对防效达63.66%; GZ2及GZ3处理防控率一致, 相对防效大于95%, 表明香蕉轮作甘蔗2年后回种香蕉, 即可使香蕉枯萎病发病率明显降低。
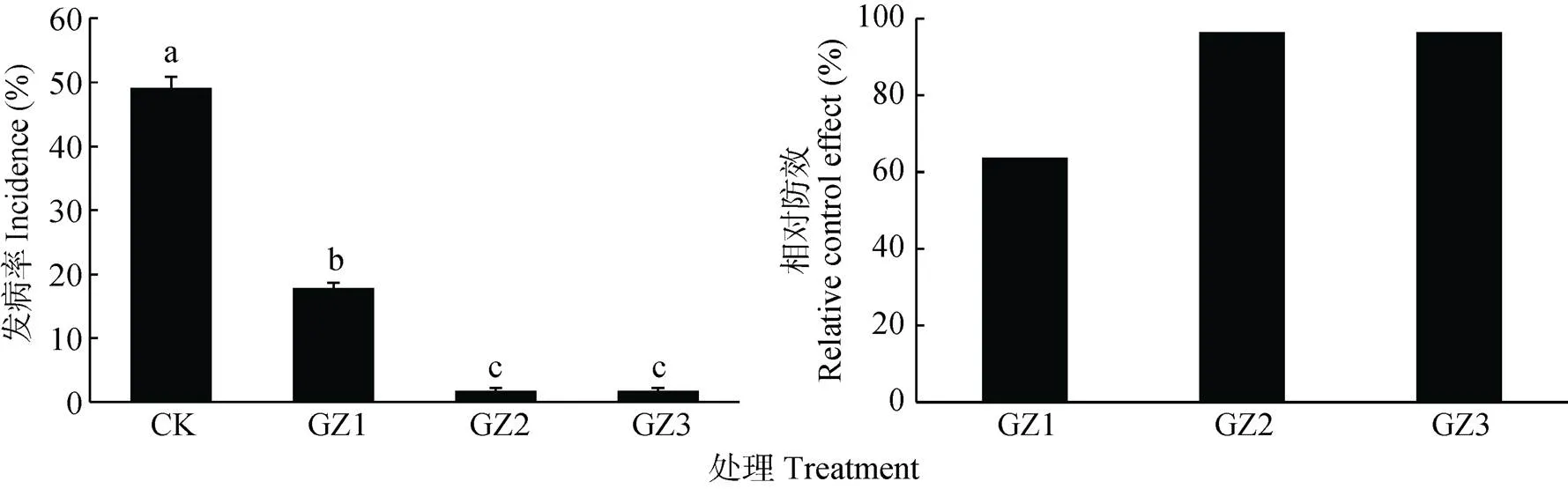
图1 与甘蔗轮作不同年限后香蕉田香蕉枯萎病发病率与相对防效
CK: 连作香蕉11年; GZ1: 香蕉连作地—甘蔗1年—香蕉1年; GZ2: 香蕉连作地—甘蔗2年—香蕉1年; GZ3: 香蕉连作地—甘蔗3年—香蕉1年。不同小写字母表示处理间差异显著(<0.05)。CK: continuous cropping bananas for 11 years; GZ1: bananas monocropping – 1 year of sugarcane rotation – 1 year of banana replanting; GZ2: bananas monocropping – 2 years of sugarcane rotation – 1 year of banana replanting; GZ3: bananas monocropping – 3 years of sugarcane rotation – 1 year of banana replanting. Different lowercase letters indicate significant differences among treatments at 0.05 level.
2.2 蕉地轮作不同年限甘蔗对后茬香蕉生长的影响
轮作甘蔗后茬香蕉生长旺盛, 香蕉株高、茎粗及叶面积随着与甘蔗轮作年限的增加而提高, 其中后茬香蕉叶面积显著高于连作香蕉(CK)(表1); 在香蕉采收时, 对不同处理的地块进行测产, 结果表明: 香蕉与甘蔗轮作后的蕉地, 相对于连作蕉地(CK), 香蕉的平均单株产量提高18.9%~35.1%, 表明轮作甘蔗后对下茬香蕉的长势和产量具有明显的促进作用, 并且以轮作2年以上更为明显。
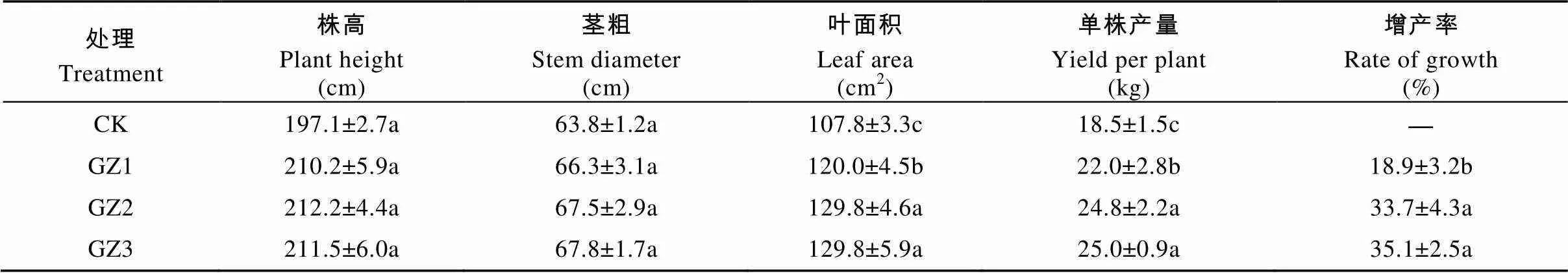
表1 与甘蔗轮作不同年限后香蕉的长势及产量
CK: 连作香蕉11年; GZ1: 香蕉连作地—甘蔗1年—香蕉1年; GZ2: 香蕉连作地—甘蔗2年—香蕉1年; GZ3: 香蕉连作地—甘蔗3年—香蕉1年。不同小写字母表示处理间差异显著(<0.05)。CK: continuous cropping bananas for 11 years; GZ1: bananas monocropping – 1 year of sugarcane rotation – 1 year of banana replanting; GZ2: bananas monocropping – 2 years of sugarcane rotation – 1 year of banana replanting; GZ3: bananas monocropping – 3 years of sugarcane rotation – 1 year of banana replanting. Different lowercase letters indicate significant differences among treatments at 0.05 level.
2.3 蕉地轮作不同年限甘蔗对土壤可培养微生物的影响
连作香蕉地轮作不同年限甘蔗, 土壤可培养微生物变化情况如图2所示。结果表明: 随着甘蔗轮作年数增加, 土壤细菌数量逐年增加, 放线菌和尖孢镰刀菌数量逐渐减少, 真菌数量无显著变化。其中土壤细菌和放线菌的数量轮作甘蔗2年后才达到显著变化; 土壤尖孢镰刀菌的数量变化对轮作甘蔗反应较敏感, 轮作1年即明显降低, 但轮作2年后不再明显降低。
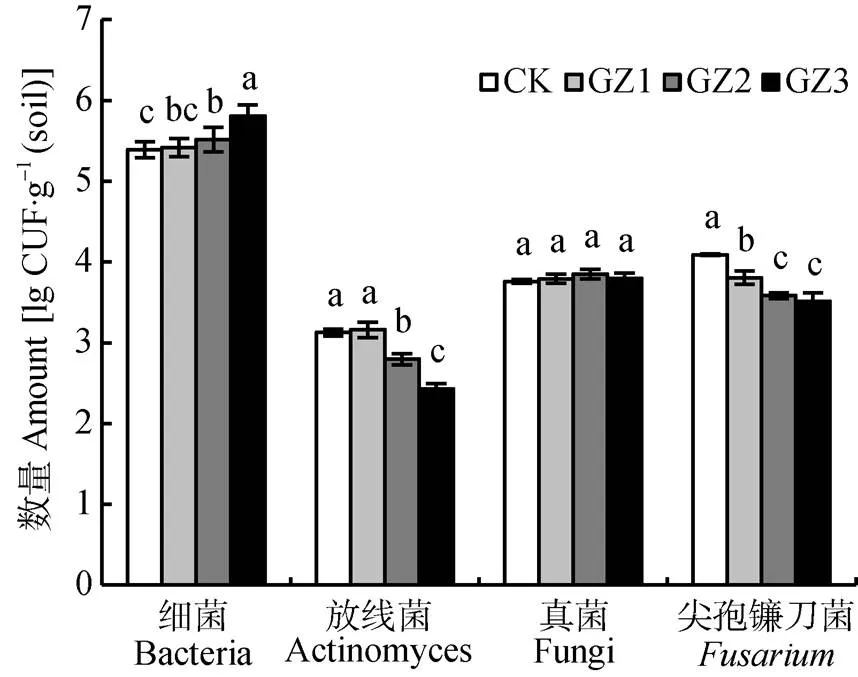
图2 与甘蔗轮作不同年限后香蕉田土壤可培养微生物数量
CK: 连作香蕉11年; GZ1: 香蕉连作地—甘蔗1年—香蕉1年; GZ2: 香蕉连作地—甘蔗2年—香蕉1年; GZ3: 香蕉连作地—甘蔗3年—香蕉1年。不同小写字母表示处理间差异显著(<0.05)。CK: continuous cropping bananas for 11 years; GZ1: bananas monocropping – 1 year of sugarcane rotation – 1 year of banana replanting; GZ2: bananas monocropping – 2 years of sugarcane rotation – 1 year of banana replanting; GZ3: bananas monocropping – 3 years of sugarcane rotation – 1 year of banana replanting. Different lowercase letters indicate significant differences among treatments at 0.05 level.
2.4 蕉地轮作不同年限甘蔗对土壤微生物群落结构的影响
2.4.1 微生物多样性指数
连作香蕉地轮作不同年限甘蔗, 土壤微生物多样性指数如表2所示。土壤原核微生物群落丰度指数(Chao 1、ACE)随甘蔗种植年数的增加而显著降低,群落多样性Shannon指数也随甘蔗种植年数的增加而显著降低。结果表明, 甘蔗种植的时间越长, 土壤原核微生物群落的丰度和多样性越低。
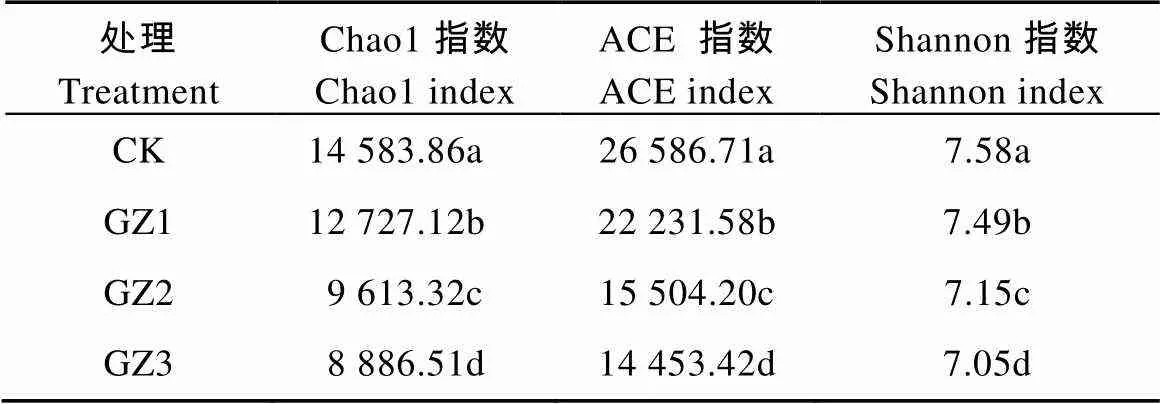
表2 与甘蔗轮作不同年限后香蕉田土壤细菌群落α-多样性指数
CK: 连作香蕉11年; GZ1: 香蕉连作地—甘蔗1年—香蕉1年; GZ2: 香蕉连作地—甘蔗2年—香蕉1年; GZ3: 香蕉连作地—甘蔗3年—香蕉1年。不同小写字母表示处理间差异显著(<0.05)。CK: continuous cropping bananas for 11 years; GZ1: bananas monocropping – 1 year of sugarcane rotation – 1 year of banana replanting; GZ2: bananas monocropping – 2 years of sugarcane rotation – 1 year of banana replanting; GZ3: bananas monocropping – 3 years of sugarcane rotation – 1 year of banana replanting. Different lowercase letters indicate significant differences among treatments at 0.05 level.
2.4.2 样品间OTU聚类
根据OTU丰富度热图, CK与GZ1聚为一类, 而GZ2与GZ3聚为一类(图3), 表明香蕉田轮作甘蔗2年后土壤原核微生物总体上发生了较大变化。根据OUT的变化情况, 主要有两种具有明显变化趋势的类群, 一类OUT的丰度随着甘蔗种植年数的增加而增加(组1), 另外一类OTU丰度随轮作甘蔗种植年限逐年较少的趋势(组2)。该结果表明, 土壤中存在特定的微生物会随甘蔗种植年数的增加而呈逐年递增或者递减的趋势。这些微生物的变化可能与枯萎病的发病率相关。
2.4.3 物种分类表达谱
物种分类表达谱表明(图4), 在本研究的4种土壤中, 微生物的优势门是变形菌门(Proteobacteria, 28.20%)、酸杆菌门(Acidobacteria, 24.93%)和绿弯菌门(Chloroflexi, 14.37%), 这3个门的微生物占比高达67%。以上各门微生物向下注释, 优势目分别为酸杆菌目(Acidobacteriales, 4.27%)、黄单胞菌目(Xanthomonadales, 9.12%)、假单胞菌目(Pseudomonadales, 6.05%)、红螺菌目(Rhodospirillales, 6.74%)、纤线杆菌目(Ktedonobacterales, 4.94%)和Thermogemmatisporales(4.23%), 这些优势目细菌占比达35%。
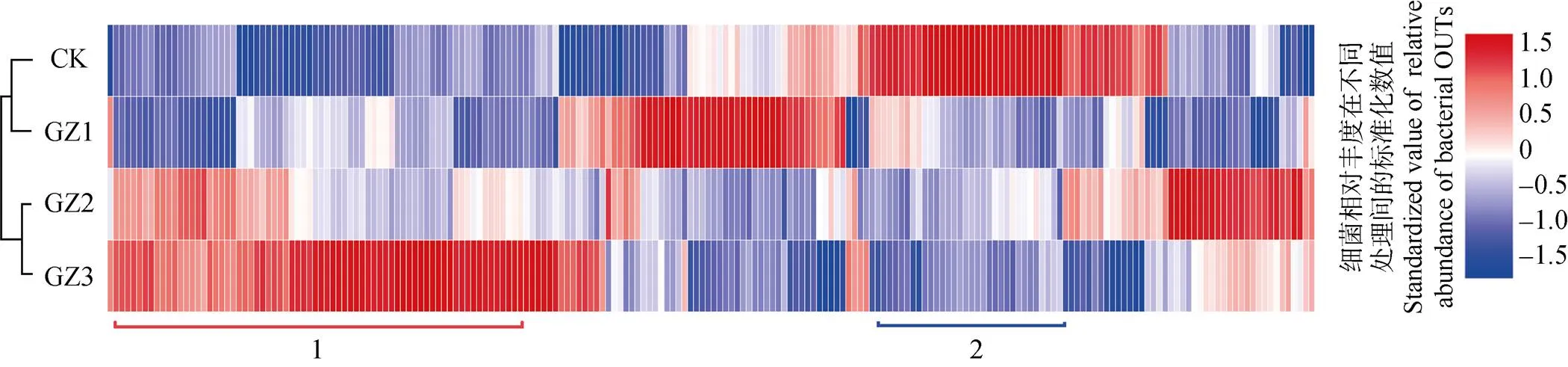
图3 与甘蔗轮作不同年限后香蕉田土壤16s rDNA(细菌OTUs)丰富度热图
CK: 连作香蕉11年; GZ1: 香蕉连作地—甘蔗1年—香蕉1年; GZ2: 香蕉连作地—甘蔗2年—香蕉1年; GZ3: 香蕉连作地—甘蔗3年—香蕉1年。红色表示微生物丰度上调, 蓝色表示微生物丰度下调。CK: continuous cropping bananas for 11 years; GZ1: bananas monocropping – 1 year of sugarcane rotation – 1 year of banana replanting; GZ2: bananas monocropping – 2 years of sugarcane rotation – 1 year of banana replanting; GZ3: bananas monocropping – 3 years of sugarcane rotation – 1 year of banana replanting. Red means microbial abundance increased, blue means microbial abundance decreased.
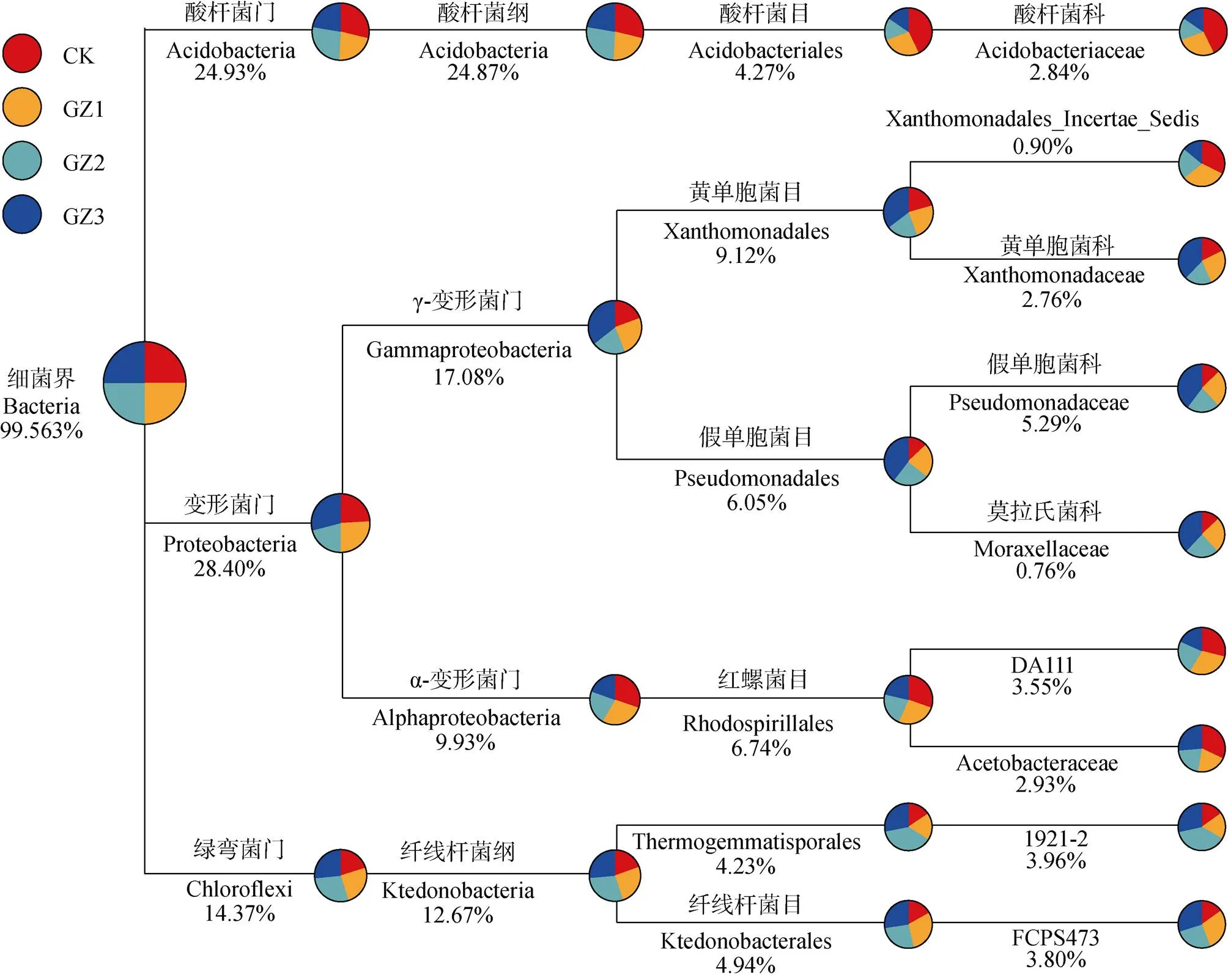
图4 与甘蔗轮作不同年限后香蕉田土壤16s rDNA(细菌OTUs)表达谱
CK: 连作香蕉11年; GZ1: 香蕉连作地—甘蔗1年—香蕉1年; GZ2: 香蕉连作地—甘蔗2年—香蕉1年; GZ3: 香蕉连作地—甘蔗3年—香蕉1年。CK: continuous cropping bananas for 11 years; GZ1: bananas monocropping – 1 year of sugarcane rotation – 1 year of banana replanting; GZ2: bananas monocropping – 2 years of sugarcane rotation – 1 year of banana replanting; GZ3: bananas monocropping – 3 years of sugarcane rotation – 1 year of banana replanting.
2.4.4 优势微生物的比较
在目水平上, 不同处理间优势细菌主要呈现3种变化趋势(图5)。第1类, 没有呈现明显规律(图5左侧黑色线段标记); 第2类, 随甘蔗种植年数逐年减少(图5左侧红色线段标记); 第3类, 随着甘蔗种植年数逐年增加(图5左侧蓝色线段标记)。从图5可知, 根瘤菌目(Rhizobiales)、酸杆菌目、军团菌目(Legionellales)和红螺菌目丰度随甘蔗种植年数的增加而逐年减少。假单胞菌目、硝化螺旋菌目(Nitrospirales)、浮霉菌目(Planctomycetales)、肠杆菌目(Enterobacteriales)、球形杆菌目(Sphaerobacterales)、酸微菌目(Acidimicrobiales)、棒杆菌目(Corynebacteriales)和土壤红杆菌目(Solirubrobacterales)则随甘蔗种植年数逐年增加。
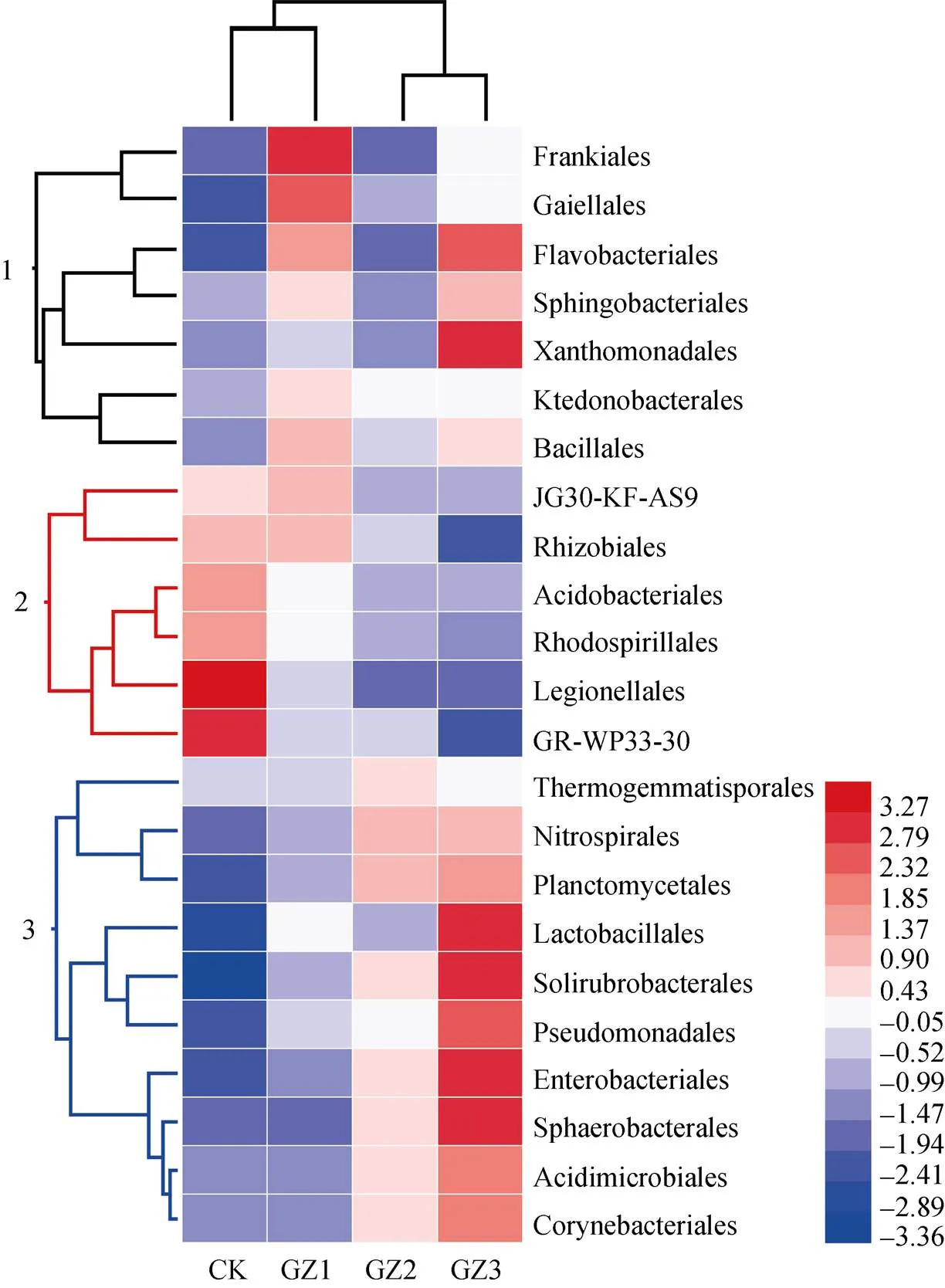
图5 与甘蔗轮作不同年限后香蕉田土壤细菌目水平上的物种分类热图
CK: 连作香蕉11年; GZ1: 香蕉连作地—甘蔗1年—香蕉1年; GZ2: 香蕉连作地—甘蔗2年—香蕉1年; GZ3: 香蕉连作地—甘蔗3年—香蕉1年。红色表示微生物丰度上调, 蓝色表示微生物丰度下调。CK: continuous cropping bananas for 11 years; GZ1: bananas monocropping – 1 year of sugarcane rotation – 1 year of banana replanting; GZ2: bananas monocropping – 2 years of sugarcane rotation – 1 year of banana replanting; GZ3: bananas monocropping – 3 years of sugarcane rotation – 1 year of banana replanting. Red means microbial abundance increased, blue means microbial abundance decreased.
2.5 优势微生物与香蕉枯萎病发病率的关系
为探索种植甘蔗后, 优势微生物变化与香蕉枯萎病发病率的关系, 在2.4.4的基础上, 对细菌优势目丰度与香蕉枯萎病发病率进行Pearson相关性分析。结果表明, 酸杆菌目(=0.986,=0.007)、红螺菌目 (=0.986,=0.041)、军团菌目(=0.993,=0.003)丰度与发病率呈显著正相关, 即以上细菌丰度越高, 香蕉枯萎病发病率越高。假单胞菌目(=-0.907,=0.047)、浮霉菌目(=-0.997,=0.002)、酸微菌目(=-0.929,=0.035)和土壤红杆菌目(=-0.965,=0.018)丰度与发病率呈显著负相关, 即以上细菌丰度越高, 香蕉枯萎病发病率越低。
3 讨论
本研究表明, 甘蔗-香蕉轮作能显著降低香蕉枯萎病发病率。已有轮作模式, 香蕉-韭菜[9]、香蕉-水稻[7]、香蕉-辣椒()[15]、香蕉-菠萝[5]、香蕉-木薯[8]、香蕉-玉米[5]轮作, 后茬香蕉枯萎病发病率分别为2%、10%、13%、15%、40%、40%, 韭菜、辣椒、水稻、木薯相对防效分别为96.7%、84.7%、81.7%、55.5%。本研究的轮作模式, 后茬香蕉枯萎病发病率仅为17.86%~1.79%, 相对防效63.66%~96.36%, 效果与韭菜接近。与以上轮作模式相比, 甘蔗为传统大宗作物, 与香蕉种植方式接近, 种植效益好, 更有利于大面积推广应用。
目前研究认为, 轮作对缓解香蕉枯萎病发生存在多种控病机制。1)直接抑菌作用。如韭菜提取物能够显著抑制尖孢镰刀菌菌丝生长和孢子萌发, 并使其形态发生畸变[9], 其抑菌物质主要来源于根系挥发物中的2-甲基-2-戊烯醛(2-methyl-2-pentenal)、二甲基三硫醚(dimethyl trisulfide)、二甲基二硫醚(dimethyl disulfide)、二丙基二硫醚(dipropyl disulfide)、二丙基三硫醚(dipropyl trisulfide)[16]。柳红娟[17]研究表明, 木薯提取物与根系分泌物对尖孢镰刀菌菌丝生长和孢子萌发同样具有显著抑制作用。2)增加土壤拮抗菌。对辣椒[15]、玉米[5]、菠萝[5]与香蕉的轮作研究表明, 这些作物的根系分泌物对尖孢镰刀菌并无显著抑制作用, 但能促进后茬土壤拮抗菌的生长, 辣椒轮作能有效提高土壤中芽孢杆菌科(Bacillaceae)、莫拉氏菌科(Moraxellaceae)和鞘脂单胞菌科(Sphingomonadaceae)细菌丰度[17]。菠萝轮作显著促进土壤中浮霉状菌属()、慢生根瘤菌属()、伯克氏菌属()等细菌显著增加, 这些拮抗菌的增加改善了土壤环境, 间接抑制病原的生长[5]。3)改变土壤理化环境。还有研究表明, 水稻香蕉轮作, 在水稻种植的水淹厌氧条件下, Eh大幅度下降至-200 mV, 形成极强的负氧化还原电位, 能够显著抑制尖孢镰刀菌孢子的存活, 缓解下茬香蕉枯萎病的爆发[18]。
本研究发现, 连作蕉地轮作甘蔗后, 土壤中优势细菌所属门类并没有发生变化, 其主要门类均为变形菌门(28.20%)、酸杆菌门(24.93%)和绿弯菌门(14.37%), 这与欧阳娴等[19]和Wang等[5]对韭菜-香蕉轮作模式和菠萝-香蕉轮作模式的研究结果类似, 均发现变形菌门、酸杆菌门、绿湾菌门为香蕉连作土和轮作土的主要细菌群系。以上3个研究表明, 在轮作香蕉地中以上3个门类细菌占主要优势。本研究还表明, 香蕉枯萎病发病率与土壤中假单胞菌目、浮霉菌目呈负相关, 而与酸杆菌目呈正相关。
前人研究表明, 假单胞菌目中多种细菌能够诱发植物产生诱导系统抗性(ISR)。van Peer等[20]发现, 将荧光假单胞菌()WCS417r接种到康乃馨()的根系后, 能够促进植物地上部对尖孢镰刀菌()的抗性, 且植物地上部受害部位积累大量的植物抗毒素。Ahn等[21]将恶臭假单胞菌()LSW17S接种到番茄()土壤中, 番茄等防御基因被诱导上调表达, 缓解尖孢镰刀菌()对番茄的危害。此外, 假单胞菌目中的其他一些有益菌能通过ET、JA等植物激素途径促进植物抗病性[22-24]。另外一方面, 假单胞菌目某些细菌能够通过直接抑制病原菌的生长而缓解植物病害的危害[25-27], 如塞帕仙假单胞菌()能够通过向土壤中释放β-1,3 glucanase而抑制病原菌的生长[25]。本研究表明, 假单胞菌目相对丰度随着甘蔗种植年数的增加而逐年递增, 且与香蕉枯萎病的发病率呈显著负相关。因此, 我们推测连作香蕉地轮作甘蔗, 提高了土壤假单胞菌目丰度, 可能诱导植物产生抗性, 或直接抑制尖孢镰刀菌的生长, 从而降低枯萎病的危害。
Pearson相关性分析表明, 浮霉菌目细菌丰度与枯萎病发病率呈显著负相关。Wang等[5]研究表明, 与香蕉连作模式相比, 香蕉-菠萝轮作模式中土壤浮霉菌门(Planctomycete)丰度更高, 且与枯萎病的发病率负相关。Sanguin等[28]的研究亦表明, 土壤浮霉菌门丰度与小麦()全蚀病呈显著负相关。Zhou等[29]向黄瓜()土壤中加入自毒物质香豆酸后, 显著促进了尖孢镰刀菌的生长而显著降低浮霉菌门细菌丰度, 两者丰度呈相反的趋势。因此, 这些证据均表明土壤中浮霉菌门细菌的增加可能与枯萎病发病率下降有一定关系。但是, 具体是浮霉菌门下何种细菌发挥作用则仍有待进一步研究。本研究亦表明, 酸杆菌目细菌丰度与枯萎病显著正相关。根据已有研究表明, 在多种酸杆菌目中, 均存在编码降解植物细胞壁和多糖酶的相关基因, 因此推测该目微生物能够入侵植物并在植物内定殖[30-31]。另外, 也有研究发现, 该目微生物与某些植物的抗旱性[32]和抗病性相关[33]。但是, 本研究酸杆菌目中何种细菌影响香蕉枯萎病的发生及其可能原因仍有待进一步研究。
4 结论
本研究对连作香蕉地轮作不同年限甘蔗时田间香蕉生长、香蕉枯萎病发生和土壤微生物群落结构组成、变化等进行了研究。结果表明: 连作香蕉地轮作2年甘蔗, 即可显著降低后茬香蕉枯萎病发病率, 且明显提高香蕉产量。土壤细菌群落丰度和多样性指数随着轮作甘蔗年限的增加而降低, 香蕉枯萎病发病率与土壤中假单胞菌目、浮霉菌目、酸微菌目和红杆菌目呈负相关, 而与酸杆菌目、红螺菌目、军团菌目呈正相关关系,轮作甘蔗通过改变土壤微生物群落结构而间接影响尖孢镰刀菌的生存环境, 降低香蕉枯萎病发病率。轮作2年后土壤微生物群落发生明显变化, 达到有效防控香蕉枯萎病危害, 以及后茬香蕉增产效果, 与古籍《广东新语》中关于香蕉-甘蔗轮作的记载一致。本研究对通过轮作等农业措施修复土壤和防控香蕉土传病害具有指导意义。
[1] ZHU Y, FOX R H. Corn-soybean rotation effects on nitrate leaching[J]. Agronomy Journal, 2003, 95(4): 1028–1033
[2] VANEERD L L, CONGREVES K A, HAYES A, et al. Long-term tillage and crop rotation effects on soil quality, organic carbon, and total nitrogen[J]. Canadian Journal of Soil Science, 2014, 94(3): 303–315
[3] XUAN D T, GUONG V T, ROSLING A, et al. Different crop rotation systems as drivers of change in soil bacterial community structure and yield of rice,[J]. Biology and Fertility of Soils, 2012, 48(2): 217–225
[4] NAVARRO-NOYA Y E, GÓMEZ-ACATA S, MONTOYA- CIRIACO N, et al. Relative impacts of tillage, residue management and crop-rotation on soil bacterial communities in a semi-arid agroecosystem[J]. Soil Biology and Biochemistry, 2013, 65: 86–95
[5] WANG B B, LI R, RUAN Y Z, et al. Pineapple-banana rotation reduced the amount ofmore than maize-banana rotation mainly through modulating fungal communities[J]. Soil Biology and Biochemistry, 2015, 86: 77–86
[6] XIONG W, ZHAO Q Y, XUE C, et al. Comparison of fungal community in black pepper-vanilla and vanilla monoculture systems associated with vanillawilt disease[J]. Frontiers in Microbiology, 2016, 7: 117
[7] 辛侃, 赵娜, 邓小垦, 等. 香蕉-水稻轮作联合添加有机物料防控香蕉枯萎病研究[J]. 植物保护, 2014, 40(6): 36–41XIN K, ZHAO N, DENG X K, et al. Effects of rice rotation incorporated with organic materials on suppression of bananawilt disease[J]. Plant Protection, 2014, 40(6): 36–41
[8] 柳红娟, 黄洁, 刘子凡, 等. 木薯轮作年限对枯萎病高发蕉园土壤抑病性的影响[J]. 西南农业学报, 2016, 29(2): 255–259 LIU H J, HUANG J, LIU Z F, et al. Effects of different years of cassava rotation on soil disease suppression in high incidence banana plantations[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(2): 255–259
[9] HUANG Y H, WANG R C, LI C H, et al. Control of Fusarium wilt in banana with Chinese leek[J]. European Journal of Plant Pathology, 2012, 134(1): 87–95
[10] 赵飞, 倪根金, 章家恩. 广东增城市农业遗产的调查研究[J]. 古今农业, 2012, (3): 52–62 ZHAO F, NI G J, ZHANG J E. Investigation on agricultural heritage in Zengcheng City of Guangdong[J]. Ancient and Modern Agriculture, 2012, (3): 52–62
[11] 林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010 LIN X G. Principles and Methods of Soil Microbiology Research[M]. Beijing: Higher Education Press, 2010
[12] KOMADA H. Development of a selective medium for quantitative isolation offrom natural soil[J]. Review of Plant Protection Research, 1975, 8: 114–124
[13] SMITH L J, SMITH M K, TREE D, et al. Development of a small-plant bioassay to assess banana grown from tissue culture for consistent infection byf. sp.[J]. Australasian Plant Pathology, 2008, 37(2): 171–179
[14] ZHAO J, NI T, LI Y, et al. Responses of bacterial communities in arable soils in a rice-wheat cropping system to different fertilizer regimes and sampling times[J]. PLoS One, 2014, 9(1): e85301
[15] 赵娜. 三种茄科蔬菜轮作对高发枯萎病蕉园土壤微生物的调控效应[D]. 海口: 海南大学, 2014: 40–41 ZHAO N. Effecting of crop rotation with three Solanaceae on the soil microbial in banana orchard with serious Fusarium wilt disease[D]. Haikou: Hainan University, 2014: 40–41
[16] ZHANG H, MALLIK A, ZENG R S. Control of Panama disease of banana by rotating and intercropping with Chinese chive (Rottler): Role of plant volatiles[J]. Journal of Chemical Ecology, 2013, 39(2): 243–252
[17] 柳红娟. 木薯对香蕉枯萎病的防控效果及其机理研究[D]. 海口: 海南大学, 2015: 16–17 LIU H J. The effect and mechanism of cassava on the control of banana Fusarium wilt[D]. Haikou: Hainan University, 2015: 16–17
[18] 辛侃. 水稻-香蕉轮作并向土壤中添加有机物料防控香蕉枯萎病的研究[D]. 海口: 海南大学, 2014: 25–28 XIN K. Control off. sp.in banana by rice-banana rotation combine with application of organic materials[D]. Haikou: Hainan University, 2014: 25–28
[19] 欧阳娴, 阮小蕾, 吴超, 等. 香蕉轮作和连作土壤细菌主要类群[J]. 应用生态学报, 2011, 22(6): 1573–1578 OUYANG X, RUAN X L, WU C, et al. Main bacterial groups in banana soil under rotated and continuous cropping[J]. Chinese Journal of Applied Ecology, 2011, 22(6): 1573–1578
[20] VAN PEER R, NIEMANN G J, SCHIPPERS B. Induced resistance and phytoalexin accumulation in biological control of Fusarium wilt of carnation bysp. strain WCS417r[J]. Phytopathology, 1991, 81(7): 728–734
[21] AHN I P, LEE S W, SUH S C. Rhizobacteria-induced priming inis dependent on ethylene, jasmonic acid, and[J]. Molecular Plant-Microbe Interactions, 2007, 20(7): 759–768
[22] SHORESH M, YEDIDIA I, CHET I. Involvement of jasmonic acid/ethylene signaling pathway in the systemic resistance induced in cucumber byT203[J]. Phytopathology, 2005, 95(1): 76–84
[23] STEIN E, MOLITOR A, KOGEL K H, et al. Systemic resistance inconferred by the mycorrhizal fungusrequires jasmonic acid signaling and the cytoplasmic function of NPR1[J]. Plant and Cell Physiology, 2008, 49(11): 1747–1751
[24] BERENDSEN R L, PIETERSE C M J, BAKKER P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478–486
[25] FRIDLENDER M, INBAR J, CHET I. Biological control of soilborne plant pathogens by a β-1,3 glucanase-producing[J]. Soil Biology and Biochemistry, 1993, 25(9): 1211–1221
[26] GARBEVA P, VAN VEEN J A, VAN ELSAS J D. Assessment of the diversity, and antagonism towardsAG3, ofspecies in soil from different agricultural regimes[J]. FEMS Microbiology Ecology, 2004, 47(1): 51–64
[27] COUILLEROT O, PRIGENT-COMBARET C, CABALLERO- MELLADO J, et al.and closely- related fluorescent pseudomonads as biocontrol agents of soil-borne phytopathogens[J]. Letters in Applied Microbiology, 2009, 48(5): 505–512
[28] SANGUIN H, SARNIGUET A, GAZENGEL K, et al. Rhizosphere bacterial communities associated with disease suppressiveness stages of take-all decline in wheat monoculture[J]. New Phytologist, 2009, 184(3): 694–707
[29] ZHOU X G, WU F Z.-acid influenced cucumber rhizosphere soil microbial communities and the growth off. sp.Owen[J]. PLoS One, 2012, 7(10): e48288
[30] WARD N L, CHALLACOMBE J F, JANSSEN P H, et al. Three genomes from the phylum Acidobacteria provide insight into the lifestyles of these microorganisms in soils[J]. Applied and Environmental Microbiology, 2009, 75(7): 2046–2056
[31] RAWAT S R, MÄNNISTÖ M K, BROMBERG Y, et al. Comparative genomic and physiological analysis provides insights into the role of Acidobacteria in organic carbon utilization in Arctic tundra soils[J]. FEMS Microbiology Ecology, 2012, 82(2): 341–355
[32] ZOLLA G, BADRI D V, BAKKER M G, et al. Soil microbiomes vary in their ability to confer drought tolerance to Arabidopsis[J]. Applied Soil Ecology, 2013, 68: 1–9
[33] CAMPOS S B, LISBOA B B, CAMARGO F A O, et al. Soil suppressiveness and its relations with the microbial community in a Brazilian subtropical agroecosystem under different management systems[J]. Soil Biology and Biochemistry, 2016, 96: 191–197
Continual effect and soil microbial ecology mechanism of banana-sugarcane rotation controllingwilt of banana (Ⅰ)*
ZENG Lisha1†, LIN Weipeng1,2,3†, LYU Shun1**, WANG Fang1, XIA Ling1, LIU Wenqing1, WU Chaorong2, ZHOU Jiankun1, DU Caixian1, CAI Kunzheng2, LIU Jianping1
(1. Institute of Banana and Vegetable Research, Dongguan 523061, China; 2. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China; 3. Tea Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510642, China)
Banana wilt caused byf. sp.is one of the most widespread and severe diseases in the world. In recent years, banana-sugarcane rotation plantation has been used to prevent and controlwilt of banana in some farmlands in the Pearl River Delta with good effects.Banana-sugarcane rotation had been recorded in ancient Chinese book Guangdong New Sight, but the role, control effect and mechanism of the rotation system was unclear. Therefore, the control effect of bananawilt after different years of sugarcane rotation was studied and soil micro-ecological mechanism discussed in this paper. The complete random design method with 4 treatments of medium-resistance ‘Nongke No. 1’ banana and ‘Guangdong Yellow Peel’ sugarcane were used in the experiment. The farmland with 11 years of continuous cropping of banana (CK) was the control. Other three treatments were continuous cropping of banana ration with sugarcane for one year (GZ1), two years (GZ2) and three years (GZ3) before replanting banana for 1 year. The bananawilt disease incidence after various years of sugarcane rotation was investigated, the numbers of soil culturable micro-organisms measured, and soil microbial composition and structure analyzed using the high-throughput DNA sequencing technique. The results showed that that bananawilt incidence in banana continuously planting field was 49.15%. After one year of sugarcane rotation, the incidence dropped to 17.86% and the effect of the relative control was 63.66%. After two or three years of sugarcane rotation, the incidence was only 1.79% and the effect of the relative control was above 95%. The amount of cultivable bacteria increased significantly along with increased year of sugarcane rotation, but the amounts ofand actinomycetes significantly decreased. The amount of fungi did not significantly change. Sequence analysis showed that soil bacterial diversity index reduced with the number of years of sugarcane rotation. The relative abundance of bacteria of Pseudomonadales, Planctomycetales, Acidimicrobiales and Solirubrobacteralesapparentlyincreased with increasing number of sugarcane rotation years and had significantly negative correlation with the incidence of bananawilt. Meanwhile, bacteria of Acidobacteriales, Rhodospirillales, Legionellales and Enterobacteriales apparentlydecreased and had significantly positive correlation with the incidence of bananawilt. In summary, banana-sugarcane rotation significantly reduced banana wilt incidence, compared with continuous banana cropping system. The inhibiting effect apparently increased with increasing number of years of sugarcane rotation. In two years of sugarcane rotation of banana field, the incidence of banana wilt significantly reduced and the yield of banana significantly increased; which was consistent with the results recorded in the Guangdong New Sight. The changes in bacterial community structure in the soil played an important role in the control of bananawilt.
Continuous banana cropping; Banana-sugarcane rotation; Bananawilt;; Soil micro-organism
, E-mail: shunlv@qq.com
Apr. 9, 2018;
Aug. 29, 2018
S474
A
2096-6237(2019)02-0257-10
10.13930/j.cnki.cjea.180361
* 广东省现代农业科技创新联盟建设项目(2016LM4216)、广东省现代农业产业技术体系(2018LM1027)、东莞市社会科技发展项目(2013108101043)和广东省科技计划项目(2012B020410005)资助
吕顺, 主要从事香蕉蔬菜病害防控研究。E-mail: shunlv@qq.com
†同等贡献者: 曾莉莎, 主要从事香蕉蔬菜病害防控研究, E-mail: 371924298@qq.com; 林威鹏, 主要从事农业生态学研究, E-mail: linweipeng1986@163.com
2018-04-09
2018-08-29
* This study was founded by the Innovation Alliance Construction Project of Modern Agricultural Technology of Guangdong Province (2016LM4216), the Modern Agricultural Industry Technology System in Guangdong Province (2018LM1027), the Social Development Science and Technology Project of Dongguan City (2013108101043) and the Science and Technology Plan Projects of Guangdong Province (2012B020410005).
†Equenlent contributors
曾莉莎, 林威鹏, 吕顺, 王芳, 夏玲, 刘文清, 伍朝荣, 周建坤, 杜彩娴, 蔡昆争, 刘建平. 香蕉-甘蔗轮作模式防控香蕉枯萎病的持续效果与土壤微生态机理(Ⅰ)[J]. 中国生态农业学报(中英文), 2019, 27(2): 257-266
ZENG L S, LIN W P, LYU S, WANG F, XIA L, LIU W Q, WU C R, ZHOU J K, DU C X, CAI K Z, LIU J P. Continual effect and soil microbial ecology mechanism of banana-sugarcane rotation controllingwilt of banana (Ⅰ)[J]. Chinese Journal of Eco-Agriculture, 2019, 27(2): 257-266

