冬小麦免耕覆盖与有机栽培对土壤微生物群落组成的影响*
王小玲, 马 琨, 汪志琴, 李 越, 魏常慧
冬小麦免耕覆盖与有机栽培对土壤微生物群落组成的影响*
王小玲1,2, 马 琨1**, 汪志琴1,2, 李 越2, 魏常慧2
(1. 宁夏大学农学院 银川 750021; 2. 宁夏大学西北土地退化与生态恢复国家重点实验室培育基地 银川 750021)
为揭示农业管理活动对土壤微生物群落结构及AM真菌多样性的影响, 以农田土壤生态系统为研究对象, 选取免耕覆盖+施有机肥(NF)、免耕覆盖+不施有机肥(NC)、传统耕作不覆盖+施有机肥(TF)和传统耕作不覆盖+不施有机肥(TC)4种处理, 采用Illumina Miseq高通量测序及磷脂脂肪酸(phospholipid fatty acids, PLFAs)分析方法, 研究持续冬小麦免耕覆盖有机栽培3年后, 土壤微生物群落结构组成、AM真菌及其多样性与土壤环境因子间的关系。结果表明, 持续免耕覆盖有机栽培能增加以PLFA表征的土壤微生物群落的生物量, 传统耕作显著提高了土壤革兰氏阳性菌(G+)、阴性菌(G-)的生物量(<0.05)。且随免耕栽培管理年限增加, 土壤AM真菌生物量呈显著上升趋势; 以16:1ω5c中性脂(NLFA)与16:1ω5c磷脂(PLFA)表征的AM真菌生物量比值显著升高(<0.05)。免耕覆盖措施下, 有机肥的施用提高了土壤AM真菌丰富度指数(Chao1指数和ACE指数), 但降低了土壤AM真菌的多样性(香农指数、辛普森指数)。主成分分析结果显示, AM真菌孢子(16:1ω5c中性脂)的生物量与土壤有机质、土壤易提取球囊霉素含量呈正相关关系, AM真菌丰富度指数与土壤有机质含量呈正相关, AM真菌多样性指数与土壤全氮含量、脲酶活性呈正相关。受农业管理措施导致的土壤理化性状及土壤生物学差异等综合因素影响, 土壤微生物生物量及AM真菌多样性和丰富度改变。免耕覆盖措施提高了土壤AM真菌多样性指数, 有机肥施用显著影响了AM真菌NLFA/PLFA生物量的比例, 改变了AM真菌孢子和菌丝间生物量碳的分配关系。
免耕覆盖; 有机栽培; 冬小麦; 微生物群落; AM真菌; 环境因子
免耕是近几十年来农田管理中的一种保护性措施, 相比传统耕作, 免耕可增加土壤表面的残茬覆盖, 减少地表径流、增加土壤表层有机质含量[1]; 同时, 免耕通过减少土壤机械扰动, 有利于减少土壤压实, 保持良好的土壤孔隙度, 从而改善微生物群落结构组成与多样性, 优化土壤环境, 间接影响作物养分吸收情况以及作物产量。此外, 土壤微生物不仅驱动土壤物质转化和养分循环, 还可作为土壤中植物有效养分的储备库[2]。作为土壤生态系统的重要组成部分, 近年来对不同耕作措施下土壤微生物生物量及微生物群落结构多样性的研究越来越受到人们的重视。相关研究表明, 长期免耕或绿肥翻压可以增加表层土壤微生物数量[3], 对土壤微生物多样性也会产生显著影响[4-5]。31年长期施肥研究表明, 有机肥施入能提高土壤革兰氏阳性菌(G+)、阴性菌(G-)的比值(G+/G-)、细菌/真菌的比值, 细菌和真菌群落结构组成也受到土壤有机碳和土壤碳氮比(C/N)的影响[6]。随农田秸秆还田量增加, 土壤真菌群落数量和多样性指数显著增加; 土壤有机碳、pH和速效磷是导致土壤微生物群落结构及多样性变化的主要因素[7]。
丛枝菌根真菌(fungi, AMF)是一种在自然生态系统与农田生态系统中普遍存在的真菌, 能够与植物根系产生互利共生的土壤微生物[8]。可有效提高植物对氮、磷等养分的获取能力[9]、提高植物的抗旱性以及维持植物群落的多样性[10]; 而且AM真菌在促进地上部碳源向地下分配, 提高土壤有机碳含量, 改善土壤结构, 增强土壤生态系统稳定性方面扮演着重要角色[11]。张贵云等[12]经过22年长期保护性耕作试验发现, 免耕覆盖处理AM真菌多样性最高, 传统耕作处理最低。免耕可以增加AM真菌群落丰度, 促进侵染率, 提高AM真菌产孢量, 进而提高作物产量[13]。而传统耕作则在一定程度上影响了AM真菌生物量, 导致菌丝体网络结构破坏[14]。
虽然有关土壤AM真菌的研究有许多报道, 但是由于气候条件、土壤类型以及耕作制度的复杂性, 有关保护性耕作措施对AM真菌的影响, 仍然缺乏。基于此, 本试验采用磷脂脂肪酸(PLFA)和Illumina MiSeq高通量测序手段, 研究免耕覆盖有机栽培下土壤AM真菌在土壤微生物群落组成中的分布特征, 探讨了不同管理措施和土壤因子对土壤微生物群落、AM真菌组成及其多样性的影响,旨在揭示AM真菌是如何在短时间内响应农业综合管理活动带来的影响, 农业综合管理活动是否会通过影响AM真菌菌丝和孢子生物量来影响碳的分配, 以期为宁夏南部山区长期免耕覆盖栽培技术的推广以及农田土地可持续利用提供理论依据。
1 材料与方法
1.1 试验地概况
试验地点位于宁夏固原市隆德县沙塘镇和平村(35°12′36″N, 105°28′48″E), 海拔1 883 m, 年均降水量410 mm, 年均蒸发量1 370 mm, 年有效积温为2 400 ℃, 年均气温6 ℃。土壤类型为黑垆土, 母质为黄土。试验前土壤基本理化性状为: pH 9.0, 全氮0.52 g×kg-1, 有机质10.63 g·kg-1, 碱解氮41.0 mg×kg-1, 全磷0.65 g×kg-1, 速效磷45.5 mg×kg-1, 速效钾170.5 mg×kg-1
1.2 试验设计
试验开始于2015年4月, 采用双因素随机区组设计, 4个处理, 4次重复, 小区面积3 m×4 m。其中A因素为耕作覆盖: 免耕覆盖(N)、传统耕作不覆盖(T); B因素为施肥: 施用有机肥(F)和不施有机肥(C)。4个处理分别为: 免耕覆盖+施有机肥(NF)、免耕覆盖+不施有机肥(NC)、传统耕作不覆盖+施有机肥(TF)和传统耕作不覆盖+不施有机肥(TC)。2015年春季整地, 第1茬作物为蚕豆(L.), 供试品种为‘临蚕6号’, 当年4月20日播种, 7月底收获。2015年、2016年、2017年9月按照试验设计分别种植冬小麦(L.), 供试品种为‘蓝天32号’。2015年冬小麦种植前将3 000 kg×hm-2的蚕豆秸秆粉碎与3 000 kg∙hm-2的小麦脱粒后的颖壳混合后均匀覆盖于免耕处理土壤表面, 其后不再覆盖。冬小麦播种量为375 kg∙hm-2, 每小区12行, 每行播31.25 kg∙hm-2, 施肥处理中生物有机肥(黄腐酸≥12%, 有机质≥40%, 巨大芽孢杆菌+胶冻样类芽孢杆菌≥0.5亿×g-1, 净含量40 kg×袋-1)施用量每小区折合纯氮(N)90 kg∙hm-2、磷(P2O5)19.7 kg∙hm-2、钾(K2O%)18.6 kg∙hm-2。免耕处理冬小麦播种前将生物有机肥均匀撒施于地表, 传统耕作处理的生物有机肥随耕翻进入土壤。免耕覆盖处理试验期间均不进行任何耕翻扰动, 传统耕作在冬小麦收获后及种植前正常耕翻。免耕处理田间杂草齐地表剪掉, 杂草覆盖在作物行间; 传统耕作处理田间杂草连根拔除, 扔出田外。
1.3 样品采集
土壤样品分别采集于2015年、2016年和2017年冬小麦开始种植及收获前, 利用“五点取样法”, 从0~20 cm土层采集冬小麦行间土壤样本, 各小区土壤样本独立, 低温储存带回实验室, 过1 mm筛, 部分储存在-40 ℃冰箱用于土壤主要微生物类群的PLFA测定, 部分储存在-80 ℃冰箱用于土壤AM真菌多样性的测定, 其余样品自然风干, 用于土壤理化性状测定。
1.4 研究方法
1.4.1 土壤基本理化性状分析
土壤全氮、全磷、有机质、碱解氮、速效磷和速效钾的测定分别采用半微量凯氏法、硫酸-高氯酸消煮-钼锑抗比色法、重铬酸钾容量法、碱解扩散法、Olsen法和NH4OAc浸提-火焰光度法, pH测定的水土比为5∶1[15]。
1.4.2 土壤微生物主要类群磷脂脂肪酸的测定
利用PLFAs分析来研究土壤微生物群落结构组成。称取相当于5 g干土重的新鲜土样, 按照魏常慧等[16]的提取步骤: 在进样口为250 ℃、He流量为40 mL×min-1(0.4 MPa)、氮气(0.4 Mpa)、色谱柱为Agilent HP-5MS, 30 µm×250 µm×0.25 µm, 柱温: 170 ℃。利用中国科学院青藏高原研究所高寒生态研究室的Agilent 6850型气相色谱仪测定, MIDI Sherlock脂肪酸图谱微生物鉴定系统分析待检样品。
1.4.3 土壤DNA提取和PCR扩增
土壤DNA样品的提取采用AXYGEN公司生产的试剂盒。按照说明书步骤进行提取, 选择AMV4.5NF/AMDGR作为引物[17], 正向引物序列为: 5¢-AAGCTCGTAGTTGAATTTCG-3¢, 反向引物序列5¢-CCCAACTATCCCTATTAATCAT-3¢, 在引物上添加6个bp的样本特异性Barcode序列, 进而对特定基因片段进行PCR扩增。扩增得到的产物通过2%琼脂糖凝胶电泳检测后, 测序及数据质量控制等均由上海派森诺生物科技有限公司完成。
1.5 数据分析及处理
对下机原始数据去除引物接头序列和各低质量碱基(phred Quality Score≤20)后进行拼接, 舍弃长度小于150 bp的序列, 且不允许存在模糊碱基(ambiguous base)N, 并去除非特异性扩增序列及嵌合体后[18], 得到有效序列608 752条。使用QIIME(quantitative insights into microbial ecology, v1.8.0)软件, 调用UCLUST序列比对工具, 对根据质量控制筛选出的优质序列按97%相似度水平的操作分类单元OTU (operational taxonomic units)代表序列进行分类学分析, 构建OTU时选取代表性序列(出现频率最高的序列)得到每个OTU对应的物种分类学信息, 随后, 基于物种分类分析结果, 使用QIIME 1.8软件对样品的Alpha多样性进行分析, 计算AM真菌的Simpson、Shannon、Chao1和ACE多样性指数。
利用Microsoft Excel 2010进行数据整理, DPS 7.05进行方差分析和Turkey多重比较。采用Canoco 5.0软件分析影响土壤AM真菌群落结构及AM真菌多样性的主要土壤理化、生物学性状的环境因子。
2 结果与分析
2.1 冬小麦免耕覆盖与施有机肥对土壤主要微生物类群的影响
土壤微生物是土壤生态系统的重要组成部分, 其种群结构变化在一定程度上能够调节土壤肥力状况及养分供应能力[19]。由表1可见, 随冬小麦免耕种植年限的延长, 土壤主要微生物类群结构组成有不同的变化。与试验开始前(2015年)相比, 连续处理2年后(2017年), 免耕覆盖不施有机肥(NC)处理中, 土壤细菌及G+的生物量显著增加, 而真菌、G-、真菌与细菌比例略有降低。在免耕覆盖施有机肥处理(NF)中, 土壤细菌、真菌、放线菌、真菌/细菌生物量的比值均显著低于试验初期; 而传统耕作不覆盖不施有机肥(TC)中, 细菌、G+和G+/G-生物量的比值均呈现增加趋势, 但差异不显著; 传统耕作不覆盖施有机肥(TF)中, 土壤细菌生物量较试验初期增加了25.12%, 而真菌和放线菌则呈稳定降低趋势, 分别降低了24.39%、0.23%。这可能是由于连续免耕覆盖、有机种植冬小麦后改善了土壤的水热状况, 从而影响了土壤微生态环境条件。总体上, 随栽培年限的延长, 土壤细菌生物量有增加的趋势, 放线菌在年际间的不同处理中无明显变化规律, 而真菌生物量整体呈显著降低的趋势。
免耕覆盖管理2年后, 有机肥管理下以特征脂肪酸表征的土壤细菌、放线菌生物量表现为NC>NF, 真菌则呈相反趋势。TF处理的土壤细菌、真菌、放线菌、真菌/细菌、G+及G-均高于TC处理。TF条件下, 有机肥的施用导致土壤G-差异显著, 比TC处理提高了20.83%; 不施有机肥情况下, 土壤细菌和放线菌生物量的差异虽不显著, 但却呈截然相反趋势, 细菌表现为TC>NC, 放线菌表现为TC
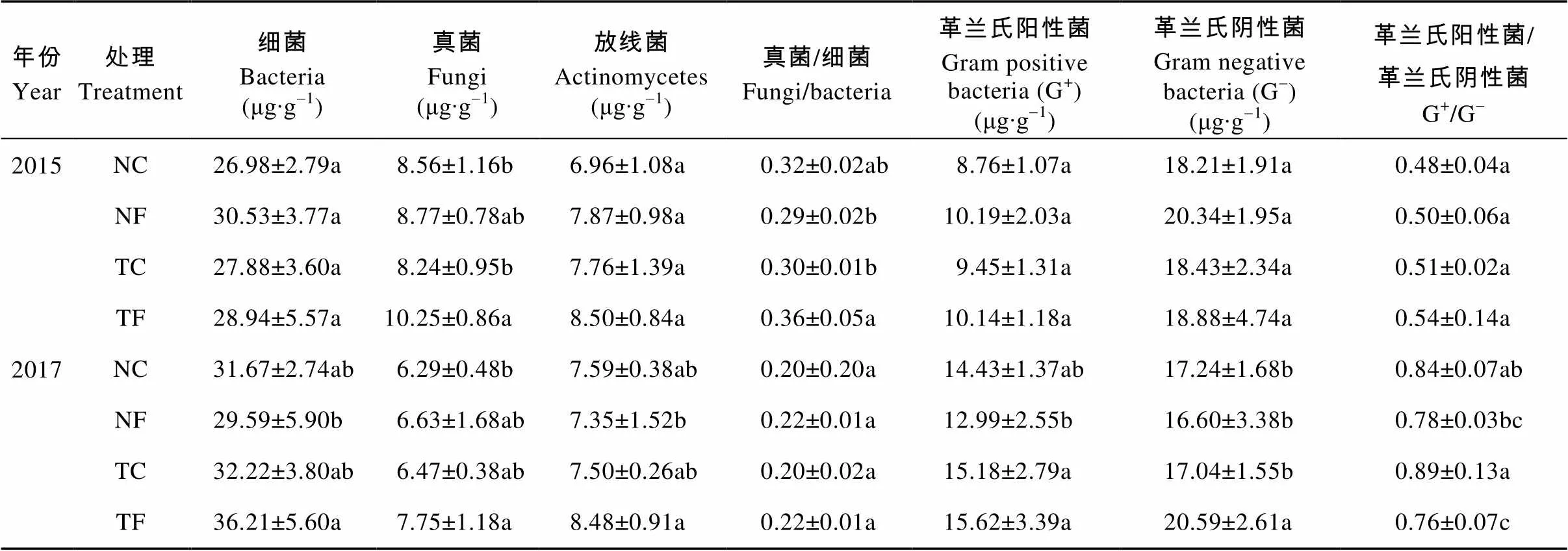
表1 连续免耕覆盖与有机栽培对土壤主要微生物类群的影响
不同小写字母代表不同处理间差异在0.05水平上显著。NC: 免耕覆盖不施有机肥; NF: 免耕覆盖施有机肥; TC: 传统耕作不覆盖不施有机肥; TF: 传统耕作不覆盖施有机肥。Different lowercase letters indicate significant differences among treatments at 0.05 level. NC: no-tillage and straw mulching without organic fertilizer application; NF: no-tillage and straw mulching with organic fertilizer application; TC: traditional tillage and no-mulching without organic fertilizer application; TF: traditional tillage and no-mulching with organic fertilizer application.
2.2 冬小麦免耕覆盖与有机栽培对土壤AM真菌结构组成的影响
由表2可见, 试验初期土壤AM真菌生物量、AM真菌占土壤微生物总PLFA生物量的比值在各处理间无明显差异, 但不施有机肥处理中16:1ω5c中性脂(NLFA)/PLFA的比例均高于施有机肥处理, 表现为TC>TF、NC>NF。连续免耕覆盖与有机栽培2年后(2017年), AM真菌占总PLFA生物量的比值无显著性差异, NC及TC处理中, 有机肥的施用并没有影响土壤中AM真菌磷脂(菌丝体结构脂)生物量; NC与NF, TF与TC之间AM真菌菌丝体的生物量间无明显差异, 而AM真菌中性脂(孢子贮存脂)生物量却表现为NC>NF、TF>TC。这说明免耕覆盖无肥、传统耕作施有机肥结合更有利于土壤AM真菌孢子的繁殖, 能增加以贮存脂形态存在的AM真菌孢子生物量碳的比例。土壤AM真菌总生物量也表现出和AM真菌中性脂相似的趋势; 与NC相比, NF处理以特征脂肪酸表征的AM真菌总生物量显著降低48.71%。在NF管理措施下, AM真菌中性脂(孢子贮存脂)和磷脂(菌丝体结构脂)生物量的比值也表现出显著差异(<0.05)。说明免耕覆盖、不施有机肥及传统耕作施有机肥的交互作用, 能改变土壤中AM真菌菌丝体及孢子中生物量碳的分配比例关系。

表2 连续免耕覆盖有机管理对土壤AM真菌群落结构组成的影响
不同小写字母代表不同处理间差异在0.05水平上显著。NC: 免耕覆盖不施有机肥; NF: 免耕覆盖施有机肥; TC: 传统耕作不覆盖不施有机肥; TF: 传统耕作不覆盖施有机肥。Different lowercase letters indicate significant differences among treatments at 0.05 level. NLFA: neutral lipid acid. NC: no-tillage and straw mulching without organic fertilizer application; NF: no-tillage and straw mulching with organic fertilizer application; TC: traditional tillage and no-mulching without organic fertilizer application; TF: traditional tillage and no-mulching with organic fertilizer application.
2.3 冬小麦免耕覆盖与有机栽培对土壤AM真菌丰富度和多样性的影响
不同处理下土壤AM真菌群落丰富度指数(Chao1和ACE)均表现为TF>TC、NF>NC(表3), 而土壤AM真菌多样性指数(Shannon和Simpson)与丰富度指数(Chao1和ACE)则呈现出完全相反的变化趋势。随有机肥的施用, 免耕和传统耕作处理下Shannon指数分别较不施肥处理下降8.40%和3.67%; 而Simpson指数则较有机肥施用处理分别下降了2.11%和3.26%。同时, 免耕覆盖处理中AM真菌多样性指数(Shannon和Simpso)也明显高于传统耕作处理。但方差分析结果表明, 不同处理间土壤AM真菌多样性及其丰富度指数均无显著性差异。
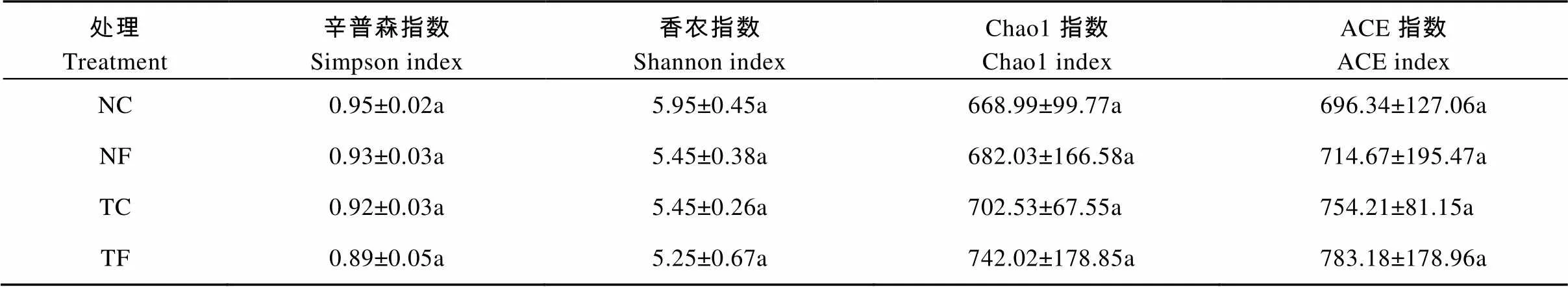
表3 冬小麦免耕栽培对土壤AM真菌丰富度和多样性指数的影响
不同小写字母代表不同处理间差异在0.05水平上显著。NC: 免耕覆盖不施有机肥; NF: 免耕覆盖施有机肥; TC: 传统耕作不覆盖不施有机肥; TF: 传统耕作不覆盖施有机肥。Different lowercase letters indicate significant differences among treatments at 0.05 level. NC: no-tillage and straw mulching without organic fertilizer application; NF: no-tillage and straw mulching with organic fertilizer application; TC: traditional tillage and no-mulching without organic fertilizer application; TF: traditional tillage and no-mulching with organic fertilizer application.
2.4 土壤AM真菌群落结构及AM真菌多样性与土壤理化及生物学性状间的相互关系
土壤AM真菌群落结构与土壤因子在影响微生物群落结构组成的过程中, 彼此存在相互制约的关系。相关性分析表明(表4), 土壤全氮与AM真菌香浓指数呈显著正相关(0.05); 速效钾与AM真菌磷脂脂肪酸显著负相关(<0.05); 脲酶与AM真菌多样性指数(Simpson指数)极显著负相关(<0.01), 与丰富度指数(ACE指数)显著正相关(<0.05); 易提取球囊霉素与土壤AM真菌中性脂生物量、AM真菌总生物量显著正相关(<0.05)。
*和**分别代表0.05和0.01水平显著相关。* and ** respectively represent significant correlations at 0.05 and 0.01 levels.NLFA: neutral lipid acid.
为进一步分析不同土壤理化、生物学性状对土壤AM真菌群落结构及AM真菌多样性的影响, 对AM真菌生物量、多样性指数分别与土壤理化、生物学性状做多元分析, 结果表明(图1a-b): 第1、2排序轴能够分别在累积变量90.48%、4.44%上解释AM真菌与土壤因子的相关性及空间分布的差异性(图1a)。各处理样点空间分散较为明显, 并位于不同象限, 说明不同管理措施下, 土壤因子在影响AM真菌分布的过程中, 彼此存在相互促进或相互制约的复杂关系。图1a显示, 土壤AM真菌磷脂(菌丝体结构脂)与碱性磷酸酶、全磷、有机质、总球囊霉素呈正相关; AM真菌总生物量与土壤有机质和土壤易提取球囊霉素呈正相关, 与土壤碱性磷酸酶活性负相关; AM真菌中性脂(孢子贮存脂)、AM真菌的NLFA/PLFA比值与土壤pH、速效磷和全氮均呈正相关。
对连续冬小麦免耕覆盖有机栽培2年(2017年)后, 不同处理下土壤AM真菌多样性及丰富度与土壤因子进行多元分析。结果显示(图1b)第1排序轴、第2排序轴分别在累积变量为41.45%和28.65%上解释了不同处理间AM真菌多样性、丰富度的空间变化; 假设性测验结果表明(pseudo-=4.8,=0.006), 所有排序轴都是极显著的; 第1排序轴对免耕覆盖、有机栽培管理影响下的AM真菌丰富度累积差异变化解释最多。与NC相比, TF和NF处理的AM真菌在空间分布上有明显分散。土壤中的有机质、全氮、总球囊霉素与土壤AM真菌丰富度指数(ACE和Chao1)呈正相关; 土壤全磷与AM真菌的丰富度指数和多样性指数均呈负相关关系, 这说明土壤全磷含量的高低会抑制AM真菌多样性和丰富度, 而外源有机碳的施入, 有利于增加AM真菌的丰富度。此外, AM真菌多样性指数(Shannon与Simpson)与全氮、碱解氮和速效钾呈正相关, 且土壤速效钾、碱解氮、全氮含量的高低也是影响AM真菌多样性的主要驱动因子。
TN、TP、AP、AN、AK和OM分别指土壤全氮、全磷、有效磷、碱解氮、速效钾和有机质; URE、ALP、CAT、EE-GRSP、T-GRSP分别指脲酶、碱性磷酸酶、过氧化氢酶、易提取球囊霉素、总球囊霉素; AMN、AMP、AMT、NLFA/PLFA分别指AM真菌中性脂、AM真菌磷脂脂肪酸、AM真菌总生物量、中性脂与磷脂脂肪酸的比值; Chao1、ACE、Shannon、Simpson分别指Chao1指数、ACE指数、香浓指数和辛普森指数。图中各形状代表不同采样点。NC表示免耕不施肥的3个重复(1~3), NF表示免耕施肥的3个重复(1~3), TC表示传统耕作不施肥的3个重复(1~3), TF表示传统耕作施肥的3个重复(1~3)。TN, TP, AP, AN, AK and OM refer to total nitrogen, total phosphorus, available phosphorus, available nitrogen, available potassium and organic matter; URE, ALP, CAT, EE-GRSP, T-GRSP refer to urease, alkaline phosphatase, catalase, easily extracted glomalin and total extracted glomalin; AMN, AMP, AMT, NLFA/PLFA refer to AM fungi neutral lipid acid, AM fungi phospholipid acid, AM fungi total biomass, neutral lipid acid and phospholipid acid ratio; Chao1, ACE, Shannon and Simpson refer to Chao 1 index, ACE index, Shannon index, and Simpson index, respectively. Each shape in the figure represents a sample. NC represents three replicates of treatment of no-tillage and straw mulching without organic fertilizer application (1-3), NF represents three replicates of treatment of no-tillage and straw mulching with organic fertilizer application (1-3), and TC represents three replicates of treatment of traditional tillage and no-mulching without organic fertilizer application (1-3), TF shows three replicates of treatment of traditional tillage and no-mulching with organic fertilizer (1-3).
3 讨论
3.1 免耕覆盖和施用有机肥对土壤主要微生物类群组成的影响
不同种类微生物特征PLFA的组成和含量的差异, 可用来直接评价土壤微生物群落结构[20]。土壤微生物群落结构越复杂、物种越丰富, 则土壤生态系统越稳定, 系统的生态功能性越高[21]。何玉梅等[22]研究表明, 传统耕作在一定程度上加快了养分矿化速度, 增强了土壤中真菌的活性, 使真菌生物量显著增加, 这与本试验中传统耕作施用(TF)或不施用(TC)有机肥下真菌生物量均高于对应的免耕覆盖处理一致。而Mathew等[20]研究指出, 土壤真菌、细菌、真菌/细菌、G+/G-的比值在0~5 cm土层中, 传统耕作处理显著高于免耕处理, 而5~15 cm土层的趋势却相反, 与本研究结果不一致。本研究发现, 0~20 cm土层, 以特征PLFA表征的细菌、真菌、真菌/细菌和G+/G-的比值均表现为传统耕作施肥(TF)显著高于免耕覆盖施肥(NF), 产生这种差异的原因可能是由于传统耕翻处理中, 植物残体、施入的有机肥随人为耕翻扰动而均匀地分布于耕作层中, 为土壤微生物的生长繁殖提供了丰富的可利用资源, 从而促进了土壤微生物的繁殖和代谢[23]。但胡娜[24]的研究指出, 长年免耕会对细菌产生抑制作用, 但短期试验系统下, 多数研究认为传统耕作会对细菌产生轻度抑制, 而通常情况下传统耕作会减少土壤中微生物总量。由此可见, 免耕覆盖更有利于土壤中微生物群落结构的增加。
此外, 相关研究认为, 免耕显著降低了真菌占细菌的比例, 主要是由于短期免耕降低了土壤生态缓冲能力, 降低了真菌的生物量。而秸秆还田则显著提高了真菌与细菌生物量的比值[25], 主要是因为外源有机碳的输入, 改善了微生物栖息环境, 提高了土壤生态缓冲能力, 为真菌的繁殖创造了有利的条件[26]。
3.2 免耕覆盖和施用有机肥下的土壤AM真菌多样性与土壤环境因子之间的相互关系
农田生态系统中AM真菌群落结构会受到耕作措施等诸多因素的影响[27]。试验结果表明, 随免耕年限的延长, 土壤AM真菌总生物量、AM真菌中性脂(孢子体)的生物量整体呈增加趋势, 而AM真菌磷脂(菌丝体)生物量整体有降低趋势。相关研究表明, 这主要是由于施有机肥对AM真菌生长及孢子繁殖会产生正效应, 对菌丝会产生负效应的缘故[28]。也有学者研究发现, AM真菌结构组成主要受不同土层深度的影响, 而不受农业生态系统管理活动的影响[29]。但Qin等[30]认为, 长期向农田施化肥会直接影响土壤AM真菌生物量及AM真菌占总磷脂脂肪酸的比例, 增加AM真菌孢子生物量。本试验中, 传统耕作施有机肥(TF)增加了AM真菌磷脂(菌丝体)生物量及AM真菌占微生物总PLFA的比值, 而免耕覆盖不施有机肥(NC)却降低了两者的生物量, 这与之前的研究结果并不完全相同。这些相互矛盾的研究结果说明, 土壤AM真菌的孢子萌发和菌丝生长很可能是由诸多环境因素(如: 耕作方式、施肥类型、覆盖方式、土层深度)等综合作用的结果, 而不是单一因素制约的结果。
AM真菌对外来扰动比较敏感, 通常被视作农业系统可持续发展中土壤肥力的重要潜在指标[31]。农田生态系统中, AM真菌群落组成的改变以及多样性的降低, 是区域耕作措施、施肥方式以及植保技术等方面的综合反映[32]。农业管理活动不仅会减少AM真菌丰富度, 而且会影响AM真菌多样性, 导致土壤微生物群落结构发生改变[27]。Gajda等[33]发现, 与传统耕作相比, 在麦秆覆盖情况下, 少耕增加了AM真菌多样性, 其分析认为是由于少耕使整个土壤剖面的含水量增加、易分散黏土含量降低、表层土壤稳定性提高, 有利于土壤AM真菌的生长。14年保护性耕作条件下的AM真菌多样性研究结果表明, 免耕土壤中的AM真菌多样性显著高于耕作处理[34], 在不扰动情况下, 土壤中AM真菌多样性更高, 土壤扰动与AM真菌多样性降低有关[35]。可见, 实施保护性耕作措施的时间越长, 越有利于AM真菌多样性的提高。这与本研究结果有一致的地方。而Shen等[36]却发现, 传统耕作措施下, 不同覆盖方式和有机无机肥配施均可以显著增加AM真菌的多样性指数。但本试验中, 免耕覆盖增加了AM真菌多样性却降低了丰富度; 同时, 施用有机肥促进了AM真菌丰富度的升高, 降低了多样性指数。但不同处理之间, AM真菌丰富度、多样性之间并无显著性差异。分析认为, 有机肥施用对AM真菌丰富度和多样性所产生的效应可能与持续免耕覆盖、有机肥管理及传统耕作时间的长短有一定的关系。此外, Xiang等[37]和Hazard等[38]指出不同时空尺度下气候因子(如: 温度、降水等)和土壤理化因子(如: pH、有效磷、土壤有机质等)也会对土壤AM真菌群落结构产生重要影响。如宋福强等[39]指出氮施加会显著降低土壤pH, 进而对土壤中AM真菌群落的多样性和均匀度产生影响, 但不同AM真菌对土壤pH的响应也各不相同。
为探究影响AM真菌群落结构及AM真菌多样性的主要环境因子, 绘制多元分析图, 发现土壤AM真菌生物量、丰富度指数均与土壤有机质、易提取球囊霉素有正相关关系。这可能是由于土壤有机质的组成成分与生态系统中的物质循环及土壤中各类生物的活性有关[40]。此外, 本研究并没有发现全磷会对AM真菌多样性产生显著影响, 这与Šmilauer[41]认为土壤磷与AM真菌群落结构或多样性并没有显著相关关系是一致的。但与以往的大多数施磷肥对AM真菌研究结果存在相互矛盾[42-43]。如Hijri等[44]发现AM真菌群落多样性与土壤磷含量呈显著对应, 且Shannon指数随着磷含量的增加而减少。根系中AM真菌丰度也随之显著减少(<0.05),但与土壤中AM真菌丰度和Chao多样性不相关[45]。另外, 碱性磷酸酶直接表征AM真菌磷代谢活力[46]且与AM真菌群落Shannon指数呈显著正相关[47], 与本试验结果不一致, 具体原因需进一步探究。因此, 作为植物与土壤环境之间沟通的桥梁, AM真菌群落结构必然会受到植物和土壤因子的直接或间接影响, 但AM真菌无论是以单一物种存在, 还是以生态系统中不同物种群落存在, 土壤氮、磷的有效性都应该是AM真菌群落结构和功能的重要驱动因素; 持续免耕覆盖栽培管理过程中, 土壤理化性质、生物学特性的改变应该是导致土壤微生物群落结构及AM真菌多样性变化的重要因素。
4 结论及展望
免耕覆盖栽培显著增加了以特征PLFA表征的土壤细菌和G+生物量; 随免耕覆盖年限延长, 土壤AM真菌总生物量提高。免耕覆盖、有机栽培管理措施通过改变AM真菌菌丝及孢子中生物量碳的分配比例关系而影响AM真菌的生物量特征。与传统耕作相比, 免耕覆盖措施提高了土壤AM真菌多样性指数, 降低了丰富度指数; 而传统耕作在有机肥施用下却使AM真菌丰富度提高、多样性降低。土壤微生物群落结构及AM真菌多样性变化受农业管理措施导致的土壤理化及生物学性状差异等综合因素的影响。
总之, 目前虽然关于农田、森林、草原、荒漠以及重金属污染等土壤中AM真菌群落结构与功能进行了广泛的关注, 但农田生态系统受人为耕种措施的扰动最大, 使得AM真菌根外菌丝生物量、孢子密度以及群落组成和多样性等对不同耕种措施的响应变得敏感而复杂, 进而影响作物共生体的效应。因此, 无论是从研究方法还是研究内容上关于以免耕为主的保护性耕作措施对土壤主要微生物群落及AM真菌群落结构的影响仍存在很多值得进一步探讨的问题。
[1] FRANZLUEBBERS A J. Soil organic matter stratification ratio as an indicator of soil quality[J]. Soil and Tillage Research, 2010, 66(2): 95–106
[2] 谭周进, 周卫军, 张杨珠, 等. 不同施肥制度对稻田土壤微生物的影响研究[J]. 植物营养与肥料学报, 2007, 13(3): 430–435 TAN Z J, ZHOU W J, ZHANG Y Z, et al. Effect of fertilization systems on microbes in the paddy soil[J]. Plant Nutrition and Fertilizer Science, 2007, 13(3): 430–435
[3] MÄDER P, BERNER A. Development of reduced tillage systems in organic farming in Europe[J]. Renewable Agriculture and Food Systems, 2012, 27(1): 7–11
[4] 孙建, 刘苗, 李立军, 等. 不同施肥处理对土壤理化性质的影响[J]. 华北农学报, 2010, 25(4): 221–225 SUN J, LIU M, LI L J, et al. The effect of different fertilization treatments on soil physical and chemical property[J]. Acta Agriculturae Boreali-Sinica, 2010, 25(4): 221–225
[5] 王改兰, 段建南, 贾宁凤, 等. 长期施肥对黄土丘陵区土壤理化性质的影响[J]. 水土保持学报, 2006, 20(4): 82–85 WANG G L, DUAN J N, JIA N F, et al. Effects of long-term fertilization on soil physical and chemical property in loess hilly area[J]. Journal of Soil and Water Conservation, 2006, 20(4): 82–85
[6] MARSCHNER P, KANDELER E, MARSCHNER B. Structure and function of the soil microbial community in a long-term fertilizer experiment[J]. Soil Biology and Biochemistry, 2003, 35(3): 453–461
[7] LI P, LI Y C, ZHENG X Q, et al. Rice straw decomposition affects diversity and dynamics of soil fungal community, but not bacteria[J]. Journal of Soils and Sediments, 2018, 18(1): 248–258
[8] 朱晨. 不同施肥制度对主要农作物土壤中AMF群落结构的影响[D]. 南京: 南京农业大学, 2016 ZHU C. Effects of different fertilization on community structure of AMF in major farmland cropssoils[D]. Nanjing: Nanjing Agricultural University, 2016
[9] HILL J O, SIMPSON R J, RYAN M H, et al. Root hair morphology and mycorrhizal colonisation of pasture species in response to phosphorus and nitrogen nutrition[J]. Crop and Pasture Science, 2010, 61(2): 122–131
[10] LI T, HU Y J, HAO Z P, et al. First cloning and characterization of two functional aquaporin genes from an arbuscular mycorrhizal fungus[J]. New Phytologist, 2013, 197(2): 617–630
[11] ROBINSON C H. Mycorrhizal symbiosis, 2nd edn. by S. E. Smith, D. J. Read[J]. Journal of Ecology, 1997, 85(6): 925–926
[12] 张贵云, 张丽萍, 魏明峰, 等. 长期保护性耕作对丛枝菌根真菌多样性的影响[J]. 中国生态农业学报, 2018, 26(7): 1048–1055 ZHANG G Y, ZHANG L P, WEI M F, et al. Effect of long-term conservation tillage on arbuscular mycorrhizal fungi diversity[J]. Chinese Journal of Eco-Agriculture, 2018, 26(7): 1048–1055
[13] KABIR Z, O'HALLORAN I P, WIDDEN P, et al. Vertical distribution of arbuscular mycorrhizal fungi under corn (L.) in no-till and conventional tillage systems[J]. Mycorrhiza, 1998, 8(1): 53–55
[14] SCHNOOR T K, LEKBERG Y, ROSENDAHL S, et al. Mechanical soil disturbance as a determinant of arbuscular mycorrhizal fungal communities in semi-natural grassland[J]. Mycorrhiza, 2011, 21(3): 211–220
[15] 鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000: 1–329 BAO S D. Soil and Agricultural Chemistry Analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2000: 1–329
[16] 魏常慧, 刘亚军, 冶秀香, 等. 马铃薯/玉米间作栽培对土壤和作物的影响[J]. 浙江大学学报: 农业与生命科学版, 2017, 43(1): 54–64 WEI C H, LIU Y J, YE X X, et al. Effects of intercropping potato with maize on soil and crop[J]. Journal of Zhejiang University: Agriculture & Life Sciences, 2017, 43(1): 54–64
[17] SATO K, SUYAMA Y, SAITO M, et al. A new primer for discrimination of arbuscular mycorrhizal fungi with polymerase chain reaction-denature gradient gel electrophoresis[J]. Grassland Science, 2005, 51(2): 179–181
[18] FADROSH D W, MA B, GAJER P, et al. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform[J]. Microbiome, 2014, 2(1): 6
[19] 徐恒. 榆林沙区人工固沙林土壤养分、微生物数量和酶活性研究[D]. 杨凌: 西北农林科技大学, 2008 XU H. Soil nutrient, microorganism and enzyme activities under different artificial sand-fixing forests in the Yulin sand area[D]. Yangling: Northwest A&F University, 2008
[20] MATHEW R P, FENG YC, GITHINJI L, et al. Impact of no-tillage and conventional tillage systems on soil microbial communities[J]. Applied and Environmental Soil Science, 2012, 2012: 548620
[21] 李雪静, 徐天乐, 陈保冬, 等. 荒漠和草原生态系统丛枝菌根真菌多样性和群落结构[J]. 生态学杂志, 2017, 36(10): 2734–2743 LI X J, XU T L, CHEN B D, et al. Diversity and community structure of arbuscular mycorrhizal fungi in desert and steppe ecosystems[J]. Chinese Journal of Ecology, 2017, 36(10): 2734–2743
[22] 何玉梅, 张仁陟, 张丽华, 等. 不同耕作措施对土壤真菌群落结构与生态特征的影响[J]. 生态学报, 2007, 27(1): 113–119 HE Y M, ZHANG R Z, ZHANG L H, et al. Effects of different tillage practices on fungi community structure and ecologic characteristics in loess soils[J]. Acta Ecologica Sinica, 2007, 27(1): 113–119
[23] 李玉洁, 王慧, 赵建宁, 等. 耕作方式对农田土壤理化因子和生物学特性的影响[J]. 应用生态学报, 2015, 26(3): 939–948 LI Y J, WANG H, ZHAO J N, et al. Effects of tillage methods on soil physicochemical properties and biological characteristics in farmland: A review[J]. Chinese Journal of Applied Ecology, 2015, 26(3): 939–948
[24] 胡娜. 免耕对土壤特性的影响[J]. 河南农业, 2018, (19): 20 HU N. Effects of no-till on soil properties[J].Henan Nongye, 2018, 19: 20
[25] 郭梨锦, 曹凑贵, 张枝盛, 等. 耕作方式和秸秆还田对稻田表层土壤微生物群落的短期影响[J]. 农业环境科学学报, 2013, 32(8): 1577–1584 GUO L J, CAO C G, ZHANG Z S, et al. Short-term effects of tillage practices and wheat-straw returned to rice fields on topsoil microbial community structure and microbial diversity in Central China[J]. Journal of Agro-Environment Science, 2013, 32(8): 1577–1584
[26] 强学彩, 袁红莉, 高旺盛. 秸秆还田量对土壤CO2释放和土壤微生物量的影响[J]. 应用生态学报, 2004, (3): 469–472 QIANG X C, YUAN H L, GAO W S. Effect of crop-residue incorporation on soil CO2emission and soil microbial biomass[J]. Chinese Journal of Applied Ecology, 2004, 15(3): 469–472
[27] BRITO I, GOSS M J, DE CARVALHO M, et al. Impact of tillage system on arbuscular mycorrhiza fungal communities in the soil under Mediterranean conditions[J]. Soil and Tillage Research, 2012, 121: 63–67
[28] MATHIMARAN N, RUH R, JAMA B, et al. Impact of agricultural management on arbuscular mycorrhizal fungal communities in Kenyan ferralsol[J]. Agriculture, Eco-systems & Environment, 2007, 119(1/2): 22–32
[29] QIN H, CHEN J H, WU Q F, et al. Intensive management decreases soil aggregation and changes the abundance and community compositions of arbuscular mycorrhizal fungi in Moso bamboo () forests[J]. Forest Ecology and Management, 2017, 400: 246–255
[30] QIN H, LU K P, STRONG P J, et al. Long-term fertilizer application effects on the soil, root arbuscular mycorrhizal fungi and community composition in rotation agriculture[J]. Applied Soil Ecology, 2015, 89: 35–43
[31] BENDING G D, TURNER M K, RAYNS F, et al. Microbial and biochemical soil quality indicators and their potential for differentiating areas under contrasting agricultural management regimes[J]. Soil Biology and Biochemistry, 2004, 36(11): 1785–1792
[32] 张贵云. 不同农业措施对丛枝菌根真菌群落结构和侵染效应的影响[D]. 南京: 南京农业大学, 2013 ZHANG G Y. Effects of different agricultural measures on community structure and colonization rate of arbuscular mycorrhizal fungi[D]. Nanjing: Nanjing Agricultural University, 2013
[33] GAJDA A M, CZYŻ E A, DEXTER A R, et al. Effects of different soil management practices on soil properties and microbial diversity[J]. International Agrophysics, 2018, 32(1): 81–91
[34] 高萍, 闫飞扬, 蒙程, 等. 黄土高原不同耕作措施下AM真菌的多样性[J]. 草业科学, 2016, 33(10): 1917–1923 GAO P, YAN F Y, MENG C, et al. Diversity of arbuscular mycorrhizal fungi under different agricultural practices in Loess Plateau in China[J]. Pratacultural Science, 2016, 33(10): 1917–1923
[35] ALGUACIL M M, LUMINI E, ROLDÁN A, et al. The impact of tillage practices on arbuscular mycorrhizal fungal diversity in subtropical crops[J]. Ecological Applications, 2008, 18(2): 527–536
[36] SHEN Y F, CHEN Y Y, LI S Q. Microbial functional diversity, biomass and activity as affected by soil surface mulching in a semiarid farmland[J]. PLoS One, 2016, 11(7): e0159144
[37] XIANG D, VERESOGLOU S D, RILLIG M C, et al. Relative importance of individual climatic drivers shaping arbuscular mycorrhizal fungal communities[J]. Microbial Ecology, 2016, 72(2): 418–427
[38] HAZARD C, GOSLING P, VAN DER GAST C J, et al. The role of local environment and geographical distance in determining community composition of arbuscular mycorrhizal fungi at the landscape scale[J]. The ISME Journal, 2013, 7(3): 498–508
[39] 宋福强, 刘宇飞, 范晓旭. 耕种措施对农田生态系统AM真菌群落结构的影响[J]. 菌物学报, 2018, 37(8): 988–998SONG F Q, LIU Y F, FAN X X. Effects of cultivation measures on AM fungal community structure in agro-ecological system[J]. Mycosystema, 2018, 37(8): 988–998
[40] ALGUACIL M M, TORRECILLAS E, LOZANO Z, et al. Arbuscular mycorrhizal fungi communities in a coral cay system (Morrocoy, Venezuela) and their relationships with environmental variables[J]. Science of the Total Environment, 2015, 505: 805–813
[41] ŠMILAUER P. Communities of arbuscular mycorrhizal fungi in grassland: seasonal variability and effects of environment and host plants[J]. Folia Geobotanica, 2001, 36(3): 243–263
[42] KAHILUOTO H, KETOJA E, VESTBERG M, et al. Promotion of AM utilization through reduced P fertilization 2. Field studies[J]. Plant and Soil, 2001, 231(1): 65–79
[43] JANSA J, OBERHOLZER H R, EGLI S. Environmental determinants of the arbuscular mycorrhizal fungal infectivity of Swiss agricultural soils[J]. European Journal of Soil Biology, 2009, 45(5/6): 400–408
[44] HIJRI I, SÝKOROVÁ Z, OEHL F, et al. Communities of arbuscular mycorrhizal fungi in arable soils are not necessarily low in diversity[J]. Molecular Ecology, 2006, 15(8): 2277–2289
[45] DE LEÓN D G, CANTERO J J, MOORA M, et al. Soybean cultivation supports a diverse arbuscular mycorrhizal fungal community in central Argentina[J]. Applied Soil Ecology, 2017, 124: 289–297
[46] BOLDT-BURISCH K, NAETH M A. Heterogeneous soil conditions influence fungal alkaline phosphatase activity in roots of[J]. Applied Soil Ecology, 2017, 116: 55–63
[47] GUO Y J, DU Q F, LI G D, et al. Soil phosphorus fractions and arbuscular mycorrhizal fungi diversity following long-term grazing exclusion on semi-arid steppes in Inner Mongolia[J]. Geoderma, 2016, 269: 79–90
Effects of no-tillage, mulching and organic fertilization on soil microbial composition in winter wheat field*
WANG Xiaoling1,2, MA Kun1**, WANG Zhiqin1,2, LI Yue2, WEI Changhui2
(1. College of Agronomy, Ningxia University, Yinchuan 750021, China; 2.National Key Laboratory Breeding Base of Northwest Land Degradation and Ecological Restoration, Ningxia University, Yinchuan 750021, China)
Soil micro-organisms constitute a significant part of soil fertility and play a critical role in maintaining soil ecological functions. Micro-organisms also are key indicators for soil quality and productivity. No-tillage and mulching cultivation indirectly affect the composition of soil microbial community by changing plant physiological characteristics and root exudates. The two agronomic practices can also improve soil environment by increasing the total amount of micro-organisms in the soil. By analyzing the composition of soil microbial community under no-tillage, mulching and organic cultivation of winter wheat in the southern mountain areas of Ningxia, the effects of agricultural management activities on soil microbial community structure and arbuscular mycorrhizal (AM) fungal diversity were determined in this paper. The study aimed at providing theoretical basis for the promotion of long-term no-tillage, mulching cultivation, sustainable use of farmlands and maintenance of soil microbial diversity. Short-term test on conservation tillage (no-tillage) was done for three consecutive years in Longde County, Guyuan. Four soil treatments were selected including no-tillage and straw mulching without organic fertilizer application (NC), no-tillage and straw mulching with organic fertilizer application (NF), traditional tillage and no-mulching without organic fertilizer application (TC) and traditional tillage and no-mulching with organic fertilizer application (TF). By using Illumina Miseq high-throughput sequencing platform and phospholipid fatty acids (PLFAs) analysis methods, soil microbial community composition, AM fungi community composition and diversity and soil environmental factors were analyzed after three years cultivation of winter wheat. The results showed that continuous no-tillage, mulching and organic fertilizer application increased soil microbial community biomass characterized by PLFA. Traditional tillages significantly improved microbial community biomass (< 0.05) of gram-positive (G+) and negative (G-) bacteria in the soil. With increasing years of management of no-tillage and straw mulching, soil AM fungi biomass significantly increased. Also biomass ratios of 16:1ω5c neutral lipid (NLFA) to 16:1ω5c phospholipid lipid (PLFA) significantly increased (< 0.05). Under no-tillage and straw mulching, the application of organic fertilizer increased soil AM fungi richness index (Chao1 index and ACE index), but reduced soil AM fungi diversity (Shannon index and Simpson index). The results of principal component analysis showed that biomass of AM fungal spores (16:1ω5 c neutral fat) was positively correlated with soil contents of organic matter, and easily extracted glomalin. While AM fungi richness index was positively correlated with soil organic matter content, AM fungi diversity index was positively correlated with soil total nitrogen content and urease activity. AM fungi richness and diversity were affected by soil physical and chemical properties and soil biological differences. Also soil microbial biomass changed along with AM fungal diversity and richness. It was concluded that no-tillage and straw mulching cultivation increased soil AM fungi diversity. The proportion of NLFA to PLFA biomass of AM fungi was also significantly affected by the application of organic fertilizer, and changed distribution of biomass carbon between AM fungi spores and mycelium.
No-tillage and straw mulching; Organic cultivation; Winter wheat; Microbial community; Arbuscular mycorrhizal fungi (AMF); Environmental factors
, E-mail: makun0411@163.com
Jun. 24, 2018;
Sep. 30, 2018
S314
A
2096-6237(2019)02-0267-10
10.13930/j.cnki.cjea.180583
* 国家自然科学基金项目(31660132, 31160104)和宁夏高等学校一流学科建设项目(NXYLXK2017B06)资助
马琨, 研究方向为农田生态学和土壤微生物生态学。E-mail: makun0411@163.com
王小玲, 研究方向为农业生态学。E-mail: 928176524@qq.com
2018-06-24
2018-09-30
* This study was supported by the National Natural Science Foundation of China (31660132, 31160104) and the First-class Discipline Construction Project of Colleges and Universities in Ningxia (NXYLXK2017B06).
王小玲, 马琨, 汪志琴, 李越, 魏常慧. 冬小麦免耕覆盖与有机栽培对土壤微生物群落组成的影响[J]. 中国生态农业学报(中英文), 2019, 27(2): 267-276
WANG X L, MA K, WANG Z Q, LI Y, WEI C H. Effects of no-tillage, mulching and organic fertilization on soil microbial composition in winter wheat field[J]. Chinese Journal of Eco-Agriculture, 2019, 27(2): 267-276

