儿茶酚胺浓度及β1—肾上腺素受体基因多态性与最大有氧能力的关联性
乐晓卉, 孙忠芹, 陈洪魁, 杨留才,王 瑾, 仲 卫, 史卫红, 刘 爽
(1.盐城工学院 体育学院,江苏 盐城 224000;2.盐城体育运动学校 训练系,江苏 盐城 224000;3.江苏医药职业学院 体育部等,江苏 盐城 224005;4.黑龙江佳木斯大学 基础医学院,黑龙江 佳木斯 154000)
遗传因素在运动员选才中的应用已受广泛重视,目前主要集中在血管紧张素原基因、腺苷-磷酸脱氨酶1、低氧诱导因子1α、α辅肌动蛋白3等基因,而肾上腺素受体基因(adrenergic receptor,AR)的相关研究仅局限在β2和β3,但其主要分别存在于呼吸系统和脂肪组织中,而β1肾上腺素受体基因(β adrenergic receptor,β1AR)主要分布在心肌细胞中[1-4],其通过改变Gs蛋白与β1AR结合部位产生功能效应[5],按照对有氧运动能力起主要作用的骨骼肌来说,心肌供血比呼吸和脂肪作用更大,而检索PUB-Med和CNKI,未见相关报道。
因此,本研究采用盐城市的运动员和体育专业的学生作为样本,比较有氧运动能力与血浆儿茶酚胺浓度的相关性,探讨β1AR 49、389位蛋白质的密码子SNPS及其与有氧运动能力的关联性,为运动员的基因选才研究提供基础数据。
1 研究对象与方法
1.1 研究对象
选择盐城运动学校、盐城师范学院体育专业学生为实验组,对照组为同时期同地区的非体育专业未经任何专业训练的健康学生,均为汉族,并征得本人或家长同意,所有受试者签署知情同意书,两组试验过程中均无脱落(脱落者删除),其基线资料分析如表1所示,其年龄、性别、身高和BMI差异无统计学意义(P>0.05),具可比性。
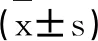
表1 二组基线资料比较表
注:▲与实验组男相比◆与实验组女相比
1.2 仪器和试剂
微量高速离心机(北京鼎昊源MicroSmart),生物安全柜(青岛海尔HR40-II A2),漩涡混合器(江苏海门其林贝尔XW-80A),掌上型迷你离心机(海门其林贝尔LX-400),全自动凝胶成像分析系统(ChampGelTM5000),全自动酶标仪(美国BIO-RAD);无核酸酶水、Goldstar Best MasterMix、无水乙醇、血液基因组柱式小提试剂盒和蛋白酶K(均为北京康为世纪),人儿茶酚胺酶联免疫试剂盒(武汉新启迪生物科技有限公司),琼脂糖、电泳缓冲液(上海兰卫检验实验室)。
1.3 研究方法
1.3.1 运动方式 采用吴剑[6]法,实验组和对照组均采用德国Ergoline 1200EL有氧功率车,方式为卧式蹬车的递增定量负荷运动,以起始负荷50W和60r/min的频率开始蹬车,每3分钟增加负荷50W,直至力竭,平卧恢复3分钟。
1.3.2 血样品采集 所有实验组和对照组均于运动结束即时抽取外周血3m1,放置至-80℃冰箱冻存。
1.3.3 ELISA法测定血浆中儿茶酚胺含量 根据儿茶酚胺含量测定试剂盒说明书进行操作,结果采用标准液进行倍比稀释后,同法操作测定,用酶标仪在450nm测定吸光度值,制作标准曲线(如图1);各样品同法得到的吸光值,在标准曲线上找出对应的浓度。
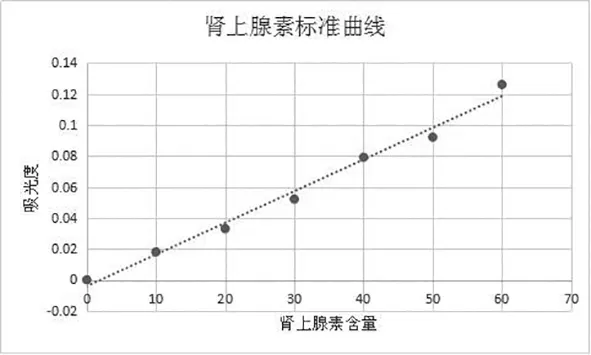
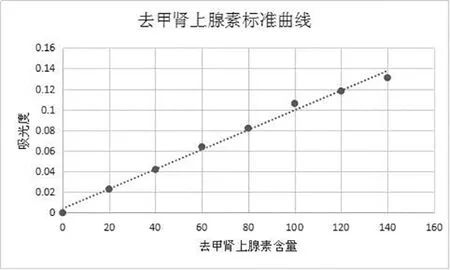
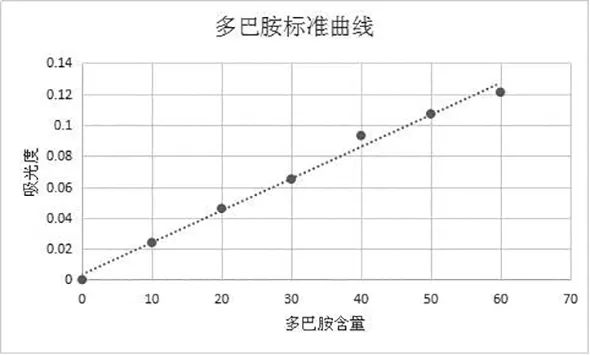
图1 儿茶酚胺类物质浓度测定标准曲线图
1.3.4 基因操作 1.3.4.1 DNA提取 取外周静脉全血EDTA抗凝,分离白细胞,酚/氯仿法提取基因组DNA,利用ND-1000紫外/可见分光光度计测定DNA质量和浓度,并放置在-80℃冰箱冻存。
1.3.4.2 β1AR基因扩增 用Primer 3.0在线软件设计引物进行PCR-RFLP,β1AR基因49位点上游引物为5’-CCUUUGTTCTUUUUTUTTCC-3’,下游引物为5’-UUCUAUUTUATUUCUA UUTAUC-3’,片段大小562bp;β1-AR基因389位点上游引物为5’-CATCATUUUCUTCTT CACUC-3’,下游引物为5’-TUUUCTTCUAUTTCA CCTUC-3’,片段大小547bp。PCR扩增体系:2×Goldstar Best Master Mix 15μ1,10μM引物2μl,模板100ng,补充ddH2O至总体积30μ1,置ABI2720热循环仪(美国)中,反应条件:循环1次(99℃10min,98℃30sec),循环38次(60℃45 sec,72℃90sec)。
1.3.4.3 酶切 β-AR基因49位点PCR产物,采用NEB公司(美国)的限制性内切酶Eco O109I在37℃下水浴中酶切8h;β-AR基因389位点PCR产物,采用NEB公司(美国)的限制性内切酶BcgI在37℃下水浴中酶切4h。
1.3.4.4电泳 两种酶切产物,各取3μ1,以100bp DNA为Marker,5%琼脂糖凝胶电泳时间45分钟(电压90V),然后在紫外线灯下显色观察。
1.3.4.5 进行质谱检测,并收集数据 基质辅助激光解析电离飞行时间质谱(Matrix-assisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF MS)反应;Typer 4.0软件检测质谱峰,并根据质谱峰图判读各样本目标位点基因型。
1.4 运动能力检测
采用高炳宏[7]一口气接一口气法,运用心肺功能测试仪(Cortex Biophysik,德国产)测试,每10s连续记录气体代谢的各项指标,包括平均体重最大耗氧量(VO2max/kg)、最大二氧化碳排出量(VCO2max)、最大呼吸商(respiratory quotient,RQmax)、最大通气量(Maximal voluntary ventilation,MVV),最大呼吸频率(Respiratory frequency,RFmax)、最大氧脉搏(O2Plusemax),最大功率(Pmax),最大运动时间(Tmax)、最大负荷的工作时间(Wmax-T),并测定运动后即刻、运动后3min和恢复后心率。
1.5 数据处理
2 结果
2.1儿茶酚胺类物质浓度比较
实验组和对照组儿茶酚胺类物质浓度比较如表2所示,运动后肾上腺素、去甲肾上腺素和多巴胺浓度,实验组均高于对照组,同性别相比,实验组亦均高于对照组,差异具有统计学意义(P<0.05)。
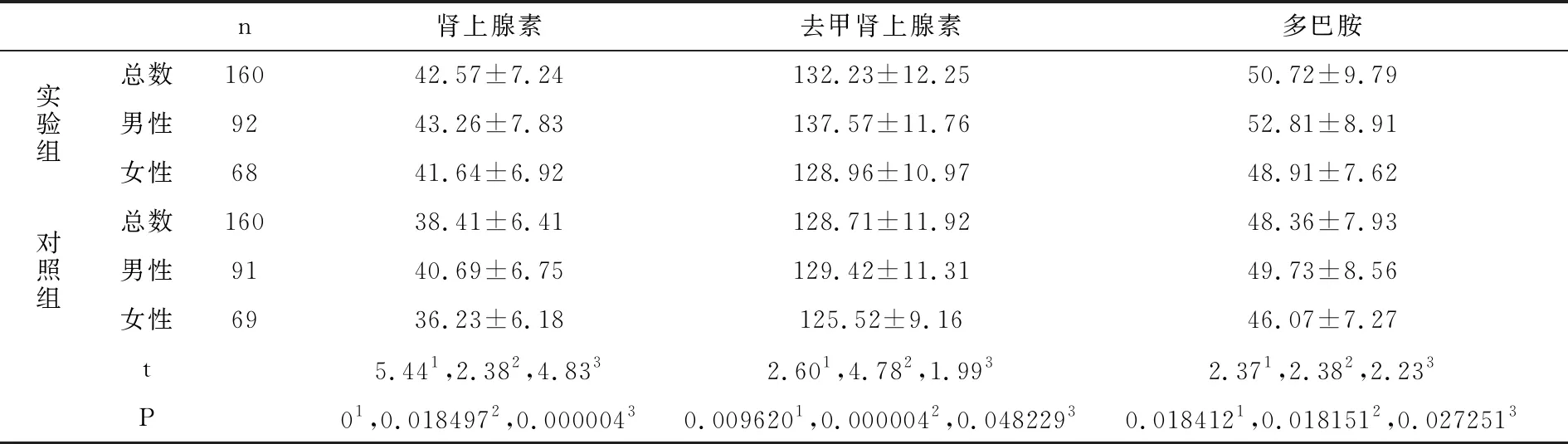
表2 儿茶酚胺类物质浓度比较表(pg/ml,均数±标准差)
注:1总数相比,2男性相比 3女性相比
2.2 β1AR基因PCR扩增检测结果
根据刘建华[1]的研究,β1AR的Ser49Gly基因多态性:Ser49Ser对应碱基为AA,Ser49Gly对应AG,GIy49Gly对应GG;Arg389G1y基因多态性:Arg389Arg对应碱基为CC,Arg389G1y对应CG,G1y389G1y对应GG。
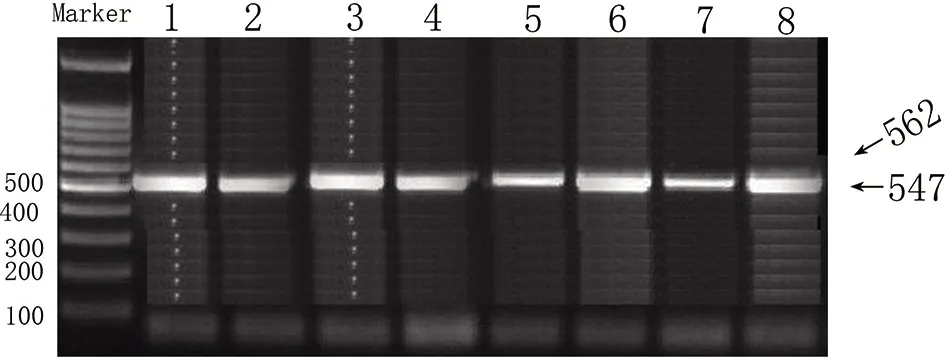
图2 β1AR基因49位点和389位点PCR-RFLP扩增检测结果
β1AR基因49位点和389位点PCR扩增目的片段长分别在562bp和547bp,如图2所示。
2.3 β1AR49和389位点多态性基因型分型
β1AR49基因分布为GG、AG、AA三种,而389位点多态性基因型分布为CC、CG和CC三种,(如图3、4所示)。
2.4 β1AR基因49位点多态性
使用Eco O109I对β1AR基因49位点酶切可区分出3种基因型:GG型(219,343bp2条条带)、AG型(562,343,219bp3条条带)和AA型(562bp1条条带),见图5。两组β1AR基因49位点多态性分析:实验组和对照组均符合H-W遗传平衡定律(P>0.05),具有群体代表性。两组β1AR基因49位点基因型和等位基因频率比较见表3所示,基因型GG、AG、AA分布的比较,差异无统计学意义(P>0.05),两组等位基因G、A频率的比较,差异亦无统计学意义(P>0.05)。
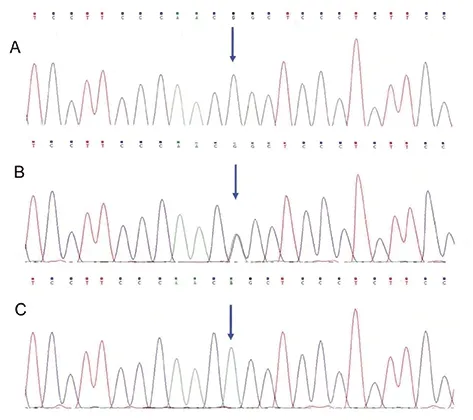
图3 β1AR基因49位点基因型分布图
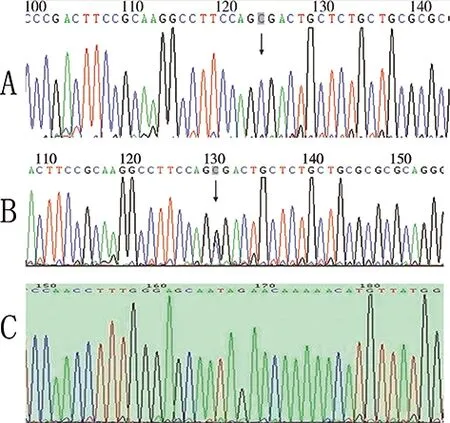
图4 β1AR基因389位点多态性的测序图谱
2.5 β1AR基因389位点多态性
使用BcgI对β1AR基因389位点酶切可区分出3种基因型:GG型(547bp1条条带)、CG型(4,171,342,547bp4条条带)和CC型(34,171,342bp3条带),见图5。两组β1AR基因389位点多态性分析:实验组和对照组均符合H-W遗传平衡定律(P>0.05),具有群体代表性。两组β1AR基因389位点基因型和等位基因频率比较见表5所示,实验组基因型CC和等位基因G、C基因型频率与对照组相比,差异均具有统计学意义(P<0.05),而两组CG、GG基因型比较,差异无统计学意义(P>0.05)。
*为实际数和理论数的比较
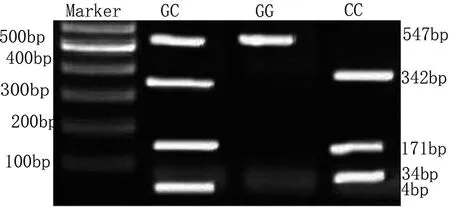
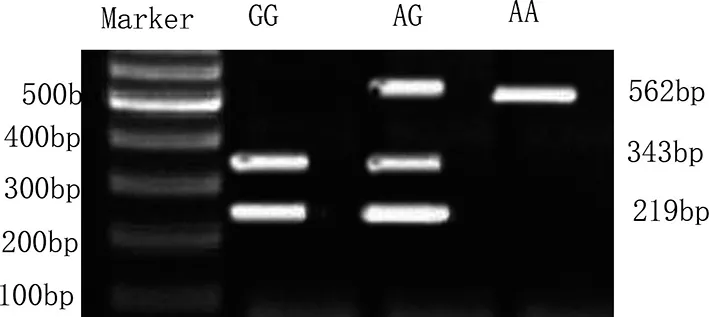
图5 β1AR基因49和389位点多态性PCR-RFLP电泳结果
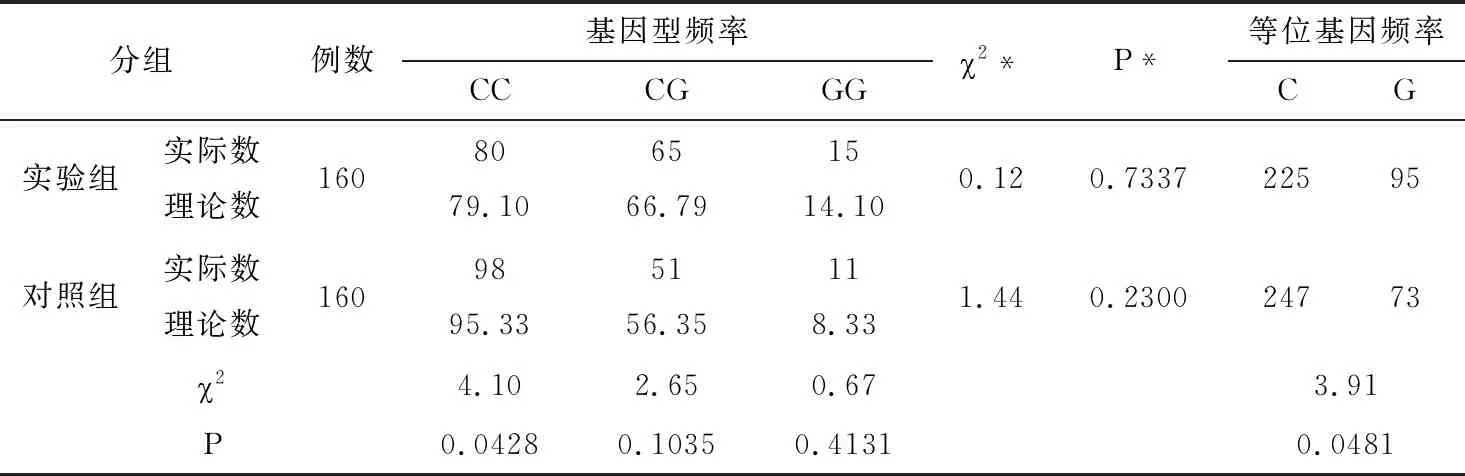
表4 两组β1AR基因389位点基因型和等位基因频率比较(n/%)
*实际数和理论数比较
2.6 血液儿茶酚胺浓度与β1AR基因多态性的关系
2.6.1 血液肾上腺素浓度与β1AR基因多态性的关系 血液肾上腺素浓度与β1AR基因多态性的关系见表5所示,实验组的血液肾上腺素浓度与β1AR基因389位点的CC明显高于对照组,差异均具有显著统计学意义(P<0.01);而两组β1AR基因49位点和β1AR基因389位点的CG、GG基因型比较,差异无统计学意义(P>0.05)。
两组中,49位点的AG基因型的血液肾上腺素浓度明显高于AA型,差异均具有显著统计学意义(P<0.01),但与GG基因型无差异,差异无统计学意义(P>0.05)。而389位点的CC基因型的血液肾上腺素浓度明显高于CG型,差异均具有显著统计学意义(P<0.01),但与GG基因型无差异,差异无统计学意义(P>0.05)。
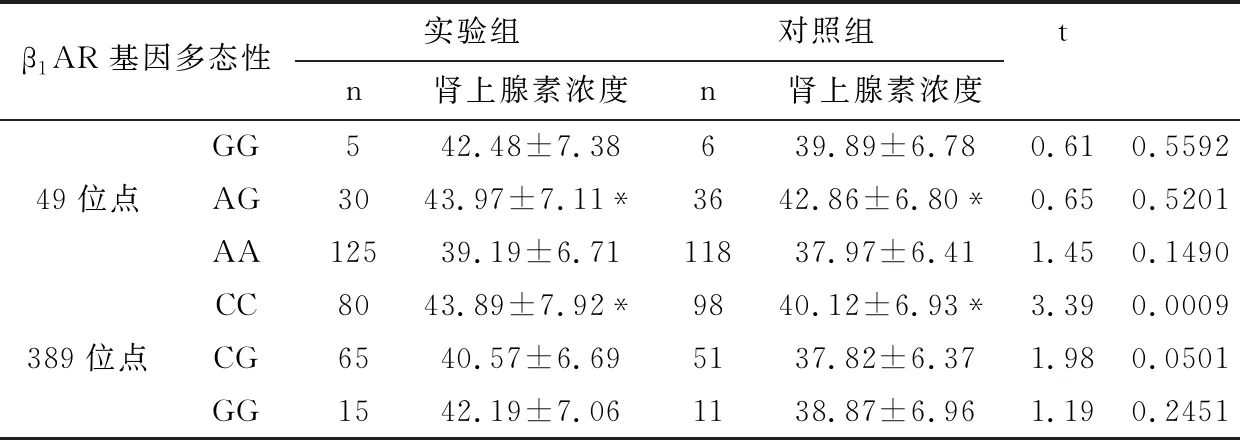
表5 血液肾上腺素浓度与β1AR基因多态性的关系
*P<0.01/0.05
2.6.2 血液去甲肾上腺素浓度与β1AR基因多态性的关系 血液去甲肾上腺素浓度与β1AR基因多态性的关系见表6所示,实验组的血液去甲肾上腺素浓度与β1AR基因389位点的CC明显高于对照组,差异均具有显著统计学意义(P<0.01),而两组β1AR基因49位点和β1AR基因389位点的CG、GG基因型比较,差异无统计学意义(P>0.05)。
两组中,49位点的AG基因型的血液去甲肾上腺素浓度明显高于AA型,差异均具有显著统计学意义(P<0.01),但与GG基因型无差异,差异无统计学意义(P>0.05)。而389位点的基因型的血液去甲肾上腺素浓度无差异,差异无统计学意义(P>0.05)。
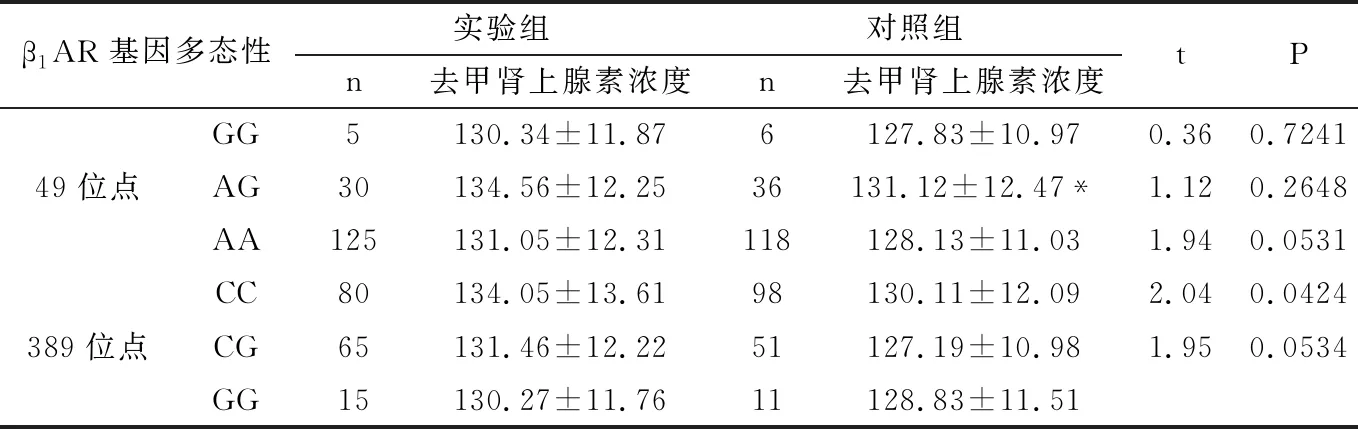
表6 血液去甲肾上腺素浓度与β1AR基因多态性的关系
*P<0.01/0.05
2.6.3 血液多巴胺浓度与β1AR基因多态性的关系 血液多巴胺浓度与β1AR基因多态性的关系见表6所示,实验组的血液多巴胺浓度与β1AR基因389位点的CC明显高于对照组,差异均具有显著统计学意义(P<0.01),而两组β1AR基因49位点和β1AR基因389位点的CG、GG基因型比较,差异无统计学意义(P>0.05)。
两组中,49位点的AG基因型的血液多巴胺浓度明显高于AA型,差异均具有显著统计学意义(P<0.01),但与GG基因型无差异,差异无统计学意义(P>0.05)。而389位点的基因型的血液去甲肾上腺素浓度无差异,差异无统计学意义(P>0.05)。
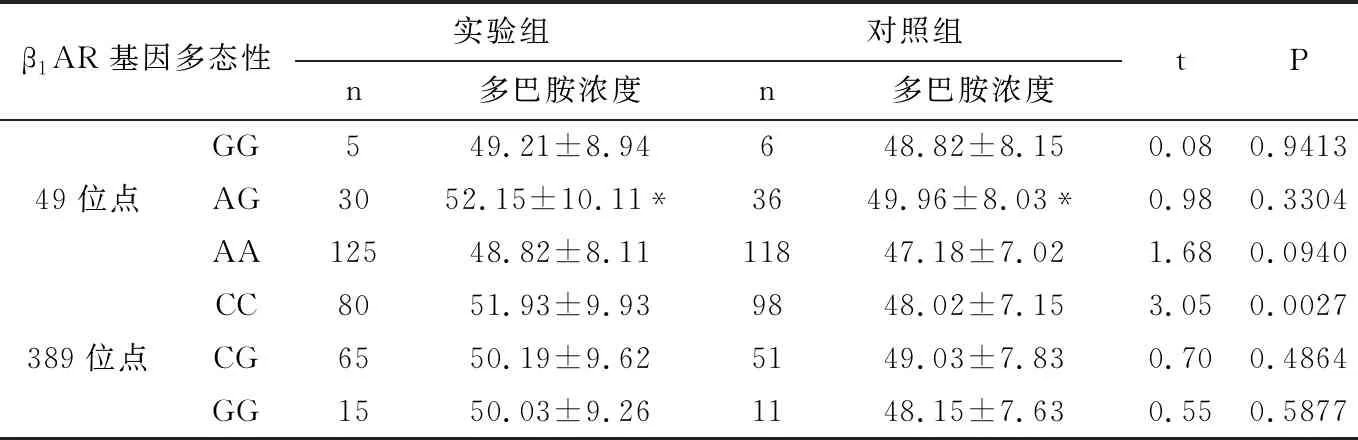
表7 血液多巴胺浓度与β1AR基因多态性的关系
*P<0.01/0.05
2.7 有氧代谢能力指标与β1AR基因多态性的关系
有氧代谢能力指标与β1AR基因多态性的关系见表8-9所示,其中VO2max/kg、O2Plusemax、VCO2max、RQmax、MVV、RFmax、Tmax、Wmax-T、运动后即刻和运动后3min心率等指标中实验组的β1AR基因389位点的CC明显高于对照组,并且实验组的CC亦高于CG和GG组,差异均具有显著统计学意义(P<0.05/0.01),而两组β1AR基因49位点和β1AR基因389位点的CG、GG基因型比较,差异无统计学意义(P>0.05)。而恢复后心率所有实验组均低于对照组,差异均具有显著统计学意义(P<0.05)。
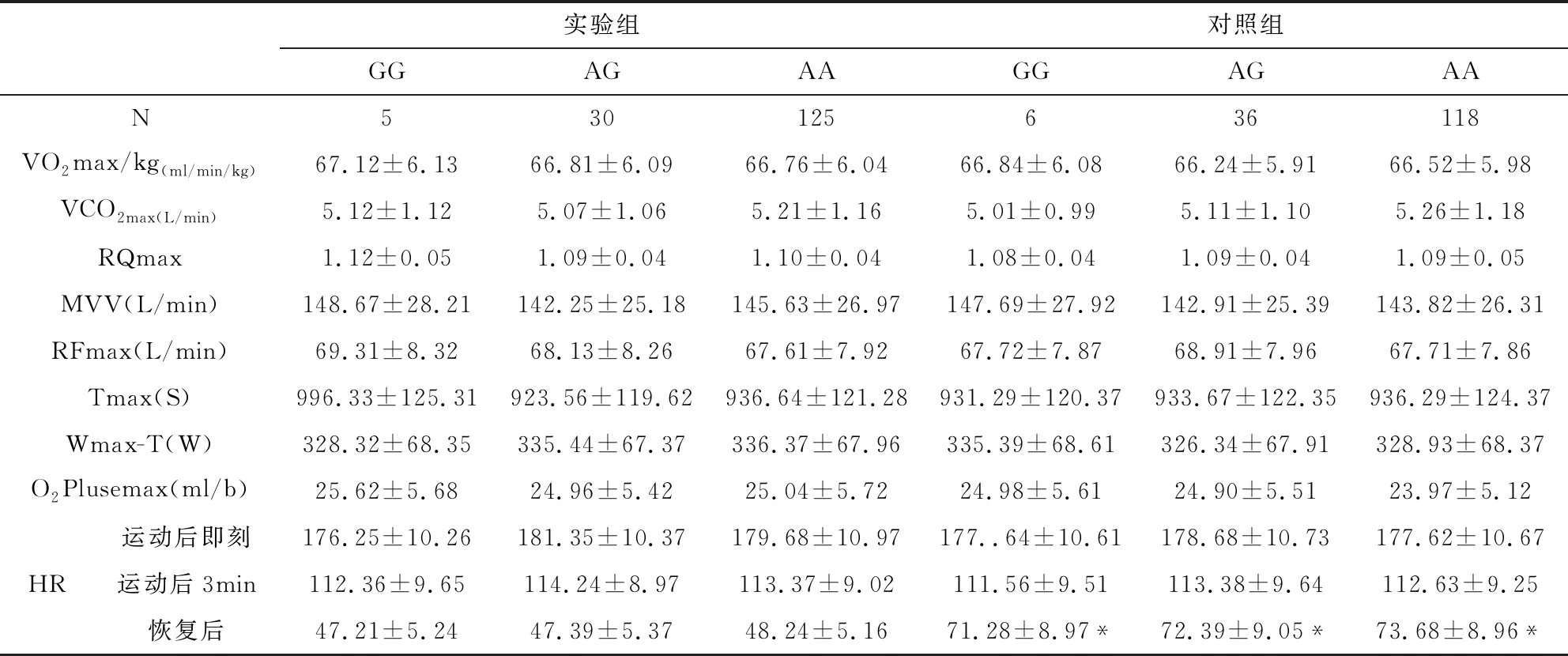
表8 有氧代谢能力指标与β1AR49位点基因多态性的关系
#与同组同位点CC相比P<0.05,*与实验组同位点相比P<0.01
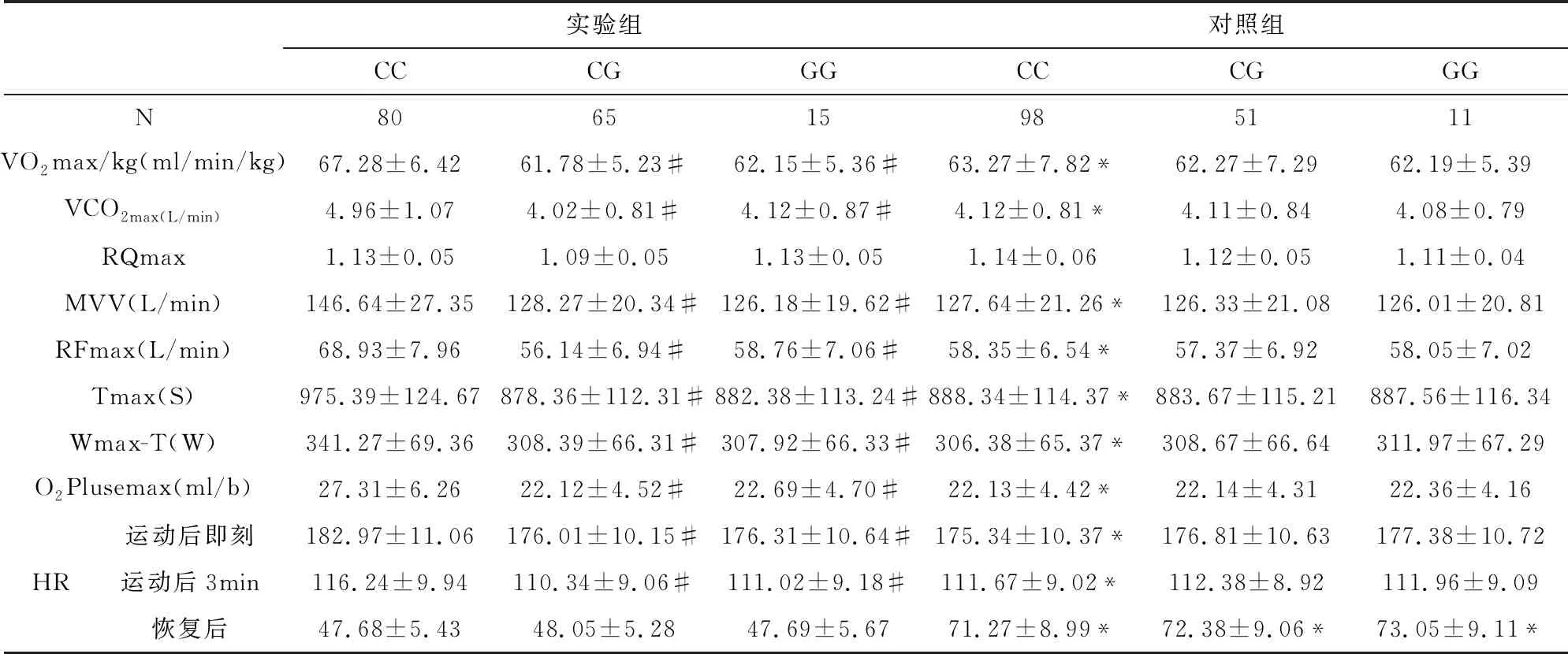
表9 有氧代谢能力指标与β1AR389位点基因多态性的关系
#与同组同位点CC相比P<0.05,*与实验组同位点相比P<0.01
3 讨 论
在心脏功能调节中,交感神经-肾上腺素能系统具有重要作用。应激状态时,交感神经兴奋,交感神经节前纤维支配的肾上腺髓质分泌大量的肾上腺素和去甲肾上腺素,进入血液,与βAR结合。而βAR有四个亚型,包括β1-AR、β2-AR、β3-AR和β4-AR,其中β1-AR主要分布在心脏,由10号染色体短臂q24-26基因编码,其属于G蛋白偶联受体超家族,分为β1-AR、β2-AR和β3-AR三种亚型,而G蛋白系单体蛋白,N端在细胞膜外,C端在胞膜内,其肽链跨膜七次,形成膜内外的环状结构,与配体肾上腺素及去甲肾上腺素结合后,别构激活G蛋白,基础状态下,G蛋白由结合GDP的α亚基和β、γ三个亚基构成,当儿茶酚胺类物质与β1-AR结合后,则G蛋白的α亚基上原来结合GDP的位置改为与GTP结合,这时α与βγ分离,游离的结合GTP的α亚基激活腺苷酸环化酶,使ATP形成cAMP,后者再激活蛋白激酶A(PKA),PKA能够使L型Ca2+通道磷酸化,促进Ca2+内流,从而使心率加快、血压上升和心肌收缩增强[8,9]。在本实验中,运动后,三种儿茶酚胺浓度实验组均高于对照组(P<0.05),证明了此点。
β1-AR基因的rs1801252即第145位的碱基A被G替换,表现在蛋白质的49位丝氨酸(Ser)被甘氨酸(Gly)所代替[1,9],经Eco O109I酶切有GG、AG和AA型三种基因型,与刘建华[1]、石力[9]和Mason DA[10]等的研究一致,而两组的基因型分布和等位基因频率的比较,无差异(P>0.05),提示β1AR基因EcoO109I多态性表达与运动能力无关联。
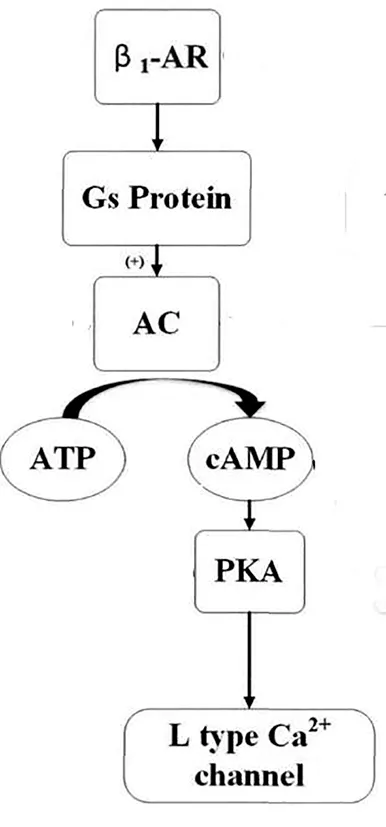
图6 β1-AR作用机理图
β1AR1165位C碱基突变为G碱基,引起蛋白质的389位精氨酸(Arg)变成了甘氨酸(Gly)突变,经BcgI酶切有GG、CG和CC型三种基因型,亦与前者[1,9,10]研究一致,但实验组基因型CC和等位基因G、C基因型频率与对照组相比,差异显著(P<0.05),而两组CG、GG基因型比较无差异(P>0.05),这与Mason DA[10]等人研究结果相仿,说明β1AR基因389位点位于细胞表面,特别是CC基因型和等位基因的C,细胞内羧基末端附近,邻近磷酸化位点,是G蛋自藕联及随后的信号转导的关键点,可能影响了β1-AR的G蛋白偶联过程,改变了腺苷酸环化酶的活化程度,从而影响受体功能,这种改变极大地影响了心肌细胞的兴奋、收缩及传导功能[11]。但49位点的AG基因型的血液去甲肾上腺素和多巴胺浓度升高显著,机理尚不清楚,有待进一步增加样本量进行研究。
有氧能力是运动的基础能力,出色的有氧能力使运动员获得较多的营养物质,增加肌肉组织获取ATP,减少对肌组织氧化酶的抑制作用,同时,增加运动性疲劳产生的5-羟色胺的排泄,减少对肌组织的抑制,促进神经性疲劳的恢复;同时,出色的有氧能力,能促进运动后堆积在神经-肌接头处的乙酰胆碱的排泄;最后,由于运动造成的钙通道控制能力降低,高氧促进钙通道控制能力恢复,使运动产生的肌细胞膜自由基减少,使肌肉恢复正常的兴奋性。这样,运动员出色的有氧能力利于运动员更好地消除在训练或比赛中积累的疲劳,使机体能够承受更大的负荷,提高训练效果[8-13]。
根据璩胜[14]的研究,VO2max/kg反映机体的有氧代谢和供能水平,而MVV反应机体摄氧利用能力;最大氧脉搏(O2plusemax)是VO2/HR的最大值,是反映心脏每搏摄取的最大氧量,是反应心肺功能的综合指标,其值越高,运动员心肺功能越强,血氧饱和度就高,其是评估心脏输氧效率高低的最佳指标;在相同递增负荷的运动模型中,总运动时间(Tmax)在最大负荷阶段的运动时间长短的不同,展示了机体运动能力的大小和总运动量,而最大负荷的工作时间(Wmax-T)反应机体承受负荷的能力。本研究显示:实验组CC获氧量明显高于对照组,并且实验组的CC亦高于CG和GG组,说明389位点的CC具有较强的获氧能力,可能与CC基因型邻近磷酸化位点,增强了腺苷酸环化酶的活化,从而促进了心肌的兴奋、收缩及传导功能,增强了获氧量,从而增加肌组织获取ATP,增加运动性疲劳物质5-羟色胺排泄以及神经肌接头乙酰胆碱排泄[11]。
4 结 论
运动后,运动员的血液儿茶酚胺浓度升高显著;具有β1AR的389位点C等位基因者,运动能力较好,具有G等位基因者,运动能力相对较差。
本实验仅研究儿茶酚胺浓度和β1AR多态性与运动能力的相关性,但对心室肌、血管的影响是下一步研究的课题。

