阿尔茨海默病患者淀粉样斑块的对比增强磁共振成像与淀粉样变的血清标志物的关联研究
向玲玲 万争艳
在MRI T2加权图像上检测为白质(WM)超强度(WMH)的WM病变可能代表微血管缺血性和/或脱髓鞘改变[1],在这种情况下,它们可被认为是脑血管疾病(CVD)的标志物[2,3]。在老年人群中,WM病变被认为是记忆和认知功能障碍的潜在危险因素[4]。有研究发现WMH与痴呆发生率增加有关[5],以及与疾病症状前阶段WM微结构改变的发生有关[6]。随着弥散张量成像(DTI)的使用,年龄相关的WM变性(即分数各向异性和扩散性)已被确定,特别是在胼um体的前额叶皮层和脾脏[7]。在轻度认知功能障碍(MCI)和早期阿尔茨海默病(AD)中,后扣带回和海马WM区的DTI纤维束显示纤维束数量也减少,这与功能磁共振成像[8]中指出的功能连通性降低一致。在前额叶和顶叶的地区,已有报道WMH病变与血氧水平依赖功能磁共振成像(fMRI BOLD)信号之间存在负相关(老年个体进行情景记忆或手指敲击任务)[9,10]。在基于磁共振成像(MRI) T2*梯度回波和磁敏感加权图像的老年人中也发现了WMH病变的负担,提示老年人WMH可能出现微出血[11]。这些结果表明,老年痴呆症患者存在WM微观结构和脑血管中断。然而,正常老年人与痴呆/AD患者之间分离WM病变负担的阈值尚待确定。早期AD的病理特征是淀粉样蛋白斑块和错折的tau缠结[12]。尸检中复合AD病理评分与T2加权MRI影像学白质病评分之间存在显著的相关关系[13]。已经发现淀粉样蛋白斑分布模式与静息状态[RS-fMRI核心中心区域(例如默认模式网络(DMN)]甚至在临床发病之前共存[14]。此外,被认为是神经元功能障碍标志物的基于氟-2-脱氧葡萄糖([18F]-FDG)PET的低代谢已被证明是AD早期的显著特征,特别是在顶叶和扣带回区域[15]。虽然细胞外淀粉样蛋白沉积与可检测的血管损伤(即脑淀粉样血管病,CAA)不直接相关[16],但其与白质损伤和RS-fMRI在痴呆不同阶段的变化有关[17]。研究表明,风险比随着风险因素(包括心血管疾病和淀粉样蛋白负荷)的数量线性增加[18]。这表明早期识别和修改这些危险因素可能预防甚至治疗AD痴呆。利用低频波动的分数幅度(fALFF)技术检测静息状态下的神经元活动是比较新的。fALFF技术通过滤波,缩放和归一化来控制生理/随机噪声,心室污染和全球个体差异,从而增强基线功能活性[19]。本研究的具体目的是比较早期AD、MCI和健康对照的WM病变体积,淀粉样蛋白负荷,FDG摄取和RS-fMRI改变(例如fALFF);研究这些MRI / PET成像指标之间的相互作用。
1 对象与方法
1.1 对象 选取来自AD神经影像学倡议(ADNI)数据库(http://adni.loni.ucla.edu)。数据是根据受试者的年龄范围以及2010年10月~2013年8月期间针对同一受试者的4种成像模式的可用性来选择的。13例早期AD患者,其中男6例,女7例,年龄(76.20±8.42)岁,MMSE评分(22.61±5.2)分;17例MCI患者其中男8例,女9例,年龄(76.67±5.5)岁,MMSE评分(26.78±4.21)分;14例年龄相匹配的健康对照,其中男女均为7例,年龄(76.35±8.21)岁,MMSE评分(28.72±5.54)分。三组性别构成、年龄、MMSE评分比较,差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 MR / PET成像 本研究的数据来自ADNI数据库(http://www.adni.loni.ucla.edu)。ADNI的主要目标是测试连续MRI,正电子发射断层扫描(PET),其他生物标志物以及临床和神经心理学评估是否可以结合来测量MCI和AD。ADNI是许多学术机构和私营企业的研究人员共同努力的结果,并从华北地区的多个地点招募受试者。成像数据-RS-fMRI(重复时间/回波时间[TR/TE]=3 000/30 ms,翻转角=80°,具有48个切片和140个体积的3.3 mm各向同性空间分辨率),T1-MPRAGE(采用体积三维MPRAGE,面内空间分辨率为0.94×0.94 mm2,切片厚度为1.2 mm,矩阵大小为256×256,166个切片),和T2加权轴向流体衰减反转恢复(FLAIR)图像(TR/TE=9 000/90 ms,翻转角度= 90°,0.86×0.86 mm2面内空间分辨率,5mm厚度和35个切片)在多个ADNI中心使用3T MRI单元获得,并在各个站点和平台上使用标准化的成像协议。另外,对于每个受试者(平面空间分辨率为1.02×0.02 mm2,厚度为2 mm,覆盖整个脑的109个切片),获取来自同一受试者的具有标准ADNI协议的[18F]-Florbetapir淀粉样蛋白PET图像。[18F]-FDG PET图像(用标准ADNI协议在[18F]-Florbetapir同一天扫描,用22 mm2面内空间分辨率重建,3.27 mm厚,覆盖整个脑的47个切片)也是从每个受试者获取。同一受试者的PET和MRI扫描之间的持续时间少于3个月。
1.2.2 观察指标
1.2.2.1 三组不同程度的室周和额叶白质病变比较 在内侧前额叶皮层(MPFC)和后扣带皮层(PCC)核心区域[20],种子产生了基于RS-fMRI的默认模式网络(DMN)。基于它们在记忆编码和巩固,自相关性和社会功能中的作用,对这两个有代表性的,造成AD患者混乱[14]的区域(MPFC和PCC)进行进一步的分析。这种组合的基于种子的连接性已被用于高特异性的自动DMN模式检测[21]。
1.2.2.2 大脑皮质淀粉样蛋白摄取情况 fALFF是通过FSL中的改编脚本获得的(http://fsl.fmrib.ox.ac.uk/fsl,版本4.1.2)。这涉及到总结超过0.005~0.1 Hz的频带,随后在频域中对整个频带进行缩放以在预处理步骤之后去除白色和生理噪声[19]。WM病变在FLAIR图像上表现为高强度,使用FireVoxel软件对每个受试者的病变半自动地进行分割(手动概述白质强度约束)[22]。全脑白质病变负荷(WMLL)是以WM中超强(≥平均值+2.5标准偏差)体素的体积(以mL为单位)获得的。
1.2.2.3 AD组的颞叶皮质中fALFF情况 将fLAIR图像生成的病灶图与每个受试者的MPRAGE数据配准,并使用非线性变形算法将其标准化至蒙特利尔神经病学研究所(MNI)的2 mm标准空间。最后,病变概率图(LPM)是通过平均每个组内的二值化归一化病变图而生成的。类似于RS-fMRI数据预处理[19],将用于量化淀粉样蛋白负荷和葡萄糖摄取值的[18F]-Florbetapir和[18F]-FDG PET图像共同记录到MPRAGE图像,并使用FSL FNIRT命令翘曲到共同的MNI空间里。使用FSL模板空间中的113个感兴趣区域(ROI),包括MPFC,PCC和小脑区域(用于PET缩放)的皮层和皮质下区块计算PET区域标准摄取值(rSUV)。每个区域的rSUV均值因小脑灰质平均SUV趋向正常化。
1.2.3 统计学方法 采用高斯随机场理论(群体差异最小,z> 2.3;聚类显著性P<0.05,校正)对群体水平内和群体之间的RS-fMRI进行体素级的多比较校正的体素FSL easythresh命令。使用Pearson和Spearman等级相关方法在WMLL,淀粉样蛋白负荷,葡萄糖代谢和RSfMRI之间进行相关性分析。
2 结果
2.1 三组不同程度的室周和额叶白质病变比较 图1A 1~3分别显示了对照组、MCI组和AD组的病灶分布(LPM)。PET淀粉样蛋白摄取图像在图1 B1~3中显示了三组平均归一化淀粉样蛋白负荷,其中在AD组中注意到最显著的摄取。MCI组的(12.88±7.47) ml和AD组的(13.16±5.12)ml的定量全脑WMLL高于对照组的(5.15±2.41)ml(P<0.05)。见图2。
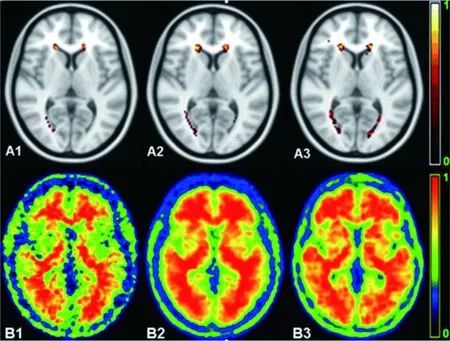
图1三组不同程度的室周和额叶白质病变比较(FLAIR图像)
2.2 大脑皮质淀粉样蛋白摄取情况 与对照组(0.15±0.12)光密度值相比,MCI组(0.42±0.15)光密度值和AD组(1.58±0.20)光密度值的定量大脑皮质淀粉样蛋白摄取(rSUV)显示出更高程度的淀粉样蛋白沉积(P<0.01)。区域标准摄取值也显示MCI组和AD组摄取值较高,AD组最高(P<0.001),包括后扣带皮层(PCC)(P<0.005)[对照组为(1.15±0.21),MCI为(1.56±0.33),AD为(1.77±0.41)]。见图3。
2.3 AD组的颞叶皮质中fALFF情况 在RS-fMRI方面,与对照组相比,MPFC中的DMN连接性降低,并且MCI组中的时间皮层中的fALFF活性降低(最小z>2.3;校正的聚类显著性P<0.05)。见图4A。与MCI组相比,AD组的DMN连接性降低,但差异无统计学意义(P>0.05)。与MCI组相比,颞叶皮质中fALFF减少,而顶叶皮质中fALFF增加(最小z> 2.3;校正簇显著性P<0.05)。见图4B。
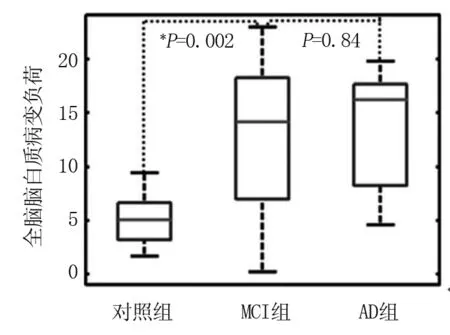
图2 全脑脑白质病变负荷(WMLL)

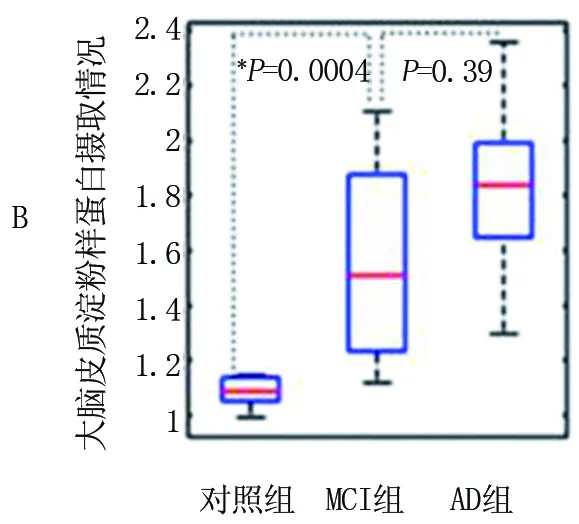
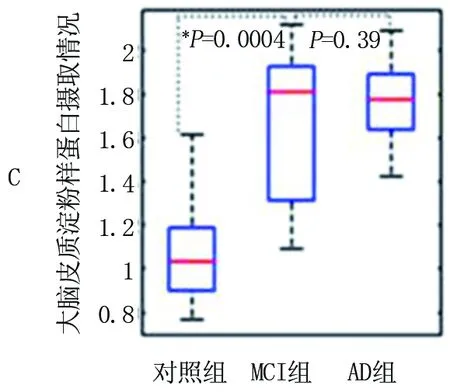
注:整个大脑皮质(P=0.0004)(A),后扣带皮层(P=0.002)(B)和内侧前额叶皮质(P=0.004)(C),与对照组相比,MCI组和AD组的SUV(rSUV)与参照小脑区的比率测量的淀粉样蛋白摄取增加;这些方框的下四分位数(水平蓝线),中位数(水平红线)和上四分位数值。须是从盒子的每一端延伸出的线条,以显示其余数据的范围
图3大脑皮质淀粉样蛋白摄取情况
2.4 大脑皮层的平均淀粉样蛋白负荷 在三组中,WMLL和整个大脑皮层的平均淀粉样蛋白负荷之间有相关性(Pearsonr=0.46,P=0.015; Spearman秩= 0.46,P=0.013)。见图5。WMLL与PCC中淀粉样蛋白负荷(Pearsonr= 0.4,P= 0.04; Spearman等级r=0.43,P=0.023)之间以及WMLL与MPFC淀粉样蛋白负荷之间也存在相关性(Personr=0.45,P=0.018;Spearman等级r=0.43,P=0.023)。见图5。
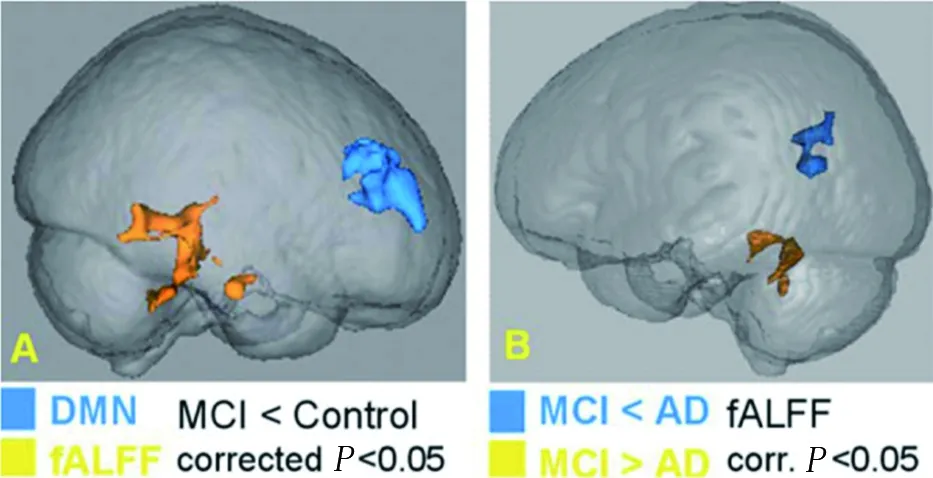
图4 AD组的颞叶皮质中fALFF情况

注:红色显示(Pearsonr=0.46,P=0.015; Spearman秩次=0.46,P=0.013),三组WMLL。蓝色显示的后扣带皮层(Pearsonr=0.4,P=0.04;Spearman秩r=0.43,P=0.023)以及在内侧前额叶皮质( Pearsonr=0.45,P=0.018; Spearman等级r=0.43,P=0.023)(绿色)中的WMLL与淀粉样蛋白负荷之间也存在相关性
图5大脑皮层的平均淀粉样蛋白负荷
2.5 MCI组WMLL和RS-fMRI DMN连接强度 在MCI组中,WMLL与DMN连接强度(r=0.56,P=0.02),WMLL与fALFF活性值(r= 0.63,P=0.01)有相关性。见图6A。同时,在AD组中,RS-fMRI fALFF活动值在减少区和增加区之间存在边际区域相关性(r=0.46,P=0.11)。整个大脑皮质的淀粉样蛋白负荷与AD患者的fALFF活性值之间存在相关性(r=0.64,P=0.046)。见图6B。
2.6 MCI组和AD组的脑FDG rSUV 关于FDG摄取,与对照组相比,MCI组和AD组的脑FDG rSUV降低(P=0.002)。见图7A。然而,MCI组和AD组比较差异无统计学意义(P=0.71)。在三组中观察到FDG摄取与淀粉样蛋白负荷呈负相关(r=0.57,P=0.0006)。见图7B。FDG组rSUV与WMLL或RS-fMRI活性无相关性(P>0.05)。
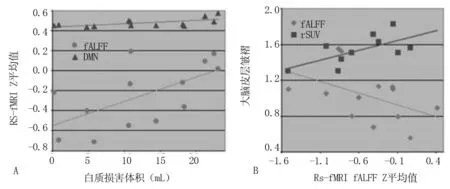
图6 A:MCI组中,WMLL与DMN连接强度;B:整个大脑皮质的淀粉样蛋白负荷与AD患者的fALFF活性值间存在相关性

图7 MCI组WMLL和RS-fMRI DMN连接强度
2.7 多种成像特征的空间对应关系 在图8中显示出了多种成像特征的空间对应关系、各种比较以及关联,其中,在疾病不同阶段(从对照组到MCI组和AD组),淀粉状蛋白负荷、FDG摄取、WMLL和RS-fMRI fALFF指标的动态对应关系在图8B中总结出。

注:A:(示意图)AD组中细胞外白质炎症,细胞外淀粉状蛋白斑块,神经元和跨突触功能障碍(低代谢)和神经变性(即神经元活性降低)之间的空间对应关系;B:(趋势图)AD组中细胞外白质炎症,细胞外淀粉状蛋白斑块,神经元和跨突触功能障碍(低代谢)和神经变性(即神经元活性降低)之间的空间对应关系
图8多种成像特征的空间对应关系
3 讨论
本研究在MCI和早期AD患者中发现典型的心室周围和额叶WM病变分布[21,23,24]。比较结果还显示MCI和早期AD患者中的总WMLL升高。同时,这些值在早期AD与MCI患者比较差异无统计学意义。最近的一项研究表明,仅仅根据全身和局部WM病变,可以实现认知障碍阶段之间的区分以及痴呆(包括AD)进展的预测[25]。本研究结果支持WM病变在前驱阶段可被检测到的观点,并且可以提供对AD早期检测的更多见解。局部PCC和MPFC定量淀粉样蛋白负荷(即rSUV)与相同年龄MCI和AD公布的结果类似[26]。本研究发现对照组和MCI组之间的差异在MPFC比PCC更为突出。La Joie R等[27]发现,对照组和可能的AD(MCI和早期AD群体的混合物)在PCC和MPFC中的区域rSUV差异相似。随着研究数目的增加,Nordberg A等[28]报道了这两个区域在对照组和MCI以及MCI和早期AD之间的显著差异。本研究对淀粉样蛋白负荷进展的观察与目前认为MCI患者的淀粉样蛋白积累在早期AD进展期间开始平稳的观点一致[29]。
WMLL与对照组和受影响人群中的淀粉样蛋白负荷之间的中度相关性提示了阿尔茨海默病早期(即MCI和早期AD)微血管损伤和淀粉样蛋白病理学之间可能的联系。然而,WMLL(脑室周围和额叶WM)和淀粉样蛋白负荷(主要在MPFC和PCC皮质区)的空间分布模式是不同的,这表明这两个区域可能在痴呆的不同阶段明显涉及。发现三种老化人群中FDG摄取与淀粉样蛋白负荷之间存在负相关,表明在AD的早期阶段,淀粉样蛋白病理学与代谢(例如MCI和早期AD患者中的代谢减退)之间的对应关系也是如此。之前已经报道了FDG和Florbetapir的不同时间轨迹[29],并且可能在早期特别是在MCI和早期AD时,这两种生物标志物共同发生并因此产生相关性。然而,本研究也注意到这两种示踪剂之间的差异,因为FDG在诊断AD(从轻到重)方面更为敏感,而Florbetapir则用于疾病进展的病理学规范和预测,特别是在AD早期[30]。
与对照相比,RS-fMRI结果显示在DMN MPFC区域中的功能连接性降低,并且在MCI患者中通过fALFF在时间区域中降低了功能活性。早期AD患者颞叶区fALFF与MCI患者相比也有所减少,但在顶叶区增加。正如所预期的那样,本研究发现颞叶皮层的神经元活动减少,AD患者往往表现出萎缩和退化。早期AD增加的顶叶fALFF提出了基于这两个区域的fALFF值之间的边际相关性的减少的时间fALFF的补偿机制。高频成分的破坏,例如那些参与记忆编码或顶层区域中的检索任务的成分,也可能导致观察到的增加的fALFF。本研究结果与文献一致,认为功能代偿和神经可塑性机制是对AD早期淀粉样蛋白斑块积累的反应[31]。在本研究中注意到的早期AD患者中淀粉样蛋白负荷与fMRI活性之间的轻微负相关似乎表明淀粉样蛋白病理学对疾病进展的致病作用。同样,最近的研究也报道了全脑以及区域功能磁共振成像连通性和淀粉样蛋白负荷之间的负相关。
仅在MCI患者中发现WMLL增高和RS-fMRI异常之间的负相关,这表明,WM病变可能在继发于痴呆前驱阶段功能连接性降低(DMN)和自发活动减少(fALFF)之后的认知下降中起重要作用。另一方面,仅在早期AD患者中淀粉样蛋白负荷增加与RS-fMRI异常之间的负相关表明淀粉样蛋白沉积可能导致随着疾病进展由fALFF反映的自发活动减少。WMLL和淀粉样蛋白负荷与fMRI反映的功能缺陷有明显的分离关联这一事实表明了认知衰退的不同阶段每种成像指标的不同敏感性。实质上,在MCI阶段观察到的功能缺陷与WM病变相一致,而一旦疾病进展到AD早期阶段,淀粉样蛋白负荷表现出与神经元活性缺陷更直接的关系。一些研究发现淀粉样蛋白负荷与认知功能减退之间的相关性,在认知正常和早期的MCI阶段比晚期MCI和早期AD阶段[32,33]更显著,基于[11C]-PIB或[18F]- Florbetapir PET配体。本研究的观察和以前发表的文章[32,33]之间的差异可能来自于本研究直接将淀粉样蛋白负荷与fMRI连通性或活动指标而不是认知功能测量(即ADAS-cog和CDR分数)相关联的事实。此外,至少在一些患者中,认知神经影像学检查所发现的神经缺陷可能存在于与轻度认知功能症状表现不同的时间框架中,可能是由于对脑病理或年龄相关变化的认知储备导致的,正如PETFDG结果[30]所认为的。
总之,本研究的定量分析暗示磁共振成像和基于PET的生物标志物的早期检测的潜力。特别相关的是,血管、功能和病理学指标的相关成像结果似乎通过早期识别可能导致淀粉样变性和WM高强度的高血压和高胆固醇血症等危险因素来支持目前的AD预防策略。

