黄芪多糖对犬血清免疫球蛋白、IFN-γ水平及分泌型IgA表达的影响
舒迎霜,贺濛初,曹护群,夏晓冬,冯士彬,李 玉,王希春,李锦春,吴金节
(安徽农业大学 动物科技学院,合肥 230061)
黄芪又名绵芪、绵黄芪,为豆科多年生草本植物,蒙古黄芪或膜荚黄芪的干燥根临床应用十分广泛,该药最早记载于《神农本草经》,味甘微温,具有益气固表、敛汗固脱、利水消肿之功效。此外,黄芪中包含多糖、甲苷、黄酮、生物碱等多种有效成分,在体内和体外均有显著的免疫调节作用[1]。临床实践证明,黄芪甲苷和黄芪黄酮均可通过NF-κB信号通路不同程度地增强小鼠RAW264.7细胞的免疫功能[2-3]。黄芪多糖(Astragaluspolysaccharides,APS)为黄芪中最主要的活性成分,具有免疫调节、抗肿瘤、保护肠道等多方面作用。卢慧等[4]研究发现,APS能显著增加雏鸡体内B淋巴细胞的增殖、分化和浆细胞的分泌功能,增强机体的免疫反应。Chen等[5]研究发现,APS可使失衡的辅助性T淋巴细胞亚群Th1和Th2及其分泌的细胞因子回到正常水平,表明APS可作用于Th细胞来调节细胞因子如IL、IFN-γ等来实现免疫调节作用。APS可显著提高鸡外周血中IFN-γ、IL-4和IL-12的质量浓度,以调节Th1/Th2平衡,增强机体免疫[6]。肠道是动物机体内最大的免疫器官,肠黏膜淋巴组织含有大量分泌型IgA(Secretory IgA, SIgA),在肠黏膜受到抗原刺激时就会激活黏膜免疫应答。研究发现[7]APS可能是通过TLR4途径诱导机体脾脏内毒素耐受性免疫应答,增强机体肠黏膜免疫功能。单春兰[8]研究报道,口服APS可以显著增加雏鸡肠黏膜IgA细胞数量以及SIgA的分泌,增强肠道的免疫应答。
目前,关于APS对猪、鼠、禽等动物免疫调节和有关疾病防治的报道较多,但APS对犬免疫机能影响的研究鲜见报道。本研究旨在探讨APS对犬血清IFN-γ水平、免疫球蛋白(IgA、IgG、IgM)水平、各肠段IgA mRNA和SIgA表达水平的影响,以研究APS调节犬免疫功能的作用机制。
1 材料与方法
1.1 材 料
1.1.1 试验动物 1岁龄健康比格犬18只,体质量10 kg左右,由南京亚东试验动物研究中心提供。试验前常规驱虫与免疫,定时定量喂食,自由饮水。
1.1.2 中药材和试剂 黄芪购自安徽合肥梅山路立方大药房;犬γ-干扰素(IFN-γ)、IgA、IgG和IgM ELISA检测试剂盒均购自上海源叶生物科技有限公司;免疫组化一抗试剂兔抗人分泌型IgA抗体购于北京博奥森生物技术有限公司;免疫组化二抗试剂羊抗兔IgG抗体购自北京中杉金桥生物科技有限公司;无水乙醇购自无锡展望化工试剂有限公司。
1.1.3 试验主要仪器 TD-100小型提取浓缩机组(浙江森力机械科技有限公司),MK3型半自动酶联免疫分析仪(美国Thermo公司),CX31正置光学显微镜(日本OLYMPUS 公司),YD-1508 R轮转式切片机(浙江金华益迪医疗设备厂),HPX-9082MBE电热恒温培养箱(上海博讯实业有限公司医疗设备厂),DW-86L388A -80 ℃冰箱(青岛海尔特种电器有限公司),台式低速离心机(湖南赫西仪器装备有限公司),LGJ-12N冷冻干燥机(北京亚星仪科科技发展有限公司)。
1.2 方 法
1.2.1 中药制备 参照文献[9],称取5 kg黄芪,去除杂质,清洗3次,沥干水分,黄芪与酒精按照质量比1∶10加至50 Lφ=80%的酒精,提取3次,每次1 h,去除油脂。取出药渣用电恒温培养箱60 ℃烘干,再称质量,按照料液比1∶20加入纯水,超声波震荡提取80 min。将药液转移至浓缩罐中浓缩至4 L,再加入3倍量的φ=95%的酒精,4 ℃静置12 h,使黄芪多糖沉淀,3 000 r/min 离心5 min,取沉淀,加蒸馏水溶解至4 L。加入等体积φ=5%的三氯乙酸,同时加入适量活性炭(样品量的15%~20%)脱色,滤去活性炭,4 ℃静置24 h,使蛋白沉淀除去蛋白。3 000 r/min 离心5 min,弃去沉淀,取上清液加2 mol/L 的NaOH调节pH为7.0,浓缩至4 L。加入3倍量φ=95%的酒精,使醇达到80%,低温静置,得疏松沉淀物,洗涤干燥得脱蛋白黄芪多糖粉,4 ℃ 保存,备用。经苯酚硫酸法测得多糖提取率为12.91%。
1.2.2 试验分组及犬的饲养管理 18只纯种比格犬随机分为3组,即对照组(只饲喂基础日粮)、黄芪多糖低剂量组(基础日粮+以生药计w=1%的黄芪多糖)和黄芪多糖高剂量组(基础日粮+以生药计w=2%的黄芪多糖),每组6 只,试验期14 d,试验期间3组试验犬饲喂管理条件一致,每天定点饲喂2 次相应日粮,上下午各 1 次,每次150 g,自由饮水。
1.2.3 样品采集 分别在试验的第0、7和14天采集血液,采血前保证试验犬空腹12 h,前肢静脉采血(每次每只采血1.5~3 mL),所采血液放于非抗凝管,待血液凝固后于3 000 r/min离心10 min,分离血清后分装于1.5 mL离心管,-20 ℃保存,备用。试验结束后,全部试验犬麻醉放血后解剖,取十二指肠、空肠中段和回肠,轻微冲洗,每个肠段分成2份,分别放置在φ=4% 多聚甲醛和液氮中速冻,-80 ℃保存。
1.2.4 血清免疫因子的测定 采用ELISA法检测血清中IFN-γ、IgA、IgM和IgG 水平,严格按照试剂盒说明操作,在460 nm处测得样本OD值后,再在Excel中根据说明书中标准品浓度和测得的OD值建立标准曲线,获得相应回归方程,计算血清中样本浓度。
1.2.5 RT-qPCR法检测各肠段IgA mRNA相对表达量 从-80 ℃取出肠段组织样本,分别用液氮研磨粉碎,加入1 mL Trizol提取总RNA,使用Invitrogen的反转录试剂盒Superscript Ⅲ将提取的总RNA进行反转录,获得cDNA,-20 ℃保存,备用。根据GenBank中犬IgA及Actin的基因序列(GenBank登录号分别为AY_576788.1和NM_001003195.1),利用Primer Premier 5.0软件设计引物(表1),引物由上海生工生物工程股份有限公司合成。采用SYBR QPCR mix试剂,ABI-7900 qPCR仪检测犬各肠段中IgA mRNA的相对表达量,结果以2-ΔΔCt表示。
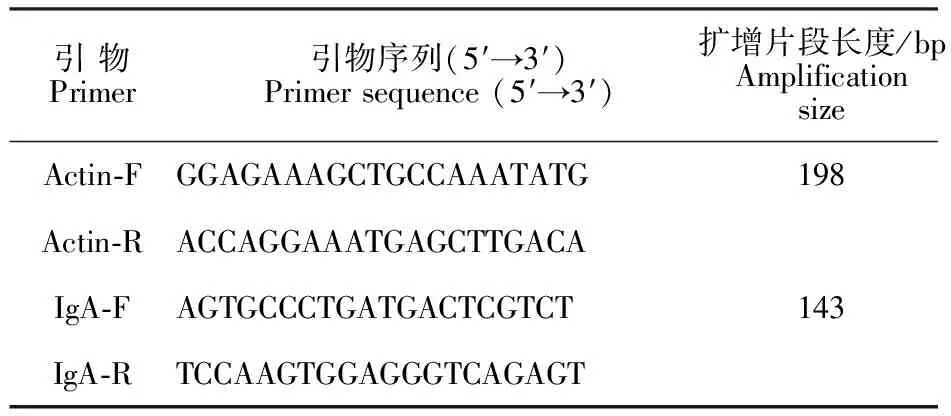
表1 qPCR扩增的引物序列Table 1 Primer sequence for qPCR amplification
1.2.6 免疫组化法检测犬各肠段SIgA蛋白表达量 从多聚甲醛中取出肠道组织,制作石蜡切片,常规免疫组化法检测各个肠段组织中的SIgA蛋白表达位点及表达量,同时设置阴性对照,阴性对照以PBS代替一抗,其他操作均一致,中性树胶封片。采用Olympus显微镜Images图像分析系统对免疫组化各肠道切片进行拍照,同一个组织选择3个视野拍照保存,将图片导入Image-Pro Plus 6.0图像分析软件进行分析,SIgA蛋白的阳性表达率用平均光密度值(Density mean)表示。
1.2.7 数据分析 采用SPSS 19.0统计软件分析数据,结果以“平均值±标准差”表示,使用单因素方差分析(One-way ANOVA)和最小显著差数(LSD)法进行多重比较;组间比较采用LDS法检验。
2 结果与分析
2.1 黄芪多糖对犬血清中Ig和IFN-γ水平的影响
2.1.1 IgA水平检测 由表2可知,第0天时,各组IgA水平差异不显著(P>0.05);第7天时,高、低剂量组均显著高于对照组(P<0.05);第14天时,高剂量组极显著高于对照组(P<0.01),低剂量组显著高于对照组(P<0.05)。
2.1.2 IgG水平检测 由表3可知,第0天时,各组IgG水平差异不显著(P>0.05);第7天时,高剂量组显著高于对照组(P<0.05),低剂量组与对照组差异不显著(P>0.05);第14天时,高、低剂量组均显著高于对照组(P<0.05)。
2.1.3 IgM水平检测 由表4可知,第0天时,各组IgM水平差异不显著(P>0.05);第7天时,组有升高趋势,但与对照组差异均不显著(P>0.05);第14天时,高剂量组显著高于对照组(P<0.05),低剂量组与对照组差异不显著(P>0.05)。

表2 血清中IgA水平检测Table 2 Detection of serum IgA levels(n=6) ng/mL
注:同列小写字母不同表示差异显著(P<0.05),大写字母不同表示差异极显著(P<0.01),下同。
Note: the difference of lowercase letters in the same column indicate significant difference(P<0.05), and the differences of uppercase letters indicate that extremely significant difference(P<0.01), the same below.

表3 血清中IgG水平检测Table 3 Detection of serum IgG levels(n=6) ng/mL

表4 血清中IgM水平检测Table 4 Detection of serum IgM levels(n=6) ng/mL
2.1.4 INF-γ水平检测 由表5可知,第0天时,各组IFN-γ水平差异不显著(P>0.05);第7天时,高剂量组显著高于对照组(P<0.05),低剂量组与对照组差异不显著(P>0.05);第14天时,高剂量组极显著高于对照组(P<0.01),低剂量组显著高于对照组(P<0.05)。
2.2 黄芪多糖对犬各肠段IgA mRNA相对表达量的影响
如表6所示,喂食黄芪多糖2周后,高、低剂量组犬各肠段IgA mRNA相对表达量较对照组均有升高趋势。其中十二指肠和回肠中高剂量组显著高于对照组(P<0.05),低剂量组高于对照组,但差异不显著(P>0.05);回肠中高、低剂量组均显著高于对照组(P<0.05)。
2.3 黄芪多糖对犬各肠段SIgA表达的影响
由图1可以看出,SIgA蛋白在犬十二指肠、空肠及回肠均有表达,蛋白阳性表达区域呈棕黄色,蛋白表达越多棕黄色也就越深,该蛋白主要分布在固有层及肠腺周围。黏膜固有层内含有大量淋巴细胞,如T细胞、B细胞及肥大细胞等多种免疫细胞,主要以T 、B淋巴细胞为首,且二者数量相当,当机体受到抗原刺激时,大量的SIgA即被分泌以介导机体的免疫调节作用[10]。

表5 血清中IFN-γ水平检测Table 5 Detection of serum IFN-γ levels(n=6) ng/mL

表6 犬各肠段IgA mRNA的相对表达量Table 6 Relative expression of IgA mRNA in small intestine of canines

A.阴性对照 Negative control;B.对照组 Control group;C.黄芪多糖低剂量组 APS low dosage group;D.黄芪多糖高剂量组 APS high dosage group;1.十二指肠 Duodenum;2.空肠 Jejunum;3.回肠 Ileum
图1各肠段SIgA表达检测(免疫组化,×400)
Fig.1DetectionofSIgAexpressionindifferentintestinalsegments(IHC,×400)
由表 7 可知,APS组犬的各个肠段SIgA蛋白表达均有不同程度增加。其中十二指肠中低剂量组显著高于对照组(P<0.05),高剂量组极显著高于对照组(P<0.01);空肠高剂量组极显著高于对照组(P<0.01),低剂量组与对照组差异不显著(P>0.05);回肠中组显著高于对照组(P<0.05),APS组组间差异不显著(P>0.05)。

表7 各肠段SIgA表达水平Table 7 Expression levels of SIgA in different intestinal segments
3 讨 论
研究证实黄芪多糖可作为广泛的免疫增强剂,通过影响机体细胞物质代谢、激活相关细胞因子、增强机体的特异性和非特异性免疫应答来增强免疫功能,但是有关黄芪多糖对犬血清及肠黏膜免疫功能的相关研究未见报道。
IFN-γ 是机体内调节免疫功能的重要细胞因子,IFN-γ最重要的作用是激活巨噬细胞和NK细胞从而促进Th0细胞向Th1细胞分化[11]。国欣欣等[12]研究证明,APS可在体外诱导大鼠肠黏膜微血管内皮细胞(Rat intestinal mucous microvascular endothelial cells, RIMVECs)合成并分泌内源性IFN-γ,可在细胞水平上加固屏障发挥免疫调节作用,增强机体免疫力。现代药理研究实践也证明,黄芪多糖具有抗病毒、抗氧化及调节机体免疫的功能,并能诱导机体免疫细胞产生和分泌干扰素[13],因此IFN-γ主要是通过细胞介导促进机体的免疫功能。杨红洋等[14]研究中药复方多糖对不同基因型鸡血清细胞因子的影响,发现不同剂量的中药复方多糖均能提高鸡血清中IL-2、IL-4、IL-6和IFN-γ水平,增强机体抵抗病原的能力。APS同样可提高血清细胞因子(TNF-α、IL-2和IFN-γ)水平及免疫细胞(巨噬细胞、淋巴细胞和NK细胞)的活性,辅助抗体和吞噬细胞抵抗病原微生物的入侵,介导免疫溶菌作用,从而增强机体免疫力[15]。血清中的免疫球蛋白主要有3种,即IgA、IgG和IgM,这3种免疫球蛋白参与的主要是体液免疫,可维持机体内环境的稳态平衡,因此检测Ig也是观察体液免疫功能强弱的重要指标之一。Assinewe等[16]报道,APS能促进机体产生特异性IgG、IgA和IgM,并且增加T细胞百分数。Wang等[17]研究发现,用APS喂养海参 2 个月,可以改善海参的吞噬细胞能力、溶菌酶活力等,从而增强其非特异性免疫应答。本研究结果表明,黄芪多糖可显著或极显著提高犬血清中IFN-γ、免疫球蛋白(IgA、IgG、IgM)水平,从而增强犬免疫力。
肠道黏膜免疫是机体抵御外界病原微生物入侵的第一道防线,当外界的抗原入侵肠腔时,巨噬细胞就会通过肠黏膜中的抗原呈递细胞将抗原物质集结起来并加工,再将加工后的抗原呈递给辅助性T细胞,辅助性T细胞激活B淋巴细胞使其增殖分化产生大量SIgA进入肠腔内,以此增强肠道免疫力[10]。其中B淋巴细胞和T淋巴细胞主要存在于肠黏膜固有层,且固有层分布着机体约80% IgA+细胞,在肠黏膜上皮表面还有肥大细胞也参与机体的免疫调节,当动物口服黄芪多糖时,大量黄芪多糖被小肠壁吸收,肥大细胞数量增多,其分泌的细胞因子含量上升,使巨噬细胞呈递抗原的作用加强, SIgA的含量也随之增加[18]。因此,评价肠黏膜免疫力强弱的标志之一即为检测肠道中SIgA的含量。李任军等[19]研究发现,给小鼠口服黄芪多糖能显著增加IELs和固有层IgA+细胞数量,增强肠道免疫功能。Rey等[20]研究发现,SIgA能够被派氏结中的树状突细胞吞噬进入肠黏膜,从而起到保护肠道增强肠道免疫的作用。Li等[21]研究指出,黄连素能够显著提高小鼠肠黏膜中SIgA的水平。陈家顺等[22]研究血根碱作为饲料添加剂对断奶仔猪肠道免疫功能的影响,发现饲粮中添加血根碱可显著提高断奶仔猪小肠黏膜IgA、IgG 和IgM的含量,达到与抗生素相当的效果。本研究结果表明,黄芪多糖组犬肠黏膜IgA mRNA及SIgA蛋白表达水平均显著高于对照组,表明黄芪多糖可促进犬肠道合成并分泌SIgA,从而增强犬的肠黏膜免疫功能。
4 结 论
黄芪多糖不仅可以提高犬血清中IFN-γ、IgA、IgG 和IgM的水平,增强机体的细胞及体液免疫功能,其中2%黄芪多糖组的免疫增强效果优于1%黄芪多糖组。黄芪多糖还能促进犬小肠黏膜IgA mRNA的表达以及SIgA的合成与分泌,表明黄芪多糖能增强犬的肠黏膜免疫,提高犬的免疫机能。

