全氟辛烷磺酸盐对大鼠胚胎发育及胎盘IGF-1表达的影响
龚阿芳,李银生
(1. 郑州澍青医学高等专科学校,郑州 450064;2. 新乡医学院,河南 新乡 453003)
全氟辛烷磺酸盐(perfluorooctane sulfonate,PFOS)作为重要的全氟化表面活性剂,广泛应用于杀虫剂、灭火剂、纸张等日常生活用品生产[1-2]。由于PFOS在人体的的蓄积率较高,目前在人体血清、脐带血、乳汁中均能检测到PFOS的存在,特别是青少年人群蓄积严重[3]。前期毒理学研究显示,PFOS对肝、神经生殖、心血管和生殖发育均有显著的毒性作用[4-7]。研究显示,肝是PFOS毒力的主要靶器官,影响脂肪代谢,越过胎盘屏障,危害子代健康[8-9]。糖皮质激素(glucocorticoid,GC),简称皮质醇,是一类甾体激素。研究认为,GC在胎儿的生长发育过程中有着重要作用,GC既可以在细胞水平影响受体、酶、离子通道和载体,也能调控细胞结构蛋白、连接蛋白和信号途径以及不同生长因子的表达,GC水平过高还能抑制蛋白质合成,甚至导致生长停滞,胎儿宫内GC过高会对子代的生长发育产生深远的影响[10-12]。
本研究通过不同剂量PFOS对孕鼠的染毒处理,检测孕鼠和胎鼠的各项生理生化指标、孕鼠血清PFOS蓄积、GC含量、胎盘胰岛素样生长因子((insulin-like growth factor 1,IGF-1)的变化,以期为PFOS导致的胎儿的生长异常研究提供参考。
1 材料和方法
1.1 实验动物
SPF级成年雌性SD大鼠48只(孕11 d),体质量240~280 g,购自第三军医大学动物中心,实验动物生产许可证号[SCXK (渝) 2015-0005]。饲养于新乡医学院SPF级动物房[SYXK(豫)2017-022],饲养条件:室温20℃~24℃,相对湿度40%~70%,光暗循环12 h/12 h,自由饮水摄食。并按实验动物使用的3R原则给予人道的关怀。实验动物福利伦理审查号:2017062302。
1.2 主要试剂与仪器
全氟辛烷磺酸钾(H2012067,99.00%分析纯,美国Sigma公司);Tween 20(H2017231,Sigma-Aldrich,美国);RT-PCR试剂盒(北京天根生化科技有限公司);RT-PCR引物由上海英维捷基贸易有限公司合成;血清糖皮质激素ELISA试剂盒(S2018031,武汉华美生物技术公司);RNA提取试剂盒(S2017023,美国Omega公司)。全自动酶标仪(Bio-Rad iMark,美国);冷冻离心机(Eppendorf Microfuge 20R,德国);实时荧光定量PCR仪(StepOne,美国ABI公司);5500 QTRAP四极杆-线性离子阱复合质谱检测系统(AB SCIEX公司);ZorbaxXDB C-18色谱柱(Narrow Agilent,美国);低温冰箱(Thermo Scientific Forma,美国);电子天平(Sartorious公司,德国);手动式超声波细胞破碎仪(Thermo公司,美国);Milli-Q超纯水仪(Millipore公司);XW-80A旋涡混合器(上海医大仪器厂)。
1.3 实验方法
1.3.1 分组和染毒
随机分为4组,对照组(0.5%体积分数的Tween 20),低剂量染毒组(5 mg/kg PFOS)、中剂量染毒组(10 mg/kg PFOS)和高剂量染毒组(20 mg/kg PFOS),每组12只。染毒组SD孕鼠每天灌胃PFOS 1次,从孕12 d到孕18 d持续染毒7 d,对照组给予含体积分数为0.5% Tween 20的水溶液。孕19 d时戊巴比妥钠麻醉后剖腹取胎,取出胎鼠和胎盘后,检测胎鼠体质量、体长和胎盘质量。每窝取3~6只幼鼠,断头处死,尽快分离组织,液氮速冻,-80℃保存待用。
1.3.2 孕鼠血清PFOS和GC水平测定
将孕鼠血液3000 r/min,4℃离心30 min后收集上清。采用高效液相色谱/质谱法测定血清PFOS含量,方法依照文献[13]。按照血清糖皮质激素ELISA试剂盒说明书操作,用酶标仪检测记录GC浓度水平。
1.3.3 胎鼠肝系数测量
取出胎鼠后,迅速将胎鼠肝用生理盐水漂洗,用滤纸吸干肝水分后立即称重。脏器系数计算方法:脏器系数=[胎鼠肝质量(g)/胎鼠体质量(g)] × 100%。
1.3.4 胎盘IGF-1的mRNA表达水平测定
每组随机取4个胎盘30 mg组织加0.5 mL TRIzol液,用组织研磨杵充分研磨,根据试剂盒说明,提取SD鼠胎盘的总RNA、逆转录为cDNA,实时荧光定量PCR仪检测IGF-1表达,以Rps16为内参计算IGF-1表达量。反应条件95℃预变性5 min,此后每循环变性95℃、30 s,退火60℃、30 s,延伸72℃、30 s,45个循环数。引物序列为:正向:5’-ACTCTGCTTGCTCACCTTTACC-3’;反向:5’-TCATCCACAATGCCCGTC-3’。
1.4 统计学方法
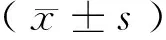
2 结果
2.1 不同剂量PFOS处理对孕鼠和胎鼠基本生长情况的影响
实验中未发现孕鼠和胎鼠有死亡畸形,实验显示,染毒后孕鼠的体质量出现了明显的下降,随着PFOS剂量的加大体质量降低趋势愈加明显,高剂量PFOS染毒组(20 mg/kg)孕鼠体质量为(208.78 ± 19.45) g,与对照组(0 mg/kg)相比差异有显著性(P< 0.001)。胎鼠的体质量、体长和胎盘的质量表现出相同的降低趋势,高剂量PFOS染毒组(20 mg/kg)下降最为严重(P< 0.001),见表1。
2.2 PFOS染毒对孕鼠血清PFOS及GC含量的影响
结果显示,持续灌胃7 d后低、中、高实验组孕鼠血清中PFOS含量逐渐增加,与低剂量组相比,中、高剂量组PFOS累积更加严重(P< 0.001)。于此同时,孕鼠血清GC在高剂量组(20 mg/kg)表达显著增加(表2,P< 0.05)。
2.3 PFOS染毒对胎鼠肝系数及胎盘IGF-1表达的影响
不同剂量PFOS染毒后,胎鼠的肝系数随着PFOS剂量增加显著降低。与对照组相比,中剂量PFOS染毒组(10 mg/kg)和高剂量PFOS染毒组(20 mg/kg)差异均有显著性(分别为P< 0.05和P< 0.001)。IGF-1表达水平在低、中、高剂量PFOS染毒组胎盘中逐渐降低,差异有显著性(表3)。
2.4 PFOS染毒对胎鼠肝生化的影响
不同剂量PFOS染毒后,胎鼠血液生化丙氨酸氨基转移酶(alanine aminotransferase,ALT)与天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)也随着PFOS给药剂量的增加而增高。与对照组相比,低、中、高PFOS染毒组(20 mg/kg)差异均有显著性(均为P< 0.05)(表4)。

表1 PFOS染毒后孕鼠和胎鼠体质量和生长状况Table 1 Body mass and growth of pregnant and fetal rats after PFOS exposure
注:与对照组比较,*P< 0.05,**P< 0.01,***P< 0.001。
Note. Compared with the control group,*P< 0.05,**P< 0.01,***P< 0.001.
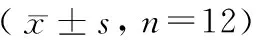
表2 PFOS染毒后孕鼠血清PFOS及GC的平均浓度Table 2 Average concentrations of PFOS and GC in serum of pregnant rats after PFOS exposure
注:#低于检测限。与低剂量组(5 mg/kg)比较,ΔΔΔP< 0.001;与对照组比较,*P< 0.05。
Note.#Lower than the detection limit. Compared with the low-dose group (5 mg/kg),ΔΔΔP< 0.001. Compared with the control group,*P< 0.05.

表3 PFOS染毒对胎鼠脏器系数及胎盘IGF-1表达的影响Table 3 Effects of PFOS exposure on organ coefficient and placental IGF-1 expression in fetal rats
注:与对照组比较,*P< 0.05,**P< 0.01,***P< 0.001。
Note. Compared with the control group,*P< 0.05,**P< 0.01,***P< 0.001.

表4 PFOS染毒对胎鼠血液生化的影响Table 4 Effects of PFOS on the blood biochemistry of fetal rats
注:与对照组比较,*P< 0.05。
Note. Compared with the control group,*P< 0.05.
3 讨论
PFOS作为一种常见的有机污染物,能够通过胎盘屏障,对子代产生持续的发育毒性[14-15]。随着PFOS愈加广泛的应用,国内外对其在生殖、发育、神经等种生命过程中直接或间接毒性作用研究愈加深入,特别是孕期PFOS暴露导致子代高死亡率已经早有报道[16]。
母鼠与仔鼠的不同毒性效应显示成年和新生儿对PFOS的敏感度不同,暴露同样剂量的PFOS可能对胚胎和新生儿的毒害作用更大。类似的胚胎期暴露和两代繁殖实验表明PFOS能够造成大小鼠的仔鼠死亡率升高和发育延迟[17-18],本研究也发现PFOS的胚胎期暴露会导致仔鼠的发育延迟。
本研究发现孕鼠血清PFOS蓄积严重且随着PFOS剂量浓度升高而显著增加。同时胎鼠的体质量、体长、胎盘质量、胎鼠肝系数随着PFOS剂量浓度升高而显著降低,说明孕期大鼠PFOS暴露可以导致孕鼠血清PFOS蓄积从而使未出生的胎鼠肝功能受损,最终降低胎鼠的体质量、体长、胎盘质量。肝作为PFOS毒性作用的主要靶器官,一旦受损,外源化合物代谢将受到严重影响。PFOS能够导致严重的肝损伤,因此PFOS对孕鼠和胎鼠的毒性作用可以从肝系数变化上得到一定程度的体现[19-20]。
本研究显示,随着PFOS剂量浓度的升高,孕鼠血清中的GC与PFOS表现出同样的变化趋势,与PFOS染毒浓度正相关,而胎盘中IGF-1表达水平却表现出相反的趋势,随PFOS染毒剂量的升高IGF-1表达逐渐降低。GC对胎儿的生长发育起着重要作用,既能借助促进细胞的快速分化来帮助胎儿健全器官的发育和成熟;相反又可以介乎抑制细胞的增殖速度来调控胎儿不同组织的发育[12]。胰岛素样生长因子(IGF-1)是一种结构上类似于胰岛素且功能接近的多肽,功能上在体内参与帮助胚胎以及胎儿的个体发育,代谢上IGF-1可以影响脂肪、蛋白质以及糖的代谢[21]。有报道显示,在胎儿发育过程中胎儿、胎盘的生长发育会受到IGF-1的调控,与此同时IGF-1的表达会受到母源高GC水平的抑制[22]。
本研究通过孕期不同剂量PFOS染毒处理,证实其对孕鼠和胎鼠的生长有显著的影响,对胎鼠的肝功能造成损伤。进一步对孕鼠血清PFOS含量、GC含量和胎盘IGF-1表达水平分析发现,其变化趋势与PFOS染毒剂量浓度密切相关。PFOS毒性机制可能是由于PFOS暴露并在孕鼠体内蓄积导致母源性GC水平升高,降低了胎盘的IGF-1表达,从而使胎鼠肝受损,影响胎鼠的正常发育。

