BDNF及其受体TrkB在低氧预适应小鼠中的表达变化和作用
吴晓东,杨 锦,贾小娥,3,巴德仁贵,3,谢 伟,3 *,邵 国,3 *
(1. 包头医学院生物医学研究中心与神经科学研究所,内蒙古 包头 014040;2. 内蒙古自治区低氧转化医学重点实验室,内蒙古 包头 014040;3. 首都医科大学宣武医院低氧适应转化医学北京市重点实验室,北京 100053)
低氧/缺血是目前临床治疗中常见的病症及致病因素[1],也是潜水、高原、航天等极端环境中面临的重要课题。机体缺氧能够引起神经系统的损伤,研究表明急性缺氧常导致脑损伤,并诱导神经元的损伤因子产生[2-3]。而低氧预适应(hypoxic preconditioning,HPC)是机体受到多次短暂、非致死性的低氧刺激后产生的内源性保护机制[4],能对机体组织尤其是脑组织产生保护作用。HPC可通过调节细胞的存活、迁移、细胞凋亡过程密切相关的因子表达,发挥其对神经系统的内源性保护作用[5],然而相关的分子机制仍未明确。
脑源性神经营养因子(brain derived neurotrophic factor, BDNF)是脑内合成的一种碱性蛋白[6],具有减少神经元损伤和死亡、调控受损神经元分化和再生以及监视神经元病理状态等功能。酪氨酸激酶受体B(tyrosine kinase receptor B, TrkB)是BDNF特异性的受体[7],二者结合后,可激活BDNF/TrkB信号通路途径,对大脑正常发育、突触可塑性以及神经元板层结构的形成发挥重要的生物学作用。研究发现[8],急性低氧损伤可造成BDNF、TrkB受体及其信号通路的改变,但BDNF、TrkB受体及BDNF/TrkB信号通路是否参与HPC的神经保护机制则仍未有定论。因此,本文通过研究急性低氧和HPC对BDNF及其受体TrkB3在早、晚期相表达的影响以及对BDNF/TrkB信号通路活性产生的作用,为后续低氧研究特别是为HPC神经保护的分子机制研究提供理论依据。
1 材料和方法
1.1 实验动物
6~8周后的SPF级雄性ICR小鼠(18~22 g)229只,购自斯贝福(北京)生物技术有限公司[SCXK (京) 2016-0002]。本研究经包头医学院实验动物伦理委员会批准(包院字20180901),实验小鼠在自然通风饲养室中饲养[SYXK (京) 2015-0023],实验在PCR室和蛋白操作室中进行,建模在实验准备室中进行,取材操作在实验准备室中进行。并按实验动物使用的3R原则给予了人道关怀。
1.2 主要试剂与仪器
组织细胞裂解液,北京博奥森生物技术有限公司;检测蛋白浓度试剂盒,美国Thermo公司产品;蛋白酶抑制剂,美国Thermo公司产品;磷酸酶抑制剂,MCE公司产品;30%丙烯酰胺;Tris.Hcl液体及10%过硫酸铵;奶粉;胎牛血清;兔源单克隆抗体及HRP标记羊抗兔抗体,美国SANTA公司产品;超敏发光液(北京普利赖基因公司);TaKaRa公司产品;氯仿;异丙醇;75%酒精;DEPC水;cDNA反转录试剂盒,Thermo公司产品;DNA合成引物,生物工程(上海)有限公司;Real-time PCR Mixture,北京康为生物技术有限公司。
超声波破碎仪(FB 50);酶标仪(Multiskan FC);制胶设备;蛋白电泳及转膜设备(Trans-Blot); 全自动化学发光成像分析系统(Tanon 5800);掌上离心机(D1008);台式低速离心机(TDZ4-WS); 小型台式高速冷冻离心机(Eppendorf 5424R); 混匀仪(MX-S/RL-Pro); 恒温振荡器(SHZ-82);微波炉(Galani);Real-time PCR仪(ABI7900HT);精密交流净化稳压电源(PRECISE AC PURIFYING,REGUCATEO Power Supply);磁力加热搅拌机(MS-H280-Pro);涡旋振荡器(Thermo Fisher)天平(SQP型-QUINTIX313)等。250 mL的透明广口瓶、塞橡塞、秒表、镊子、手术刀、离心管等。
1.3 实验方法
1.3.1 重复低氧小鼠模型的建立
将实验小鼠放入250 mL的透明广口瓶中,塞紧橡胶塞,立刻计时并观察小鼠的呼吸状态。当小鼠达到低氧非致死状态时,即小鼠出现仰式呼吸,大口喘气,出现痉挛。迅速拔下橡胶塞,快速取出小鼠,记录时间,该小鼠为低氧1次,低氧1次组的小鼠模型构建成功,实验结束。若是低氧4次组的小鼠则继续重复上述步骤,取出小鼠后,记录时间,待小鼠由仰式呼吸转为背式时,再次迅速放入广口瓶中进行重复低氧,共4次。本实验将低氧1次和低氧4次后即刻处死的小鼠记为0天低氧组(H1-0,H4-0);低氧后1天处死的小鼠记为1天低氧组(H1-1,H4-1);低氧后2天处死的小鼠记为2天低氧组(H1-2,H4-2);低氧后3天处死的小鼠记为3天低氧组(H1-3,H4-3);低氧后4天处死的小鼠记为4天低氧组(H1-4,H4-4);未低氧直接处死的小鼠记为对照组(H0-0)。小鼠处死后,立即剥离小鼠左右海马,放入1.5 mL的EP管中并标记,然后冻存在-80℃的冰箱中。
1.3.2 Real-time PCR
使用Trizol法提取总RNA,在装有小鼠海马组织的EP管内加入300 μL TRIzol液,用匀浆仪研磨20下,形成粉红色的匀浆。再加入200 μL液并用注射器上下吸打10次,将匀浆样品放置在冰上5 min,放入离心机离心(12000 r/min,4℃,5 min)。取上清加入100 μL氯仿(氯仿:TRIzol=0.2∶1),温和上下混匀20次,室温放置15 min,再离心(13000 r/min,4℃,5 min)。取上清于新EP管中并标记,加入250 μL预冷异丙醇(异丙醇∶TRIzol=0.5∶1),上下混匀20次并离心(13000 r/min,4℃,10 min),离心后弃除上清即出现贴壁的RNA。加入1 mL75%预冷酒精洗涤RNA沉淀用手指弹EP管,使RNA漂起。1000 r/min,4℃,5 min离心,弃上清,室温干燥RNA沉淀。最后加入25 μL无酶水回融,测OD值。 使用First Strand Cdna Synthesis试剂盒(Thermo公司)将总RNA逆转录为cDNA,-20℃保存。引物由生物工程(上海)有限公司合成,BDNF 基因、TrkB基因和β-Actin基因引物的设计见表 1。在96孔板(ABI公司)加入3 μLcDNA Template,1 μL primer,10 μL Mix以及高压水6 μL共20 μL,每个待测样品需重复3个空,3000 r/min,10 min离心。放入ABI7900HT Real-time PCR仪中,反应条件为50℃ 2 min;95℃ 5 min;95℃ 30 s,59℃ 30 s,72℃ 30 s,共40个循环,72℃ 2 min延伸。
1.3.3 Western blot 电泳
总磷酸化的TrkB(分子量为140× 103)需配配制6%的分离胶;位点磷酸化的TrkB及TrkB(分子量分别为90× 103, 95× 103)需配8%的分离胶;BDNF(分子量为14× 103)需配12%的分离胶,5%的浓缩胶。TrkB蛋白加样量为20 μg,BDNF蛋白的加样量为30 μg。电泳浓缩胶恒流49 mA;分离胶恒流39 mA。转膜,恒流400 mA,BDNF1小时,TrkB蛋白2-3 h。封闭,除了位点磷酸化的TrkB需用0.5%胎牛血清封闭外,其他蛋白均用5%脱脂奶粉封闭1 h;TBST洗膜10/次,3次。孵育一抗,一抗 在4℃摇床上孵育过夜。 二抗孵育,二抗室温300 rmp摇床上孵育2 h。显影,用等体积的超敏发光液A液和B液浸泡膜,曝片(自动化学发光成像分析系统Tanon 5800)。
1.4 统计学方法
采用GraphPad Prism 5统计软件,运用的统计学方法为方差分析(ANOVA)和t检验,比较了相同低氧次数不同天数处死组及相同天数处死不同低氧次数组之间的差异,P<0.05或P<0.01为差异有显著性。

表1 基因引物序列Table 1 Gene primer sequences
2 结果
2.1 重复低氧后可以提高小鼠低氧耐受时间
小鼠经低氧处理后,其低氧耐受时间随着低氧次数的增加而增加,图1显示,后一次耐受时间比前一次耐受时间更明显(P<0.05)。说明低氧模型和HPC模型构建成功。

注:H0-0:未低氧直接处死的小鼠(对照组);H1-0、H4-0:分别为低氧1次和低氧4次后即刻处死的小鼠(0天低氧组);H1-1、H4-1:分别为低氧1次和低氧4次后1天处死的小鼠(1天低氧组);H1-2、H4-2:分别为低氧1次和低氧4次后2天处死的小鼠(2天低氧组);H1-3、H4-3:分别为低氧1次和低氧4次后3天处死的小鼠(3天低氧组);H1-4、H4-4:分别为低氧1次和低氧4次后4天处死的小鼠(4天低氧组)。下图同。与对照组相比,*P < 0.05。图2 BDNF的Real time PCR和Western blot检测结果Note. H0-0: mice not directly killed by hypoxia (control group); H1-0, H4-0: mice killed immediately after hypoxia once or hypoxia four times (0-day hypoxia group); H1-1, H4-1: mice killed one day after hypoxia once or hypoxia four times, respectively (1-day hypoxia group); H1-2, H4-2: mice killed two days after hypoxia once or hypoxia four times, respectively. Mice (2-day hypoxia group); H1-3, H4-3: mice were killed 3 days after hypoxia once or hypoxia four times, respectively (3-day hypoxia group); H1-4, H4-4: mice were killed 4 days after hypoxia once or hypoxia four times, respectively (4-day hypoxia group). The same in the following figures. Compared with the control group,*P < 0.05.Figure 2 The results of BDNF real-time PCR and Western blot

注:与前一次低氧组相比,*P < 0.05。图1 小鼠不同低氧次数的耐受时间记录Note. Compared with the previous hypoxia group,*P < 0.05.Figure 1 Tolerance timepoints of hypoxia in mice
2.2 低氧预适应在早期相上调小鼠海马中BDNF的表达
与对照组相比,急性低氧组和HPC组小鼠海马中BDNF 在mRNA水平的表达都有增加的趋势(图2A)。而BDNF在HPC早期相(即低氧预适应处理后1天),相较于对照组其蛋白水平表达显著升高(P<0.05)(图2B);但在晚期相,BDNF蛋白表达上调的并不明显。因此,BDNF可能在HPC的早期通过表达上调发挥其神经保护作用。
2.3 低氧预适应小鼠海马中全长型TrkB的表达有上调的趋势
与对照组相比,急性低氧早期相小鼠海马中的全长型 TrkB mRNA和蛋白表达均有降低的趋势,而中期相mRNA表达变化不明显(图3A),晚期相蛋白表达变化不明显(图3B)。相较于对照组,HPC早期相小鼠海马中的全长型 TrkB mRNA和蛋白表达均有增加的趋势;但在晚期相mRNA表达变化不明显(图3A),中期相蛋白表达变化不明显(图3B)。因此,全长型 TrkB可能在低氧预适应的早期相表达增加,并可能改变BDNF/TrkB信号通路的活性。
2.4 低氧预适应在中晚期相下调小鼠海马中截短型TrkB的表达
与对照组相比,低氧组截短型TrkB受体表达则有降低的趋势,在HPC中、晚期相(即低氧预适应处理后2、4天)其mRNA表达显著降低(P<0.05)(图4A),但截短型TrkB 蛋白表达有降低的趋势但差异无显著性(图4B)。因此,截短型 TrkB可能在HPC的中晚期相表达下调,也有可能影响BDNF/TrkB信号通路的活性。
2.5 低氧抑制小鼠海马中BDNF/TrkB信号通路的活性,而低氧预适应晚期相可激活信号通路
在HPC中BDNF与TrkB受体表达均发生变化,很有可能其信号通路活性也会随之变化,因此我们又检测了低氧和HPC情况下BDNF/TrkB信号通路的活性。与对照组相比,急性低氧组BDNF/TrkB信号通路活性明显的被抑制(P<0.05、P<0.01),而HPC组BDNF/TrkB信号通路活性有增加的趋势,且在晚期相(即低氧预适应处理后4天)(P<0.05)(图5)。因此,HPC在晚期相可能通过激活BDNF/TrkB信号通路发挥神经保护作用。
3 讨论
目前研究发现HPC是机体在非致死性缺氧状态下产生的内源性保护机制。HPC可能是通过上调保护性因子表达,或下调损伤性因子表达,从而达到内源性保护作用。如在神经系统,HPC可通过下调NR2B、HESC等因子产生神经保护[8-9],HPC通过高表达Bcl-2、Caspase-3、PKC、CaveOLI-3等因子产生保护作用[5-10]。但是分子机制仍未明确。而我们通过构建低氧和HPC小鼠模型,也是为了探索其中发挥作用的保护性因子及相关机制,以上实验也证实了小鼠低氧耐受时间随着低氧次数的增加有上升的趋势(P<0.05),表明模型构建成功,一些因子表达可能发生变化,从而增加小鼠低氧耐受时间。
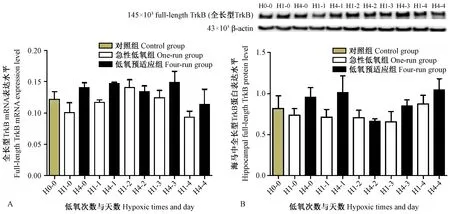
图3 全长型TrkB的Real time PCR和 Western blot结果Figure 3 The results of full-length TrkB real-time PCR and Western blot
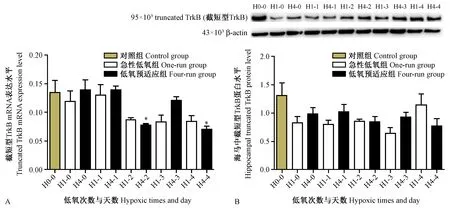
注:与对照组相比,*P < 0.05。图4 截短型TrkB的Real time PCR和 Western blot检测结果Note. Compared with the control group,*P < 0.05.Figure 4 The results of truncated TrkB real-time PCR and Western blot
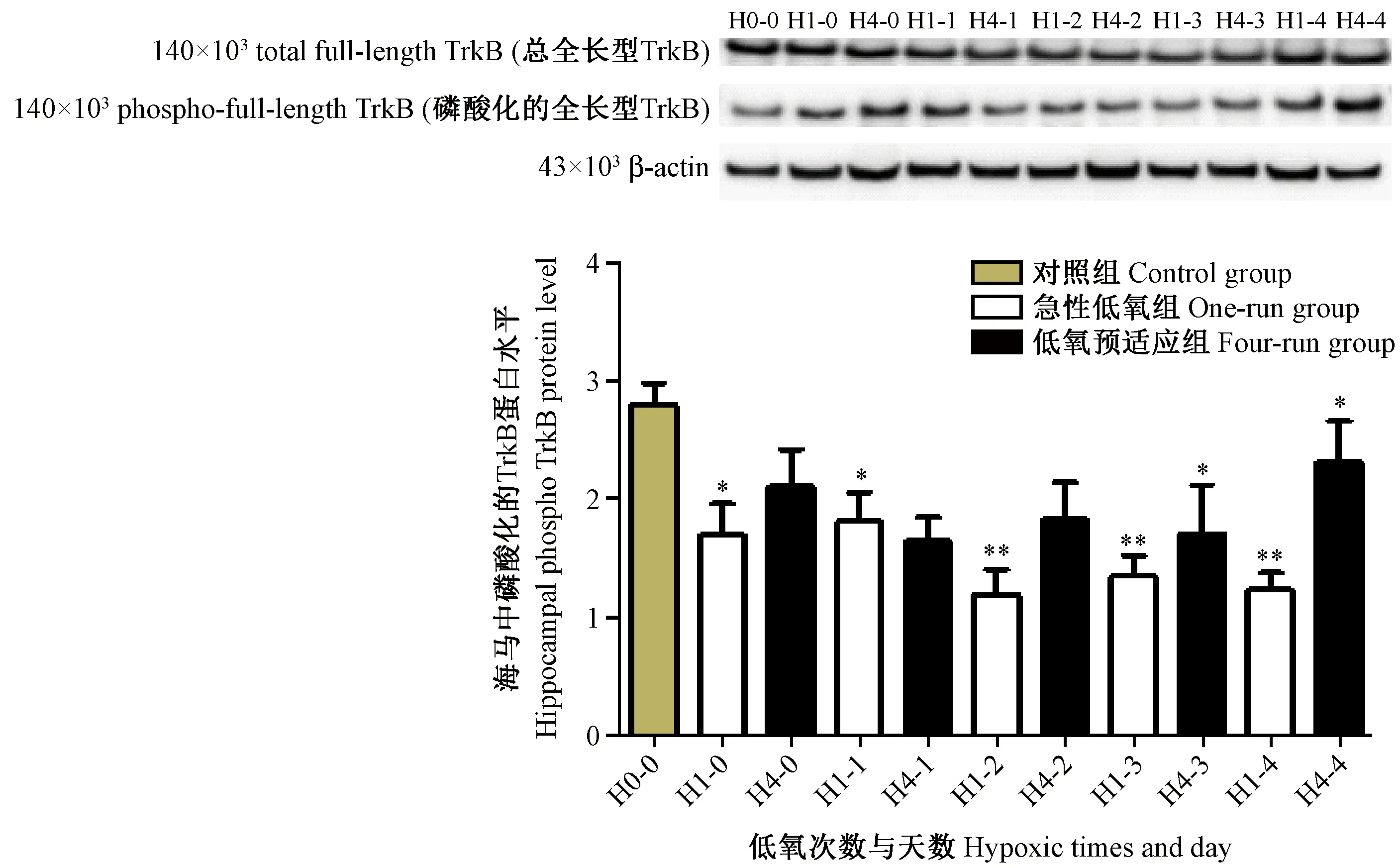
注:与对照组相比,*P < 0.05,** P < 0.01。图5 磷酸化的 TrkB蛋白的Western blot结果Note. Compared with the control group,*P < 0.05,** P < 0.01.Figure 5 The Western blot results of phospho-TrkB protein
BDNF广泛分布于中枢神经系统内,能调节神经元的分化和突触可塑性,尤其是对小脑海马结构的发育起到中要的作用[11]。Sciesielski等发现小鼠HPC时可以刺激神经细胞中的BDNF表达上调[12]。最新研究发现体内BDNF表达受缺氧环境的影响,并且它参与了神经保护和修复的机制[13]。我们研究也发现急性低氧组和低氧预适应组小鼠海马中的BDNF表达都有增加的趋势,并且HPC组的BDNF蛋白表达在早期相增高显著(P<0.05)。因此BDNF可能通过在早期相的高表达参与了HPC的神经保护机制。
TrkB是BDNF的特异性受体,其主要分为两大亚型,即全长型的Trk B受体(140×103)和截短型TrkB受体(90×103),前者与BDNF结合可正常激活BDNF/TrkB信号通路,后者可通过异二聚体抑制BDNF/TrkB信号通路活性[14]。BDNF/TrkB信号通路激活后可以改善神经功能、减少梗死体积以及修复受损神经元[15]。Tian等在海马神经元缺氧研究中提出急性低氧时海马中TrkB的表达量出现降低的趋势[16]。而小鼠经多次低氧后,TrkB受体促使与其配体BDNF结合,对后期神经元的损伤进行修复并增加存活率[17]。我们研究发现HPC后全长型 TrkB表达有增加的趋势,而截断型TrkB的mRNA表达在晚期相显著降低,由于mRNA表达变化发生在HPC晚期,所以截短型TrkB在蛋白水平表达的显著变化我们未能观察到,可能在HPC的更晚时间其表达才会发生显著差异。这有待于我们继续通过实验来证实。由此可见,HPC一方面可能上调全长型的TrkB受体表达,另一方面下调截短型TrkB受体表达,都可能影响BDNF/TrkB信号通路的活性。
既然小鼠HPC可导致BDNF和TrkB受体表达变化,而BDNF和TrkB受体结合后激活信号通路,因此HPC的保护作用可能是通过BDNF/TrkB信号通路活性变化而实现的。因此我们进一步研究了BDNF/TrkB信号通路活性在HPC状态下的变化情况。前人研究发现低氧抑制BDNF/TrkB信号通路,当加入δ-阿片受体激活剂,该信号通路从新被激活,进而细胞的凋亡和线粒体膜电位抑制得到了改善[9-16]。本实验也发现,与对照组相比。急性低氧组BDNF/TrkB信号通路被抑制,与急性低氧组相比,HPC后磷酸化的TrkB表达有升高的趋势,尤其在晚期相(低氧预适应4天后)显著增加(P<0.05)。由此我们猜测HPC是通过增加BDNF表达,促使BDNF与其受体结合,从而使TrkB酪氨酸残基磷酸化,信号通路被激活,以及HPC使截短型TrkB表达下调,异二聚体减少,进而减少了对信号通路的抑制,在这两种机制的共同作用下,激活BDNF/TrkB信号通路,通过调控神经元损伤和修复、增加神经元突触性以及监视神经元病理状态等方面对大脑产生了保护作用。

