右美托咪定通过调控TLR4表达对神经细胞氧糖剥夺损伤保护作用的机制研究
张 涛,曾凌竹
(重庆三峡中心医院,重庆 404000)
脑卒中是一种中老年人常见的神经系统疾病,随着我国老龄化的加剧,预后和治疗高发病率、高致残率和高死亡率的脑卒中已刻不容缓。缺血性脑卒中是脑卒中的主要病理类型,其与神经细胞凋亡、兴奋性中毒、氧化应激和炎症反应等多种发病机制有关[1-2]。Toll样受体4(TLR4)是Toll样受体家族中研究较多的成员,可通过多种途径参与细胞凋亡、免疫和炎症反应,在机体抵抗病原体感染或组织损伤方面发挥着积极作用,与神经细胞疾病、免疫性疾病、癌症等多种疾病的发生发展密切相关[3-5]。右美托咪定是一种有效的α2-肾上腺素受体激动剂,也是临床上辅助患者镇静和全身麻醉的常用药物。前人研究[6-7]已证实右美托咪定对神经功能损伤具有较好的保护作用,但其有无介导TLR4表达参与神经细胞损伤的保护机制尚不清楚。因此,本研究通过构建氧糖剥夺损伤细胞模型,从炎症反应上分析右美托咪定调控TLR4表达对神经细胞氧糖剥夺损伤的保护机制。
1 材料和方法
1.1 实验材料
PC12细胞购于中国医学科学院基础医学研究所。采用DMEM培养基(含10%胎牛血清)于37℃和5%CO2培养箱内常规培养。以0.25%胰蛋白酶消化传代,收集第3代长势良好的对数生长期细胞进行实验。
1.2 主要试剂与仪器
右美托咪定购于江苏恒瑞医药公司,DMEM培养基、胎牛血清和胰蛋白酶购于美国Gibco公司,Trizol试剂、TLR4抑制剂TAK-242购于美国Takeda公司SYBR Premix Ex TaqⅡ购于北京聚合美生物公司,Bax抗体和Bcl-2抗体购于美国Cell Signaling Technology公司,TLR4抗体和β肌动蛋白(β-actin)抗体购于美国Proteintech公司。辣根酶标记的二抗购于北京中杉金桥公司。细胞裂解液、CCK-8试剂盒、ECL化学发光试剂盒和逆转录试剂盒购于碧云天生物技术研究所,BCA法蛋白含量检测试剂盒购于南京凯基生物科技发展公司,肿瘤坏死因子-α(TNF-α)ELISA试剂盒和和白细胞介素-6(IL-6)ELISA 试剂盒购于美国R&D公司。CO2细胞培养箱购于美国Forma公司,酶标仪和凝胶成像系统购于美国Bio-Rad公司,有机玻璃密闭缺氧箱为自制。PCR仪购于上海赛默生物公司。
1.3 实验方法
1.3.1 实验分组
将对数生长期的PC12细胞随机分为对照组:正常培养,模型组:制备氧糖剥夺模型,右美托咪定低、中和高剂量组:在氧糖剥夺模型基础上给予终浓度为0.1、1.0和10.0 μmol/L右美托咪定。后期实验分为模型组:制备氧糖剥夺模型,抑制剂组:在氧糖剥夺模基础上给予终浓度为30 μmol/L TLR4抑制剂TAK-242,抑制剂+右美托咪定组:在氧糖剥夺模基础上给予终浓度为30 μmol/L TLR4抑制剂TAK-242和终浓度为10 μmol/L 右美托咪定。
1.3.2 氧糖剥夺细胞模型的建立
采用无血清、无糖的pH 7.2的洛克缓冲液(5.6 mmol/L KCl+154 mmol/L NaCl+1 mmol/L MgCl2+2.3 mmol/L CaCl2+3.6 mmol/L NaHCO3+6 mmol/L HEPES+5 mg/mL 庆大霉素)培养 PC12细胞,先置于含5% CO2和95%N2的缺氧培养箱中培养1 h,再置于含5% CO2和95%空气的培养箱中培养24 h。右美托咪定处理组在氧糖剥夺及复糖氧过程中均采用含相应浓度的右美托咪定培养基。
1.3.3 细胞存活率的测定
取对数生长期的PC12细胞,在96孔板上接种细胞浓度为5×104个/mL的细胞悬液200 μL/孔,于培养箱中培养至细胞贴壁75%时,参照1.3中的分组及1.4中的处理进行操作,每组设置5个复孔。培养结束后,弃培养基,加入CCK-8试剂10 μL孵育1 h。以酶标仪检测450 nm波长处各组细胞的吸光度(OD)值,以无细胞的培养液调零,并根据公式:细胞存活率=100%×(实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)计算各组细胞的存活率。每组细胞测定3次。
1.3.4 Western blot检测
收集各组PC12细胞,加入细胞裂解液提取总蛋白后,采用BCA法对总蛋白样品进行浓度的定量。以每孔50 μg蛋白样品进行凝胶电泳分离,浓缩胶电压设为80 V,分离胶单压设为120 V。电泳结束后,将蛋白凝胶转至NC膜,置于封闭液中常温封闭2 h。加入稀释比例为1∶1000的特异性一抗(Bax、Bcl-2、TLR4和β-actin)摇床4℃下孵育24 h。封闭液洗膜3次后,加入稀释比例为1∶2000的二抗摇床37℃孵育1 h。参照ECL化学发光试剂盒暗室中显色、曝光,以β-actin为内参,采用凝胶成像分析系统分析目的蛋白的相对表达水平。每组细胞测定3次。
1.3.5 RT-PCR检测
采用Trizol法提取PC12细胞的总RNA,定量RNA纯度后,以其作为模板,逆转录合成cDNA。再取2.5 μL cDNA作模板,加入各1 μL上下游引物、12.5 μL SYBR Premix Ex TaqⅡ(2×)和8 μL 无核酸酶水配制25 μL的PCR反应体系,设定PCR仪的三个阶段的反应条件分别为1)94℃ 5 min,2)94℃ 30 s、60℃ 30 s、72℃ 1 min,3)72℃ 5 min。其中第二阶段循环35次。TLR4引物上游序列为5’-GATTGCTCAGACATGGCA -GT-3’,下游序列为5’-CCCACTCGAGGTAGGTGTTT-3’,内参β-actin引物上游序列5’-CCCATCTATGAGGGTTACGC-3’,下游序列为5’-TTTAATGTCACGCACGATTTC-3’,均由上海生工生物公司合成。采用2-△△Ct法检测各组细胞中TLR4 mRNA的相对表达水平。每组细胞测定3次。
1.3.6 ELISA检测
每组取100 μL细胞上清液,参照TNF-α、IL-6 ELISA检测试剂盒说明书步骤检测各组细胞的TNF-α和IL-6含量。每组细胞测定3次。
1.4 统计学方法
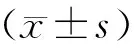
2 结果
2.1 右美托咪定对PC12细胞增殖的影响
对照组、模型组以及右美托咪定低、中和高剂量组细胞中细胞存活率分别为(92.88±11.25)%、(58.62±6.76)%、(75.85±7.05)%、(81.24±5.65)%和(88.76±6.93)%,五组整体比较差异有显著性(F=8.907,P=0.003 与对照组细胞存活率相比,经氧糖剥夺处理后的模型组细胞的存活率明显降低(P<0.05)。给予低、中和高剂量的右美托咪定处理后,PC12细胞的存活率分别与模型组相比,均明显升高(P<0.05),且呈浓度依赖性(t1=2.716,t2=3.565,t3=4.751,P<0.05)。结果见图1。
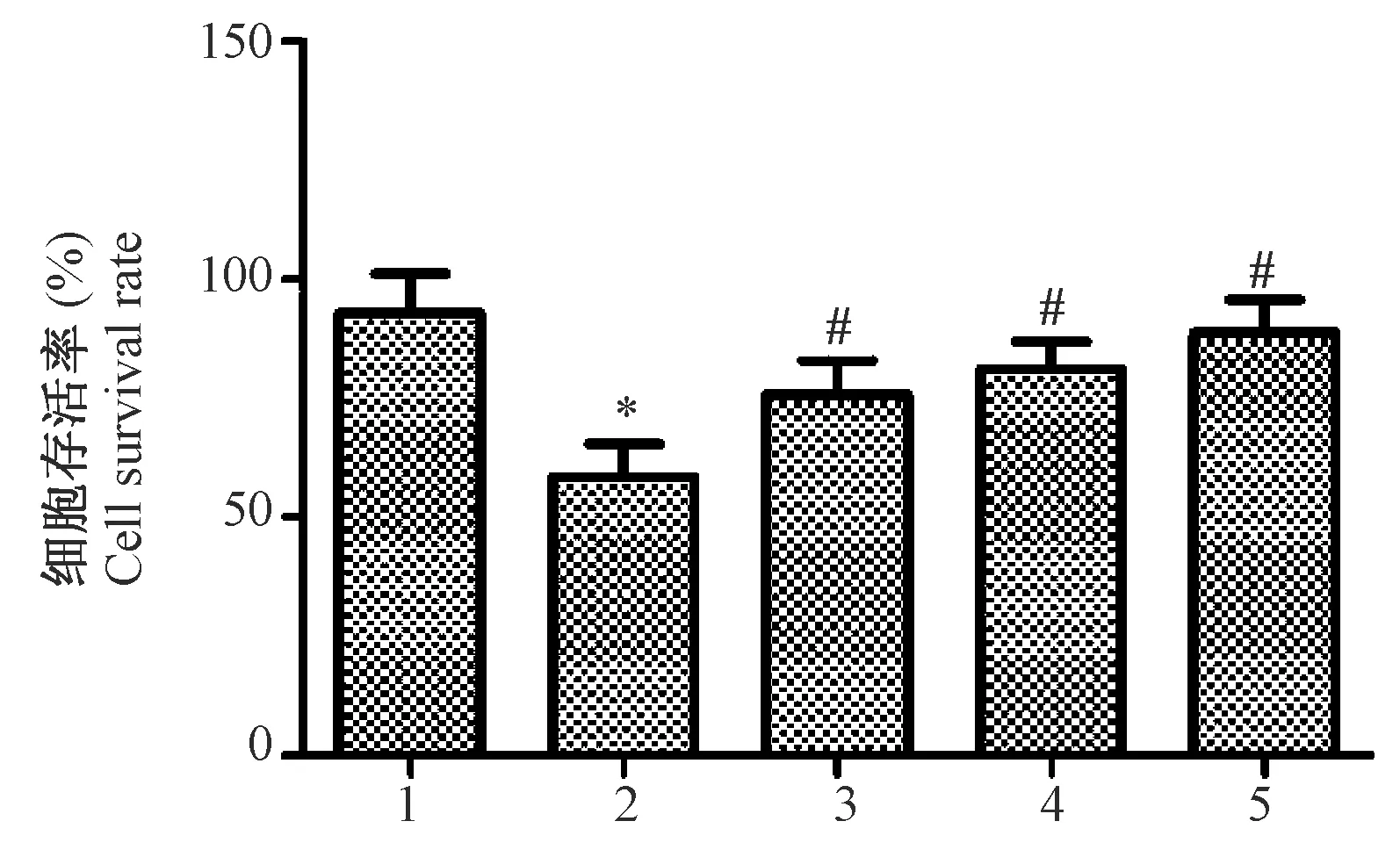
注:1:对照组;2:模型组;3:右美托咪定低剂量组;4:右美托咪定中剂量组;5:右美托咪定高剂量组。与对照组相比,*P<0.05;与模型组相比,#P<0.05。图1 右美托咪定对PC12细胞增殖的影响Note. 1: Control group; 2: Model group; 3: Dexmedetomidine low dose group; 4: Dexmedetomidine medium dose group; 5: Dexmedetomidine high dose group. Compared with the control group,*P< 0.05. Compared with the model group,#P< 0.05.Figure 1 Effect of dexmedetomidine on the proliferation of PC12 cells
2.2 右美托咪定对PC12细胞凋亡相关蛋白Bax和Bcl-2表达的影响
Western blot检测对照组、模型组以及右美托咪定低、中和高剂量组细胞中Bax蛋白的相对表达量分别为0.18±0.02、1.22±0.08、0.85±0.05、0.37±0.03和0.22±0.02,Bcl-2蛋白的相比表达量分别为0.83±0.06、0.23±0.02、0.35±0.03、0.46±0.02和0.55±0.03。对照组、模型组以及右美托咪定低、中和高剂量组细胞中Bax蛋白和Bcl-2蛋白的相比表达量分别整体比较差异有显著性(FBax=288.495,PBax<0.05;FBcl-2=125.274,PBcl-2< 0.05)。与对照组相比,模型组细胞中Bax蛋白表达明显升高(P<0.05),而Bcl-2蛋白表达明显降低(P<0.05);与模型组相比,右美托咪定低、中和高剂量组中Bax蛋白表达显著降低(P<0.05),而Bcl-2蛋白表达显著升高(P<0.05),且呈现浓度依赖性改变。结果见图2。
2.3 右美托咪定对PC12细胞炎症因子TNF-α和IL-6的影响
氧糖剥夺后PC12细胞、对照组、右美托咪定低、中和高浓度处理组中TNF-α含量分别为(865.38±52.16)pg/mL、(328.76±37.45)pg/mL、(668.95±27.56)pg/mL、(611.52±25.48)pg/mL和(573.46±22.37)pg/mL,IL-6含量分别为(235.42±23.16)pg/mL、(128.65±11.58)pg/mL、(188.73±18.25)pg/mL、(171.55±20.47)pg/mL和(154.32±12.64)pg/mL,分别整体比较差异有显著性(FTNF-α=92.704,PTNF-α<0.05;FIL-6=15.225,PIL-6<0.05)氧糖剥夺后PC12细胞上清液中TNF-α含量IL-6含量明显高于对照组中TNF-α含量IL-6含量(P<0.05),右美托咪定各浓度处理组均能够降低氧糖剥后TNF-α和IL-6含量(P<0.05)。结果见图3。
2.4 右美托咪定对PC12细胞中TLR4 mRNA和蛋白的表达
RT-PCR检测对照组、模型组、右美托咪定低剂量组、右美托咪定中剂量组和右美托咪定高剂量组细胞中TLR4 mRNA的相对表达量分别为1.23±0.09、5.45±0.48、4.15±0.39、2.95±0.30和1.78±0.18,整体比较差异有显著性(F=86.887,P<0.05)结果见图4A;Western blot检测各组细胞中TLR4蛋白的相对表达量分别为0.15±0.02、1.18±0.25、0.75±0.06、0.42±0.03和0.28±0.02,整体比较差异有显著性(F=37.971,P<0.05)结果见图4B和4C。与对照组相比,模型组细胞中TLR4 mRNA和蛋白的表达水平均显著升高(P<0.05),而右美托咪定低剂量组、右美托咪定中剂量组和右美托咪定高剂量组中TLR4 mRNA和蛋白的表达水平较模型组均呈浓度依赖性降低,且差异有显著性(P<0.05)。

注:A:Western blot检测结果,B:Bax和Bcl-2蛋白的相对表达量。1:对照组;2:模型组;3:右美托咪定低剂量组;4:右美托咪定中剂量组;5:右美托咪定高剂量组。与对照组相比,*P<0.05;与模型组相比,#P<0.05。图2 各组细胞中Bax和Bcl-2蛋白的表达Note. A: Result of Western blot. B: Relative expressions of Bax and Bcl-2 proteins. 1: Control group; 2: Model group; 3: Dexmedetomidine low dose group; 4: Dexmedetomidine medium dose group; 5: Dexmedetomidine high dose group. Compared with the control group,*P<0.05. Compared with the model group,#P<0.05.Figure 2 Expression of Bax and Bcl-2 proteins in cells from each group

注:A:TNF-α含量;B:IL-6含量。1:对照组;2:模型组;3:右美托咪定低剂量组;4:右美托咪定中剂量组;5:右美托咪定高剂量组。与对照组相比,*P<0.05;与模型组相比,#P<0.05。图3 右美托咪定对TNF-α和IL-6的影响Note: A: TNF-α content. B: IL-6 content. 1: Control group; 2: Model group; 3: Dexmedetomidine low dose group; 4: Dexmedetomidine medium dose group; 5: Dexmedetomidine high dose group. Compared with the control group,*P<0.05. Compared with the model group,#P<0.05.Figure 3 Effect of dexmedetomidine on TNF-α and IL-6 levels
2.5 右美托咪定调控TLR4表达对PC12细胞的影响
模型组、抑制剂组和抑制剂+右美托咪定组细胞的存活率分别为(63.76±5.53)%、(76.22±4.15)%和(89.65±5.36)%,Bax蛋白的相对表达量分别为1.18±0.09、0.48±0.03和0.24±0.02,Bcl-2蛋白表达量分别为0.26±0.03、0.55±0.04和0.89±0.06,TLR4蛋白的表达量分别为0.92±0.06、0.42±0.05和0.13±0.02,TNF-α含量分别为(887.26±39.25)pg/mL、(695.48±22.16)pg/mL和(426.18±25.42)pg/mL,IL-6含量分别为(245.68±22.25)pg/mL、(188.46±21.15)pg/mL和(117.85±18.65)pg/mL。模型组、抑制剂组和抑制剂+右美托咪定组分别整体比较差异均有显著性(F存活率=19.715,P存活率<0.05;FBax=228.383,PBax<0.05;FBcl-2=146.705,PBcl-2<0.05;FTLR4=221.123,PTLR4<0.05;FTNF-α=180.063,PTNF-α<0.05;FIL-6=28.601,PIL-6<0.05)。给予30 μmol/L TLR4抑制剂处理后,PC12细胞的存活率和Bcl-2蛋白表达升高,Bax和TLR4蛋白表达以及TNF-α和IL-6含量降低;给予10 μmol/L右美托咪定处理后,TLR4抑制剂对PC12细胞的存活率、Bcl-2蛋白、Bax蛋白、TLR4蛋白表达以及TNF-α、IL-6含量的调控作用明显增强,结果见图5。
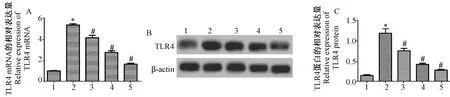
注:A:RT-PCR检测结果;B:Western blot检测结果;C:TLR4蛋白的相对表达量。1:对照组;2:模型组;3:右美托咪定低剂量组;4:右美托咪定中剂量组;5:右美托咪定高剂量组。与对照组相比,*P<0.05;与模型组相比,#P<0.05。图4 各组细胞中TLR4 mRNA和蛋白的表达Note. A: Results of RT-PCR detection. B: Western blot test results. C: Relative expression of TLR4 protein. 1: Control group; 2: Model group; 3: Dexmedetomidine low dose group; 4: Dexmedetomidine medium dose group; 5: Dexmedetomidine high dose group. Compared with the control group, *P< 0.05. Compared with the model group,#P< 0.05.Figure 4 Expression of TLR4 mRNA and protein in cells from each group
3 讨论

注:A:细胞存活率;B:Western blot检测结果;C:蛋白的相对表达量;D:TNF-α和IL-6含量。1:模型组;2:抑制剂组;3:抑制剂+右美托咪定组。与模型组相比,*P<0.05;与模型+抑制剂组相比,#P<0.05。图5 右美托咪定调控TLR4表达对PC12细胞的影响Note. A: Cell survival rate. B: Result of Western blot. C: Relative expression of protein. D: TNF-α and IL-6 levels. 1: Model group; 2: Inhibitor group; 3: Inhibitor + dexmedetomidine group. Compared with the model group,*P<0.05. Compared with the model + inhibitor group,#P<0.05.Figure 5 The effect of dexmedetomidine on the expression of TLR4 in PC12 cells
我国脑卒中的发病率有明显升高和年轻化的趋势,而目前对于脑卒中导致的患者瘫痪、感觉和认知功能障碍以及死亡仍然缺乏有效的治疗手段,探讨脑卒中的发病机制,寻找有效的治疗药物及靶点是脑卒中疾病研究的热点[8-10]。右美托咪定是一种麻醉辅助药,具有镇静、镇痛和抑制交感神经的作用,其可通过调控细胞凋亡、细胞炎症和氧化应激反应等多种途径改善组织缺血再灌注损伤。例如:右美托咪定可通过抑制caspase-3活性抑制细胞凋亡,改善肾缺血再灌注损伤[11];还可通过调控NLRC5缺陷小鼠细胞中炎症因子TNF-α、IL-6、IL-1β和氧化应激因子iNOS表达反应参与肝缺血/再灌注损伤的保护作用[12]。TLR4是一种重要的模式识别受体,可通过调控下游NF-κB信号通路和TNF-α、IL-6、IL-8等炎症因子在炎症反应中发挥着重要的调控作用[13-14];作为一种广泛存在于脑组织不同细胞的受体分子,TLR4已被证实可通过调控NF-κB信号通路引起脑神经细胞的炎症损伤和凋亡[15-16]。有报道[17-18]指出,右美托咪定可作为神经保护剂,抑制海马区神经细胞凋亡和上调HSP70表达改善脑损伤;同时,右美托咪定可通过调控TLR4表达改善心肌缺血/再灌注损伤,但右美托咪定有无介导TLR4表达参与保护神经细胞损伤的分子机制并不清楚。
为了探讨相关机制,本研究通过构建氧糖剥夺细胞模型,以低、中和高剂量右美托咪定作用PC12神经细胞,采用CCK-8法检测细胞存活率,Western blot检测促凋亡蛋白Bax和抑凋亡蛋白Bcl-2表达,ELISA法检测炎症因子TNF-α和IL-6含量。结果发现,右美托咪定能够呈浓度依赖性提高PC12细胞存活率,并下调Bax和上调Bcl-2表达,降低TNF-α和IL-6含量。结果表明,右美托咪定可通过促进神经细胞增殖、抑制神经细胞凋亡及减轻炎症反应发挥改善神经细胞损伤的作用,这一结果与龚辉等[19]发现的右美托咪定改善大鼠脑缺血再灌注损伤的机制相吻合。我们通过RT-PCR和Western blot进一步检测发现,PC12细胞中TLR4 mRNA和蛋白的表达均随右美托咪定浓度的升高而降低。结果提示,右美托咪定可能通过抑制TLR4表达参与神经细胞损伤的保护作用。已有研究[20-21]证实,TLR4可调控神经细胞凋亡,在TLR4基因敲除的小鼠脑组织神经元细胞神经元凋亡指数和Bax/Bcl-2比值升高;另外,TLR4的激活可促进炎症因子TNF-α和IL-6的表达。为了验证右美托咪定通过抑制TLR4表达参与神经细胞损伤的保护机制这一结果,我们采用30 μmol/L TLR4抑制剂TAK-242抑制TLR4表达后,观察发现PC12细胞的存活率、凋亡相关蛋白Bax和Bcl-2表达以及炎症因子TNF-α和IL-6含量的变化趋势与右美托咪定作用的结果相一致;同时在抑制TLR4表达基础上,给予10 μmol/L右美托咪定作用后,TLR4抑制剂的作用明显增强。结果证实,右美托咪定通过抑制TLR4表达参与神经细胞的增殖、凋亡、炎症反应等过程,进而发挥保护作用。
总之,我们从细胞水平上证实了右美托咪定可改善神经细胞氧糖剥夺损伤,其可通过抑制TLR4表达参与及其神经细胞的保护作用。该结果为右美托咪定有效治疗缺血性脑损伤提供了新的依据,也为TLR4有望成为缺血性脑损伤的治疗靶点提供了参考依据。

