FOXO3A基因敲除小鼠繁殖鉴定及骨髓造血干细胞表型初步分析
王玉全,李程程,苏路路,管博文,卢延华,孟爱民,樊飞跃
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021)
FOXO3A又名横纹肌肉瘤样1叉头框(forkhead rhabdomyosarcoma-like1,FKHRL1),属于叉头框蛋白(forkhead box protein,FOX)家族的O亚型,广泛参与细胞增殖分化调节, DNA损伤应答以及抗氧化应激调节过程[1-4]。近几年的研究发现FOXO3A在造血干细胞功能维持,造血系统稳态调节上发挥重要作用[4-7]。为了直接评价FOXO3A在造血系统损伤调节中的作用,探索相应的调节机制,为相关疾病的治疗提供思路和方向,我们将FOXO3A基因敲除纯合型小鼠在SPF级动物屏障环境饲养繁殖,成功繁育鉴定出FOXO3A基因敲除纯合型小鼠。同时,通过流式细胞术技术对野生型小鼠和纯合型小鼠的骨髓细胞进行检测分析,为以后开展造血系统损伤研究奠定实验基础。
1 材料和方法
1.1 实验动物
FOXO3A基因敲除小鼠(FOXO3A+/-)由中国医学科学院医学实验动物研究所张连峰课题组储存(store number:016132-UCD),雌性FVB/N小鼠4只,SPF级,体重16~18 g,5周龄;野生型雄性FVB/N小鼠2只,SPF级,体重16~18 g,5周龄,由北京维通利华实验动物技术有限公司提供[SCXK (京) 2016-0011]。饲养于中国医学科学院医学实验动物研究所屏障环境动物房[SYXK (京) 2015-0035],按照SPF级动物饲养标准进行饲养,饲养过程实行自由采食和饮水,垫料每周更换1次并补充饲料和饮用水。繁殖采用一雄一雌或一雄两雌同笼合养方式进行,雌鼠孕期为19~21 d,哺乳期为20~23 d,幼鼠在14日龄剪趾标号,剪尾鉴定基因型,在21~24日龄分笼饲养。实验方案通过中国医学科学院医学实验动物研究所实验动物管理和使用委员会(IACUC)审批,IACUC号为:MAM17002。实验动物饲养繁育和实验过程中,在不影响实验要求和实验结果的基础上,严格按实验动物使用的3R原则给予人道主义关怀。
1.2 主要试剂与仪器
EasyPure Genomic DNA Kit购自Trans Gen Biotech公司,引物由上海赛默飞世尔科技公司合成,2×GC buffer、Recombinant Taq DNA Polymerase Taq购自TaKaRa公司,GelRedTM购自Bitotium公司,流式抗体CD4、CD8、B220、Ter119、Gr-1、CD11b、Streptavidin、scal-1、ckit均购自BD或 Bioscience公司;Bio-Rad T100 Thermal Cycler,Tanon-1600数码凝胶图像处理系统,BD FACSAria TMⅡ流式细胞仪。
1.3 实验方法
1.3.1 小鼠基因型鉴定
(1)小鼠基因组DNA的提取:小鼠剪趾标号,剪尾0.5 cm置入1.5 mL无菌EP管中,参照Transgen的Genomic DNA Kit说明书提取基因组。
(2)引物设计:如表1。
(3)PCR反应:根据Recombinant Taq DNA Polymerase Taq说明采用20 μL体系进行扩增,其中2× GC buffer 10 μL、dNTP(2.5 mmol/L each)1.6 μL、Forward Primer(50 μmol/L)0.2 μL、Reverse Primer(50 μmol/L)0.2 μL、rTaq polymerase 0.2 μL、DNA template 3 μL、H2O 4.8 μL。反应条件:94℃预变性,3 min;94℃变性,30 s;58℃退火,30 s;72℃延伸,30 s;72℃后延伸,10 min;35个循环。
(4)琼脂糖凝胶电泳鉴定:取PCR扩增产物10 μL在含GelRed (1×)的2%琼脂糖凝胶中以120 V电压电泳20 min后于凝胶成像仪中观察。小鼠组织基因组琼脂糖凝胶电泳基因型片段为野生型(FOXO3A+/+,WT):100 bp;纯合型(FOXO3A-/-):186 bp;杂合型(FOXO3A+/-):100 bp、186 bp,基于此基因条带可以鉴别每只小鼠基因型。
1.3.2 骨髓细胞检测分析
为探讨FOXO3A对造血系统的影响,进行骨髓造血细胞计数及分型检测初步实验。
(1)骨髓细胞计数:取FOXO3A基因敲除纯合型小鼠3只,雄性,体重25~31 g,11~16周龄;野生型3只作为对照,雄性,体重19~29 g,11~16周龄。小鼠脱颈处死,75%酒精浸泡消毒,无菌条件取小鼠双侧股骨和胫骨,用1 mL PBS缓冲液冲洗骨髓至2 mL EP管中,采用KOVA一次性计数板,人工骨髓计数。
(2)造血干细胞和造血祖细胞比例测定[8]:分离的骨髓细胞,每只小鼠取5×106个细胞,终体积100 μL。按体积比1:20加入biotin标记的混合一抗抗体(CD4、CD8、B220、Ter119、Gr1、cd11b),4℃孵育30 min,PBS洗涤一次,1500 r/min离心5 min,离心后去上清,100 μL PBS重悬,加入混合二抗抗体streptavidin(percp标记)、scal-1(PE标记)、ckit(APC标记),4℃孵育30 min,PBS洗涤一次,离心条件如上,200 μL PBS重悬。 BD流式细胞仪检测HPCs(Lin-c-kit+Sca1-or LSK- cells),HSCs(Lin-c-kit+Sca1+or LSK+cells)在骨髓中所占的比例。
1.4 统计学方法
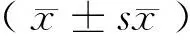
2 结果
2.1 小鼠的繁殖情况
FOXO3A基因敲除杂合型雌鼠成功繁殖出子代幼鼠,雌鼠妊娠期为19~21 d,哺乳期为20~23 d,每胎产6~13只幼鼠,成活率在98%以上。
2.2 小鼠基因型鉴定
随机选择出生15 d 1~9号小鼠剪趾标号,剪尾提取基因组,分别用引物FOXO3A-A、FOXO3A-B和引物FOXO3A-A、FOXO3A-C进行PCR扩增,采用水作为空白对照,野生型小鼠基因组作为阴性对照,杂合型小鼠基因组作阳性对照。扩增结果显示阴性对照只扩增得到100 bp条带,为野生型小鼠;阳性对照扩增得到100 bp和186 bp条带,为杂合型小鼠;5、6号只扩增得到186 bp条带,为FOXO3A基因敲除纯合型小鼠;2、3、8、9号为FOXO3A基因敲除杂合型小鼠,1、4、7号为野生型小鼠。(如图1)
2.3 小鼠的生长情况
幼鼠由雌鼠哺乳喂养,哺乳期为21 d左右,产后21~24 d离乳分笼。子代基因敲除纯合型小鼠与杂合型小鼠长势正常,与野生型FVB/N小鼠相比外观、生长发育未见明显差异。
2.4 FOXO3A基因敲除小鼠骨髓计数结果
小鼠骨髓细胞计数结果显示,FOXO3A基因敲除纯合型小鼠骨髓有核细胞计数与野生型小鼠相比[(6.167±1.424) vs. (10±1.732)],未见明显差异(P=0.1625)。结果表明,FOXO3A基因敲除不会引起小鼠骨髓有核细胞数目的明显改变。(如图2)
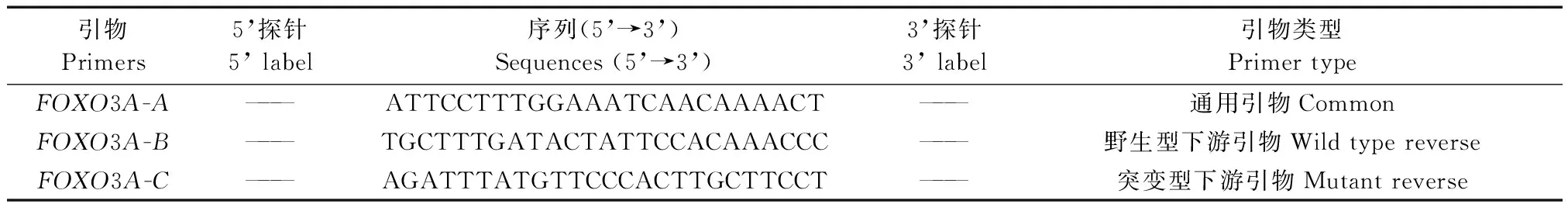
表1 引物设计Table 1 Protocol primers
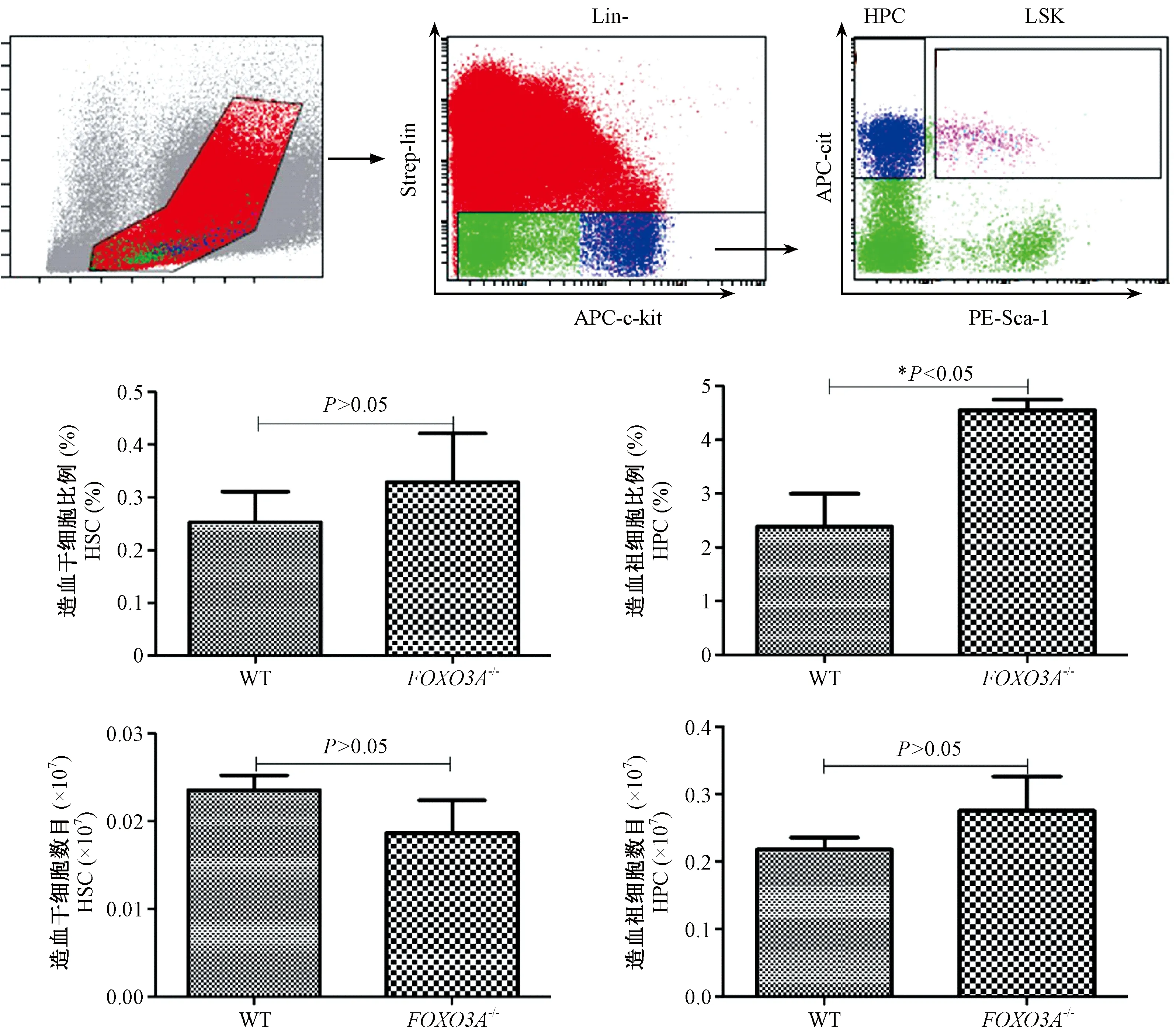
图3 FOXO3A基因敲除小鼠造血细胞表型分析Figure 3 Analysis of the phenotype of hematopoietic cells in FOXO3A knockout mice

注:A:1~9号小鼠用引物FOXO3A-A、FOXO3A-B扩增结果;B:1~9号小鼠用引物FOXO3A-A、FOXO3A-C扩增结果。M:DNA marker,2000 bp分子量标准;N:阴性对照;P:阳性对照。图1 子代小鼠基因型鉴定结果Note. A: Mice 1-9 were amplified with the primers FOXO3A-A and FOXO3A-B. B: Mice 1-9 were amplified with the primers FOXO3A-A and FOXO3A-C. M: DNA marker, 2000 bp; N: Negative control; P: Positive control.Figure 1 Genotype identification of daughter mice

图2 FOXO3A基因敲除小鼠骨髓计数Figure 2 FOXO3A gene knockout mouse bone marrow cell counts
2.5 FOXO3A基因敲除小鼠造血细胞表型分析结果
为了直接观察FOXO3A基因敲除对小鼠造血系统的影响,我们采用流式细胞仪检测FOXO3A基因敲除纯合型小鼠和野生型小鼠的骨髓细胞,流式细胞仪分析时门的设置如图3所示。我们检测了造血祖细胞(lin-scal-1-ckit+,HPC),造血干细胞(lin-scal-1+ckit+,HSC)的比例和数目。结果如图3所示,与野生型小鼠相比,FOXO3A基因敲除会引起骨髓中造血祖细胞比例明显升高(P<0.05),造血干细胞和造血祖细胞数目却没有明显改变(P>0.05)。实验结果显示,FOXO3A基因敲除未发现造血干细胞和造血祖细胞的明显差异。
3 讨论
FOXO3A作为重要的核转录因子,有“长寿基因”之称,广泛表达于成人各种组织器官中。目前研究认为FOXO3A参与多种疾病致病调节过程,例如肿瘤[9]、血液系统疾病、心血管疾病[10]、神经系统疾病[11]等。先前研究发现FOXO3A可以通过调控氧化应激和细胞周期来调节造血干细胞的功能[12, 13],FOXO3A基因缺陷小鼠随年龄增长或给予5-氟尿嘧啶(5-FU)刺激表现中性粒细胞增多,造血干细胞中蛋白激酶B(AKT)、胞外信号调节激酶(ERK)激活及增殖抑制蛋白Spred2(Sprouty-related Ena/VASP homology 1 domain-containing proteins 2)、p27Kip1表达下调,表明FOXO3A在造血干细胞功能维持及抗应激调节中发挥至关重要的作用[7]。近来研究发现由Fancd2基因介导的DNA损伤修复通路与FOXO3A基因介导的应激调节通路在造血干细胞维持上存在功能性互作[5],这为应激诱导的造血干细胞衰竭等血液疾病治疗开辟新的靶点。同时,衰老的造血干细胞中存在完整的FOXO3A介导的促自噬信号通路,保护其免受骨髓微环境中出现的能量危机、细胞因子匮乏等代谢应激损伤[14]。衰老的造血干细胞易于积累DNA损伤,通常功能丧失,被认为是提高老年人血液系统疾病发生率的根本原因之一[15]。由此,FOXO3A调节的促自噬机制是否通过保护损伤、功能缺陷的衰老造血干细胞而直接导致衰老相关血液系统疾病的发展也是我们值得关注的。
FOXO3A基因敲除动物模型对直接评价FOXO3A功能、活性调控机制,了解FOXO3A在不同情况下的调节机制,为血液病等疾病的治疗提供新思路是十分重要的。FVB/N品系小鼠受精卵有大而显著的前核,易于进行显微注射,易于进行转基因模型构建,同时,FVB/N小鼠繁殖力较强,子代数目多,采用FVB/N品系小鼠构建基因缺陷动物模型能为后续实验顺利开展提供模型保障。
将FVB背景的FOXO3A基因敲除杂合型小鼠严格按照SPF级动物饲养标准进行饲养和繁育。杂合型小鼠与野生型交配,子代经基因型鉴定后选育出杂合子,采用杂合子雌雄配对繁殖保种,可获得FOXO3A基因敲除纯合型小鼠用于后续实验。FOXO3A基因敲除杂合型雌鼠成功繁殖出子代幼鼠,雌鼠妊娠期为19~21 d,哺乳期为20~23 d,每胎产6~13只幼鼠,成活率在98%以上。幼鼠由雌鼠哺乳喂养,哺乳期为21 d左右,产后21~24 d离乳分笼。子代基因敲除纯合型小鼠与杂合型小鼠长势正常,与野生型FVB/N小鼠相比外观、生长发育未见明显差异。饲养繁育过程中,雌鼠会出现长时间不孕或产子率低的情况,应考虑互换雄鼠或替换掉年龄较大的雌鼠;若在饲养过程中出现噪音分贝高或惊吓,会发生食子现象;偶尔也出现雌鼠怀孕或产仔后雄鼠死亡现象,建议平时多注意观察照料。
基因型鉴定过程中,我们设计了三条引物,一条为通用引物,一条与通用引物来鉴定野生型,另外一条与通用引物来对鉴定FOXO3A基因敲除。通过两对引物的扩增情况来反映小鼠的基因型。同时,为了避免结果中出现的假阳性,增加鉴定的可靠性,我们设置水作为空白对照,野生型作阴性对照,杂合子或纯合子作阳性对照。
为了评价FOXO3A基因敲除对小鼠造血系统的影响,我们分别对FOXO3A基因敲除小鼠和野生型对照小鼠进行骨髓有核细胞计数分析,并采用流式细胞仪分别检测其造血祖细胞和造血干细胞的比例和数目。结果显示,骨髓有核细胞计数,野生型小鼠和FOXO3A基因敲除小鼠相比,差异无显著性。HSC比例和数目,两组间没有明显的变化。FOXO3A基因敲除的HPC的比例较野生型有所增加,但是数目差异无显著性。综上,FOXO3A基因敲除对小鼠造血系统表型没有明显的影响,初步测定结果可用于造血干细胞研究的基础数据。我们后续也会开展一系列实验来评价FOXO3A基因敲除对小鼠造血系统稳态及功能的影响。
(致谢:感谢中国医学科学院医学实验动物研究所张连峰教授、关菲菲老师、高翔老师给予的指导帮助。)

