5-氟尿嘧啶联合机械划伤致金黄地鼠口腔黏膜炎模型的建立
唐晓丽,杨 霖,杨 依,张宇轩,陈潋月,方 芳*
(1. 北京中医药大学中药学院,北京 102488;2. 首都医科大学附属北京中医医院,北京 100010)
口腔黏膜炎(oral mucositis,OM)是肿瘤患者接受放化疗后常出现的并发症,主要表现为口腔组织出现红斑、变薄,随着组织继续变薄,最终会发生溃疡[1-2]。OM引发的疼痛、吞咽困难及食欲减退等,严重影响患者生活质量[3]。目前,对OM的防治措施主要有冷冻疗法、激光疗法、抗菌消炎剂、细胞保护剂及细胞因子等,虽然防治方式多样,但临床上还未有被大家公认的疗效确切的防治方法[4]。
5-氟尿嘧啶(5-fluorouracil,5-FU)是细胞周期特异性的细胞毒类抗癌药物。临床资料显示[5],应用5-FU化疗导致OM的发生率为28%左右。本研究给金黄地鼠腹腔注射5-FU联合机械划伤颊囊,通过相关指标检测建立OM动物模型,为进一步开发防治OM的药物提供稳定的实验基础。
1 材料和方法
1.1 实验动物
12只SPF级雄性金黄地鼠,8~9周龄,体质量130~150 g,购自北京维通利华实验动物技术有限公司[SCXK (京) 2016-0011]。动物实验经由实验动物伦理委员会批准(批准号:BUCM-2-2018031101-1003),在北京中医药大学屏障环境动物室进行[SYXK (京) 2016-0038],每笼饲养3只金黄地鼠。实验动物的使用按照3R原则给予人道主义的关怀照顾。
1.2 主要试剂与仪器
5-氟尿嘧啶(美国MedChem Express公司,批号:HY-90006/CS-0993);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)ELISA试剂盒(武汉博士德生物公司);超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、BCA蛋白定量试剂盒(南京建成生物工程研究所)。酶标仪(德国BMG Labtech股份有限公司);全景扫描仪(3D Histech Pannoramic MIDI,Hungary);超声细胞破碎仪(北京平利洋医疗设备有限公司);高速低温离心机(Eppendorf AG,Hamburg,Germany)。
1.3 实验方法
1.3.1 动物分组与模型制备
1.3.2 金黄地鼠口腔颊囊宏观分析
造模后观察金黄地鼠右侧口腔颊囊划伤部分宏观变化(红斑、糜烂、血管扩张、上皮溃疡和脓肿等)并拍照,进行评分。评分标准[6]如下:0分:颊囊健康,无糜烂、血管扩张等;1分:颊囊可见红斑,无糜烂;2分:红斑严重,血管扩张,有糜烂面;3分:黏膜可见一个或多个溃疡面,总面积不超过颊囊表面区域面积的25%;4分:溃疡面面积约为颊囊表面区域的50%;5分:颊囊黏膜几乎完全溃烂。
1.3.3 口腔颊囊组织病理学检测
取右侧颊囊组织浸泡在4%多聚甲醛中进行常规石蜡包埋、切片(4 μm)及经苏木精-伊红(hematoxylin-eosin,HE)染色后脱水封片,用全景扫描仪在20倍光镜下拍照并观察口腔黏膜病变情况。
1.3.4 血清中TNF-α和IL-1β含量测定
腹主动脉取血,静置,2500 r/min离心10 min,分离血清。按照ELISA试剂盒的说明书测定血清中TNF-α和IL-1β的含量。
1.3.5 口腔颊囊组织生化指标检测
将右侧颊囊组织按照质量1∶9体积生理盐水进行匀浆,离心并分离上清,按照SOD试剂盒、MDA试剂盒以及BCA蛋白定量试剂盒的使用说明进行测定。
(1)风化裂隙及采空塌陷导水裂隙。区内对煤矿床充水有明显影响的风化裂隙主要发育在龙潭组及其上覆地层的地表浅部,而深部风化程度减弱,其导水性亦差。采矿期间产生的采空塌陷导水裂隙将起到主要的导水作用,其作用是沟通巷道上部水源,从而使充水水源渗入或涌入矿井。由此可见,采空塌陷导水裂隙具有明显导水作用。
1.3.6 脏器指数测定
迅速剖取金黄地鼠胸腺和肾上腺,称湿重,计算脏器指数:脏器指数=脏器质量(g)/体质量(g)× 100%。
1.4 统计学方法
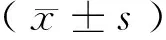
2 结果
2.1 5-FU联合机械划伤对金黄地鼠进食量和体重的影响
与对照组相比,模型组动物在造模后第1~8天内每只动物的日平均进食量显著减少(P< 0.01)。模型组在造模后第8~14天内每只动物的日平均进食量有所恢复,与对照组相比无明显差异(见表1)。
实验期间,对照组动物的体重未见明显变化,而造模后第8天模型组动物体重降低,其它时间点未见明显变化(见表2)。
2.2 5-FU联合机械划伤对金黄地鼠口腔颊囊宏观变化的大体观察
对照组颊囊比较红润且颜色较浅,无血管扩张,模型组在造模后第1天出现红肿,与对照组相比颊囊颜色明显较深,评分明显升高,第3天出现溃疡面但面积较小,评分达高峰(P< 0.01),第8天之后颜色逐渐恢复,评分降低,且溃疡情况明显好转,第10天及第14天的颊囊损伤恢复,评分与对照组相同(见图1、表3)。
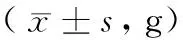
表1 5-FU联合机械划伤对金黄地鼠进食量的影响Table 1 Effect of 5-FU combined with mechanical scratch on food intake of golden hamsters
注:与对照组相比,**P< 0.01。
Note. Compared with the control group,**P< 0.01.
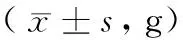
表2 5-FU联合机械划伤对金黄地鼠体重的影响Table 2 Effect of 5-FU combined with mechanical scratch on the weight of golden hamsters
注:与对照组相比,P> 0.05。
Note. Compared with the control group,P> 0.05.
2.3 HE染色观察5-FU联合机械划伤对金黄地鼠颊囊组织的病理损伤
颊囊组织HE染色结果显示:对照组动物颊囊组织的表皮层结构清晰,真皮层胶原含量丰富且排列紧密;肌层部分肌细胞排列疏松,间隙增大,组织未见明显炎症反应。模型组动物在造模后第8天可见颊囊组织中皮下血管周围有较多肥大细胞;第14天时,可见肌层肌细胞排列疏松,间隙增大且肌层血管附近有少量肥大细胞。与对照组相比,模型组炎症反应重,肥大细胞数量多(见图2)。

表3 5-FU联合机械划伤对金黄地鼠口腔颊囊宏观影响的评分Table 3 Effect of 5-FU combined with mechanical scratch on macroscopic scores of right cheek pouch of golden hamsters
注:与对照组相比,**P< 0.01。
Note. Compared with the control group,**P< 0.01.

注:A:对照组;B:模型组造模后第1天;C:模型组造模后第3天;D:模型组造模后第8天;E:模型组造模后第10天;F:模型组造模后第14天。图1 5-FU联合机械划伤对金黄地鼠右侧颊囊的宏观影响Note. A: Control group. B: Model group on day 1 after surgery. C: Model group on day 3 after surgery. D: Model group on day 8 after surgery. E: Model group on day 10 after surgery. F: Model group on day 14 after surgery.Figure 1 Macroscopic effect of 5-FU combined with mechanical scratches on the right cheek pouch of golden hamsters
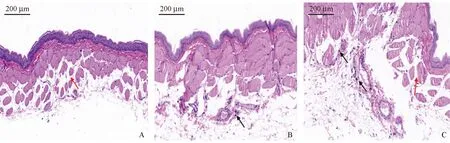
注:A:对照组第8天;B:模型组第8天;C:模型组第14天。肌层部分肌细胞间隙增大,如图中红色箭头所示;皮下血管周围较多肥大细胞,如图中黑色箭头所示。图2 5-FU联合机械划伤对金黄地鼠颊囊组织的影响(HE染色,× 20)Note. A: Control group on day 8. B: Model group on day 8. C: Model group on day 14. The space between some muscle bundles was increased, as indicated by the red arrow in the figure. High numbers of mast cells were present around subcutaneous blood vessels, as indicated by the black arrows in the figure.Figure 2 Effect of 5-FU combined with mechanical scratch on cheek pouch tissue in golden hamsters. HE staining
2.4 5-FU联合机械划伤对金黄地鼠血清中TNF-α和IL-1β含量的影响
与对照组相比,模型组在造模后第8天和第14天金黄地鼠血清中TNF-α、IL-1β的含量均有明显升高(P< 0.05,P< 0.01)。随着时间的延长,模型组金黄地鼠血清中TNF-α、IL-1β的含量逐渐升高(见表4)。
2.5 5-FU联合机械划伤对金黄地鼠颊囊组织MDA含量和SOD活性的影响
与对照组相比,模型组在造模后第8天和第14天金黄地鼠颊囊组织中MDA的含量明显升高(P< 0.05),SOD的活性明显降低(P< 0.05,P< 0.01)(见表5)。
2.6 5-FU联合机械划伤对金黄地鼠脏器指数的影响
与对照组相比,模型组金黄地鼠第8天和第14天的肾上腺指数和胸腺指数均无明显差异(见表6)。

表4 5-FU联合机械划伤对金黄地鼠血清中TNF-α和IL-1β含量的影响Table 4 Effect of 5-FU combined with mechanical scratch on serum TNF-α and IL-1β in golden hamsters
注:与对照组相比,*P< 0.05,**P< 0.01。
Note. Compared with the control group,*P< 0.05,**P< 0.01.
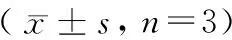
表5 5-FU联合机械划伤对金黄地鼠颊囊组织中MDA含量和SOD活性的影响Table 5 Effect of 5-FU combined with mechanical scratch on MDA content and SOD activity in cheek pouch tissue of golden hamsters
注:与对照组相比,*P< 0.05,**P< 0.01。
Note. Compared with the control group,*P< 0.05,**P< 0.01.
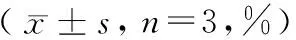
表6 5-FU联合机械划伤对金黄地鼠的脏器指数的影响Table 6 Effect of 5-FU combined with mechanical scratch on the organ indexes of golden hamsters
注:与对照组相比,P> 0.05。
Note. Compared with the control group,P> 0.05.
3 讨论
近年来,化疗对肿瘤的治疗作用越来越明显,但是随之而来的并发症OM也越来越严重。据文献报道[7],对接受化疗的患者进行口腔检查时,发现59%的癌症患者出现红斑、糜烂等口腔软组织炎症。化疗所致口腔黏膜损伤的发生机制可能与口腔黏膜上皮细胞的直接损伤作用和骨髓抑制等有关,但具体发病机制尚不完全明确[8]。有研究表明,OM的病理学过程分为五个阶段:启动,信息生成,信号放大,溃疡和愈合。在初始阶段,通过产生氧化应激和活性氧,内皮细胞、成纤维细胞和上皮细胞会出现DNA损伤。转录因子如核因子-κB(NF-κB)的激活导致许多基因上调,包括IL-1β和TNF-α,进而引发炎症反应和增加皮下血管分布。这些细胞因子也参与正反馈循环,放大初始反应,最终可能导致疼痛的黏膜发生溃疡[9]。
目前,国内有很多关于化疗致OM的临床研究报道,但是对于如何建立化疗致口腔黏膜炎动物模型的研究却很少。化疗致OM产生的关键因素是化疗药物而非肿瘤自身,虽然选用正常动物在模拟临床肿瘤患者化疗后OM产生过程上有一定的局限性,但是相比荷瘤动物应用方便,也可出现类似于临床的症状,故有关化疗致OM的研究大多采用正常动物。国外用于OM研究的动物主要有:大鼠[10],仓鼠[11],金黄地鼠[6]等。仓鼠和金黄地鼠具有口腔颊囊大的典型特征,易于观察,常被用作研究OM的动物模型。Lima等人[11]的研究证明了用5-FU干预仓鼠,然后对颊囊进行机械性创伤会导致严重的OM,在第5天出现红斑,充血,出血以及大面积的溃疡和脓肿,第10天炎症程度达到最大。Medeiros等[12]使用5-FU诱导金黄地鼠口腔黏膜炎,在初次注射后第10天显著增加了颊囊组织中TNF-α和IL-1β的含量。本实验使用金黄地鼠研究5-FU联合机械划伤致OM的模型,通过拍照观察发现在造模后第3天金黄地鼠口腔颊囊出现溃疡面,炎症反应最明显且评分最高,随着时间的延长,从第8天开始炎症反应逐渐减轻,第14天基本恢复正常。HE染色显示,在第8天和第14天模型组金黄地鼠颊囊组织均有肌细胞间隙增大及皮下血管周围细胞肥大现象,存在炎症反应。本研究还发现,在造模后第8天和第14天金黄地鼠血清中TNF-α和IL-1β的含量均明显升高。这提示虽然宏观方面观察口腔颊囊在第8天后开始恢复,但是在第14天血清中促炎症细胞因子的含量仍然较高,炎症反应依然存在。本实验结果可以看出,此造模方法模拟了化疗药物所致OM的临床表现(如红斑,溃疡等)。
在OM的初始阶段,口腔黏膜释放自由基和各种炎症介质诱导氧化应激,这种氧化应激状态除了减少抗氧化酶如SOD的活性外,还会使MDA的水平增加[13],而氧化应激损伤也会进一步加重炎症反应。据文献报道[14],采用5-FU诱导雄性金黄地鼠口腔黏膜炎,颊囊组织中MDA的含量明显较高,SOD的活性明显较低。本研究发现,用5-FU联合机械划伤诱导金黄地鼠口腔黏膜炎,在造模后第8天及第14天颊囊组织中MDA的含量明显升高,SOD的活力显著下降。这提示5-FU联合机械划伤对金黄地鼠影响持续时间较长,在第14天MDA的含量和SOD的活性未见恢复,口腔颊囊组织炎症反应仍然存在。
本研究还发现,与对照组比较,模型组金黄地鼠在造模后8 d内日平均进食量明显减少且体重减轻,而第8~14天内的日平均进食量和体重未见明显差异。这提示造模引起的口腔黏膜炎症影响了动物进食和体重。
肾上腺和胸腺与体内的炎症反应有关,胸腺是体内重要的免疫脏器,脏器相对质量的变化称为脏器指数,能够评估动物的免疫功能,同时也是临床上最常用、最基本的评估指标[15]。本实验中未见金黄地鼠的肾上腺指数和胸腺指数有明显变化。
综上所述,5-FU联合机械划伤可以引起OM的临床症状,在造模后第3天最明显,8 d后慢慢恢复,但促炎症细胞因子和氧化应激反应在造模后14 d持续存在,提示成功建立金黄地鼠口腔黏膜炎动物模型,可用于口腔黏膜炎发病机制及治疗药物的研究。
注:金黄地鼠是仓鼠科仓鼠亚科金仓鼠属动物,在公开出版物中使用仓鼠作为名称更为科学。但鉴于目前我国实验动物国家标准中提到的动物的种类都是地鼠,作为专业人员能够清楚该物种在动物分类中地位,并不妨碍科学研究的成果和使用,故本文在发表时仍沿用“金黄地鼠”,待国标修订后再统一命名为“仓鼠”。

