基于巢氏病例对照研究丹参川芎嗪注射液疑似过敏反应的影响因素分析❋
李 敏,谢雁鸣,章轶立,高 阳△,徐鸿燕
(1. 中国中医科学院中医临床基础医学研究所,北京 100700; 2. 中国中医科学院眼科医院,北京 100040;3.中国人民大学统计学院,北京 100872)
丹参川芎嗪注射液(贵州拜特制药有限公司,国药准字H52020959)具有扩张动脉、抗血小板凝集和改善微循环等作用,主要用于心脑血管疾病的治疗。丹参川芎嗪注射液虽然治疗效果显著,但发生过敏反应的情况也同样不容忽视[1-3]。丹参川芎嗪注射液最新版说明书上记有“未发现明显毒副作用,曾报道有过敏反应,可见皮疹、瘙痒、心悸、胸闷、寒战、头晕、头疼、恶心、呕吐、胃肠道不适、浅静脉炎等,停药后消失。曾有过敏性休克和喉头水肿报道”的标注。为了解真实世界中丹参川芎嗪注射液发生过敏反应的影响因素,本研究收集全国24家三甲医院信息系统(hospital information system,HIS)中使用丹参川芎嗪注射液住院患者的住院信息,采用巢氏病例对照(nested case-control study,NCCS)研究设计和Logistic回归分析的统计方法,探索使用丹参川芎嗪注射液出现疑似过敏反应的人群中,可能引起过敏反应的相关因素,为丹参川芎嗪注射液的合理用药提供科学依据。
1 材料与方法
1.1 数据来源
本数据来源于中国中医科学院中医临床基础医学研究所构建的HIS数据仓库,选取2006年10月至2015年12月全国24家大型三甲医院HIS数据库中使用丹参川芎嗪注射液的住院患者,包括基本信息表、西医诊断信息表、医嘱信息表等数据。
1.2 数据规范化
本研究数据来源于多家医院,各家医院在同一项目中采纳的标准不尽相同。为便于分析,需要对数据进行规范化。参照西医《诊断学》第7版对西医诊断信息进行规范化;将数据库中记录为商品名称的化学药物转化为化学通用名称并合并相同项。对合并用药,采取合并同种化学成分的方式对化学药物进行规范,将同类药物成分但剂型不同的中成药进行合并,其他中成药保留原始名称,对合并用药的分析均基于标准化后的数据。
1.3 研究对象及数据界定
本研究的研究对象为使用丹参川芎嗪注射液后出现疑似过敏反应的人群。疑似过敏反应人群的界定:使用丹参川芎嗪注射液后立即停药,并且在24 h以内使用抗过敏药物(苯海拉明、异丙嗪、扑尔敏、赛庚啶、息斯敏、特非拉丁、地塞米松、氯雷他定、地氯雷他定、西替利嗪、咪唑斯汀、依巴斯汀、非索非那定、左西替利嗪、葡萄糖酸钙等)。
1.4 研究设计
根据数据的界定标准,在数据库中使用丹参川芎嗪注射液共有37548例住院患者,其中发生疑似过敏反应的病历124例(0.33%),未发生过敏反应的病历37424例。采用回顾性NCCS的设计方法,以性别相同、年龄±3岁作为配比条件,按照1∶4的方法进行匹配,最终纳入620个数据。将研究对象分为过敏组和对照组,病例组开始使用丹参川芎嗪至停止使用的时间范围在0~24 h,期间仅使用1次,停止使用后的24 h内使用抗过敏药物,且使用丹参川芎嗪注射液前与使用中均未使用抗过敏药物者。对照组开始至停止使用丹参川芎嗪注射液时间>7 d,且用药时未使用地塞米松注射液、异丙嗪、氯雷他定、维生素C注射液、葡萄糖酸钙注射液等常用抗过敏药物。
1.5 统计学方法
采用Logistic回归分析统计方法,采用SAS.9.2软件作为分析软件。
2 结果
基于现有HIS数据库信息,结合临床实际情况,考虑最有可能成为过敏反应影响因素的有64个,分别为合并病(频数前30位)、合并用药(剔除苯海拉明、异丙嗪、扑尔敏、赛庚啶、息斯敏、特非拉丁、地塞米松、氯雷他定、地氯雷他定、西替利嗪、咪唑斯汀、依巴斯汀、非索非那定、左西替利嗪、葡萄糖酸钙后的频数前30位)、住院天数、疗程、单次剂量、日剂量。运用条件logistic回归进行数据建模分析,采用逐步选择法筛选变量,对使用丹参川芎嗪注射液出现疑似过敏反应的影响因素进行分析判断。
2.1 合并用药对比分析
过敏组与对照组比较,合并用药影响因素中呋塞米片和前列地尔注射液的P值分别为0.003、0.007,且回归系数为正,说明丹参川芎嗪注射液在联合使用呋塞米片或前列地尔注射液时,发生过敏反应的危险会大大增加。同时筛选联合用药中胸腺肽的P值为0.001,回归系数为负数,说明胸腺肽是使用丹参川芎嗪注射液疑似发生过敏反应的保护因素。
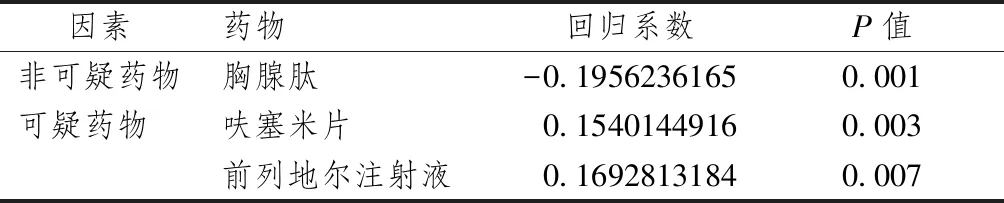
表1 合并用药影响因素分析结果
2.2 合并疾病对比分析
过敏组与对照组比较,恶性肿瘤的P值为0.045,且回归系数估计值为正,说明使用丹参川芎嗪注射液合并恶性肿瘤时发生疑似过敏反应的危险会大大增加;同时筛选合并疾病中慢性肾病的P值为0.022,回归系数估计值为负数,说明慢性肾病是使用丹参川芎嗪注射液疑似发生过敏反应的保护因素。

表2 合并疾病影响因素分析结果
2.3 住院天数对比分析
过敏组与对照组比较,住院天数时间段为8~14、15~28、>28 d的P值分别为0.018、0.003和0.001,且其回归系数均为负数,说明住院天数分段中8~14、15~28、>28 d是使用丹参川芎嗪注射液的保护因素。

表3 住院天数影响因素分析结果
2.4 用药剂量对比分析
过敏组与对照组比较,丹参川芎嗪注射液单次用药剂量、日剂量、疗程分段P值均>0.05,说明单次用药剂量、日剂量、疗程分段并不是导致丹参川芎嗪发生过敏反应的影响因素。
3 讨论
3.1 使用丹参川芎嗪注射液发生疑似过敏反应的影响因素
联合用药是药物相互作用的基础,药物相互作用的结果是将单一药物的疗效变成多个药物的综合疗效,而不良反应的出现是药物相互作用不良效应的体现[4]。
丹参川芎嗪注射液与前列地尔注射液联合用药时发生过敏反应的可能性较大,其原因可能是前列地尔注射液可扩张血管,增加毛细血管通透性,促使炎症渗出和黏液腺分泌增多,机体可出现过敏症状[5]。前列地尔注射液是以脂微球为药物载体的静脉注射用制剂,其将前列腺素E1封入直径0.2 μm的脂微球中,增加其靶向性。但如果少量的前列腺素E渗透至脂微球载体外,即可引起一系列的不良反应[6]。丹参川芎嗪注射液与前列地尔注射液皆可扩张血管,改善微循环,两种药物的药理作用叠加是导致不良反应的主要原因[7]。丹参川芎嗪为含有丹参提取物和盐酸川芎嗪的化学药物,其中丹参提取物以丹参素为代表成分在体内的吸收,但其在体内分布、代谢和排泄的机制并不是十分清楚,可能因化学成分、pH值等改变使微粒数增加,微粒进入血管引起局部血栓、血肿、损伤、坏死,产生微血管阻塞并发生不良反应。而前列地尔注射液是一种分子量较大,含有注射用大豆油、卵磷脂、甘油等油性成分的乳状液体,对血管有一定的刺激作用,两种药物合用可能通过化学成分改变增加微粒数引起不良反应[8]。
丹参川芎嗪注射液与呋塞米片联合用药发生过敏反应的可能性较大,其原因在于呋塞米与丹参川芎嗪注射液存在配伍禁忌[9-11]。有学者提出丹参川芎嗪注射液与呋塞米注射液配伍后产生白色沉淀,因丹参川芎嗪注射液为酸性,呋塞米注射液为弱碱性,混合后pH值发生改变,因而使药物析出[12]。这类文献报道为本研究探讨丹参川芎嗪注射液与呋塞米片联用发生过敏反应的机制提供了相关线索。且呋塞米片属于磺胺类非抗菌药,其与磺胺类抗菌药之间易发生交叉过敏反应。也有学者认为,本身过敏反应易感性增高的患者(如青霉素过敏史患者)在使用磺胺类非抗菌药之后亦有较大可能出现过敏反应,因此临床对于存在磺胺类抗过敏药物和青霉素过敏的病人使用呋塞米片时要谨慎[13]。
丹参川芎嗪注射液与恶性肿瘤合并使用时发生过敏反应的情况往往较多。对于肿瘤患者而言,过敏产生的原因与肿瘤产生的组胺、癌胚蛋白等生物活性物质的释放刺激感觉神经有关。另一方面肿瘤致病因子和肿瘤细胞作为一种异体抗原或致敏原,不断刺激机体产生抗体如IgE抗体等,从而形成类过敏反应[14]。中药抗癌要把握合适的时机,如患者已行根治手术或放化疗术后,中医药治疗应以“扶正”为主,此时若再以活血化瘀药攻伐,稍有疏忽就会产生中药的毒副作用。相关文献报道,丹参类制剂不宜与抗癌药环磷酰胺、环己亚硝胺等通用,其可能会促进恶性肿瘤的转移,并对某些抗癌药物具有增敏作用。这可能与其减少瘤组织内DNA含量有关[15-16]。 丹参川芎嗪注射液成分复杂,其主要致敏原因是由鞣质引起的,鞣质进入机体后,可作为半抗原与血浆蛋白的氨基缔合成更大分子的复合物,引起机体的变态反应。抗癌靶向药物中阿昔替尼、厄洛替尼、利妥昔单抗和曲妥珠单抗等均属于大分子药物,其引起的过敏反应在国内外均有文献报道,推测可能与其影响皮肤滤泡和间质细胞表皮生长因子信号通路有关。由于丹参川芎嗪注射液和抗癌药都有致变态反应特性,且两药物联合使用时,丹参川芎嗪注射液中的某些成分可能与抗癌药物缔合成更大分子的复合物而加大过敏反应[17-19]。
3.2 本研究的不足
本研究的局限性在于HIS数据库提供的是回顾性数据,且研究数据也是根据患者是否使用抗过敏药物推测获得,缺乏过敏反应的判断。因此本研究得到的可疑过敏反应影响因素仅做参考,还需要进一步的临床试验进行验证。

