运动调节可溶性Klotho的研究现状与展望
饶志坚 郑莉芳 常芸 于涛 史仍飞
1上海师范大学体育学院(上海 200234)
2上海体育学院运动科学学院(上海200438)
3国家体育总局体育科学研究所(北京100061)
1 前言
目前,人类对衰老的认知已经取得了巨大的进步,并据此发展出了各种策略以预防、延缓甚至逆转衰老。据统计全球老年人群在2050年将急剧增加,随着寿命的延长意味着老年期也越长,而在衰老期会出现各种慢性病,如心血管疾病、癌症和神经退行性病变,在发展中国家这些疾病是致病和致死的主要因素,且为此花费巨大。因此,人们不仅关注寿命,更加关注健康寿命。
Klotho是由Kuro-o等在1997年发现的一种抗衰老基因并得以命名[1]。在Klotho-/-小鼠中发现多种与衰老相关的症状,如运动神经元变性、骨量减少、皮肤皱缩、软组织钙化、动脉粥样硬化、听力减退、认知功能障碍、不育等,而且这种小鼠与野生型小鼠相比寿命显著下降,在2月龄左右会因衰老而死亡[1]。相反,若小鼠过量表达Klotho,则其寿命可延长20%~30%[2]。人体研究结果也发现,40岁之后人血清Klotho水平下降[3-5],且在一些患有与衰老相关疾病的患者中(如癌症、高血压、肾病等)也发现血清Klotho浓度下降[6]。这些结果表明Klotho可能会影响衰老的进程,这一发现引起许多研究人员的兴趣,从而展开对Klotho的研究。后来研究发现,Klotho除了具有抗衰老功能外,还参与调节矿物质[7]和能量代谢[8],改善认知功能[9]等。
运动能延缓衰老,降低与衰老相关疾病的发病率和死亡率;运动还能提高骨密度,改善认知功能,降低心血管疾病、糖尿病及肾病的风险等[10]。但运动给人体带来这些益处的具体机制仍不清楚。相似地,高水平的血清Klotho与上述的多种症状呈负相关[6]。运动和Klotho的效果有如此多的相同之处,那么运动与Klotho的表达水平有着怎样的关联?运动是不是通过调节Klotho的表达来实现其给人体带来的部分益处?本文对此展开综述。
2 Klotho一般概述
2.1 Klotho的分类
目前发现3种Klotho相关基因:α-Klotho,这种基因在多种组织中表达,主要是在肾脏和大脑,它可能参与矿物质平衡的调节[1];β-Klotho,这种基因主要在肝脏、脾脏、脂肪组织及大脑中表达,它参与唾液酸、脂代谢和能量代谢[11,12];γ-Klotho,这是一种半分子 Klotho相关蛋白,主要表达在棕色脂肪组织[13,14]。本文所提到的Klotho都是指α-Klotho。
Klotho蛋白存在5种不同的形式,包括一种单次跨膜蛋白和三种脱落蛋白以及一种分泌型蛋白,如图1。单次跨膜和脱落形式的蛋白是由同一种mRNA转录而来的,最初会生成一种分子量约130的单次跨膜Klotho蛋白,称为m-Klotho。m-Klotho的C端包括穿膜和细胞内片段,而细胞外的部分有两个结构域,KL1和KL2。每一个KL结构域都拥有葡萄糖苷酶活性,它能从碳水化合物糖蛋白中剪切出唾液酸。脱落型Klotho是由ADAM10、ADAM17及BACE1剪切细胞表面m-Klotho所释放的,目前发现两个剪切点:第一个是直接紧邻着细胞外膜剪切,称为α剪切;第二个是在KL1和KL2之间剪切,称为β剪切。近邻细胞外膜剪切后得到的蛋白包括KL1和KL2(p-Klotho),而在KL1和KL2之间剪切得到的蛋白只含有KL1(p-KL1)[15]。如果同时剪切两个位点的话则可得到脱落的 p-KL1和另一种含有KL2的蛋白(p-KL2)[16]。相比之下,分泌型Klotho(s-Klotho)是由另一段基因转录翻译后形成的,这段基因存在于KL1基因之后是一种比较短且独特的序列,这段序列可产生一种几乎与p-KL1相同的蛋白,但是有一种与p-KL1截然不同的C端[17](p-KL1:SQLTKPISSLTKPYH;s-KL1:DTTLSQFTDLNVYLW)。但这种小的C端是否会导致s-Klotho和p-Klotho具有不同的功能还不明确。
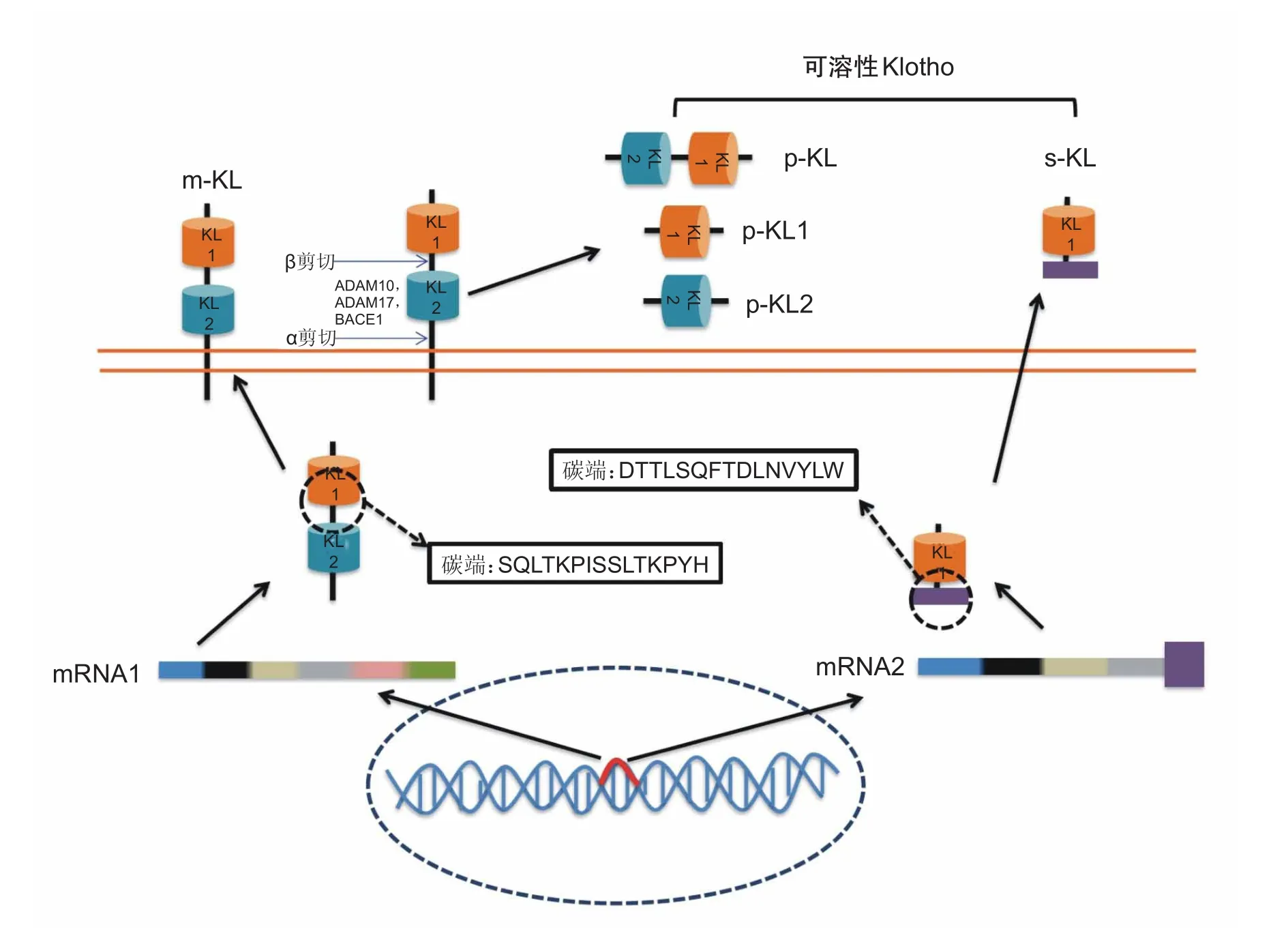
图1 Klotho的分类
2.2 可溶性 Klotho的生物学功能
目前m-Klotho的作用相对比较清楚,它可作为纤维细胞生长因子受体(FGFR)的共受体与纤维细胞生长因子23(FGF23)结合发挥一些关键作用,包括调节维生素D、钙以及磷的代谢[11,18]。相比之下,可溶性Klotho的作用目前还不是很明确。Klotho主要表达于肾脏和大脑[1],然而Klotho-/-小鼠中的一些不表达Klotho的细胞也被发现出现功能障碍,表明Klotho能作为一种激素远程作用于其它细胞。近些年的相关研究揭示了可溶性Klotho作为一种循环激素的生物学效应及其可能机制(如图2),综述如下。
研究发现可溶性Klotho具有抗衰老的作用,主要原因在于它能抑制胰岛素样生长因子信号通路[2,19]。可溶性Klotho抑制胰岛素样生长因子信号通路导致叉头转录因子(FOXO)的激活,并上调抗氧化酶的基因的表达,如锰超氧化物歧化酶(MnSOD),这对清除活性氧及降低氧化应激十分重要[20]。除了胰岛素/胰岛素样生长因子-1(IGF-1)通路外,可溶性Klotho还能通过其他抗氧化通路来发挥其细胞保护作用,如环磷酸腺苷/激酶A(cAMP/PKA)[21,22]。此外,可溶性 Klotho可通过增强细胞的氧化能力保护细胞免受于高氧和磷的毒性损伤,这可能是通过增加核呼吸因子1/2(Nrf1/2)转录活性实现的[23]。可见可溶性Klotho可通过多条信号通路抑制氧化应激,从而发挥其抗衰老的作用。
心血管疾病发病率的降低与血清中可溶性Klotho水平升高有关[24]。研究证实内皮细胞功能障碍与Klotho的表达负相关,表明可溶性Klotho的降低可能是心血管疾病的风险因素[1]。内皮细胞功能障碍在动脉粥样硬化发展过程中发挥着重要作用[25],可溶性Klotho对血管的保护作用可能是通过调节一氧化氮(NO)利用度来减轻内皮细胞功能障碍而实现的[21,26,27]。
可溶性Klotho也可能是一种肿瘤抑制因子,可以对包括乳腺癌、宫颈癌、胰腺癌、黑色素瘤、胃癌、大肠癌、肺癌、肝癌、肾细胞癌和卵巢癌等疾病的发生有抑制作用[28]。体外实验发现,可溶性Klotho可通过调节多条通路来抑制肿瘤,包括胰岛素/IGF-1通路、FGF通路、Wnt信号通路以及转化生长因子-β(TGF-β)通路[29,30]。
可溶性Klotho还能调节瞬时受体电位阳离子通道(TRPC)6、TRPC1、TRVP5及ATP调节钾离子通道ROM(ROMK)1离子通道,从而维持内皮细胞的完整性、保护内皮细胞的通透性,防止内皮细胞功能障碍[31,32]。此外,可溶性Klotho可能还具有抗炎作用,在Klotho-/-小鼠中肿瘤坏死因子α(TNF-α),Wnt和γ-干扰素(IFNγ)的表达水平升高,这些炎症因子的上调促进了小鼠的衰老[33]。
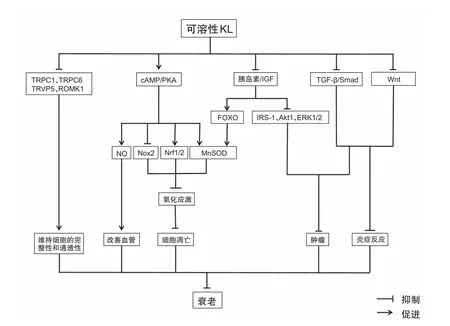
图2 可溶性Klotho的功能
2.3 可溶性 Klotho的来源
如上所述,可溶性Klotho蛋白主要包括两种类型:脱落型和分泌型。可溶性Klotho能在人体多种体液中检测出来,如血液、尿液和脑脊液[34,35]。Klotho在肾脏中表达最多,因此可溶性Klotho可能是来源于肾脏。Lindberg等[36]发现小鼠全肾敲除Klotho基因后,在这些小鼠的肾脏中检测不到可溶性Klotho,此外,这些小鼠血清可溶性Klotho水平与野生型小鼠相比下降80%左右。因此,这项实验表明肾脏是血清中可溶性Klotho的主要来源。然而,特异性敲除近曲小管的Klotho基因对血清可溶性Klotho水平的影响不大[37],这可能是由于可溶性Klotho在近曲小管的表达水平远低于远曲小管,因此仅仅敲除近曲小管的Klotho基因不足以降低血清可溶性Klotho浓度。另一个可能的解释是近曲小管的Klotho从顶端流入尿液,并不会影响血液可溶性Klotho的水平。
Hu等[38]从大鼠和人类肾脏的下腔静脉和上腔静脉取血并检测两种血液中可溶性Klotho的水平,结果发现下腔静脉与上腔静脉血中可溶性Klotho浓度比值大于1,表明可溶性Klotho是由肾脏释放到循环中的。在双侧肾切除的大鼠中,其血清可溶性Klotho浓度在一天之内降低到原来的一半,进一步表明肾脏是可溶性Klotho来源的主要器官。此外,可溶性Klotho的清除可能也是在肾脏中完成的,将合成的Klotho注射入无肾大鼠后发现其清除速度显著降低,表明肾脏对可溶性Klotho的清除具有重要作用[38]。除了上述几个研究,其它关于血清可溶性Klotho的来源的报道很少。慢性肾病的病人其血清可溶性Klotho浓度显著低于健康人群[39,40]。然而,慢性肾病与全身性Klotho表达下降有关[41],因此并不能证明可溶性Klotho仅来源于肾脏。
3 运动对可溶性Klotho的影响
人体和动物实验研究都已经证明运动后血清可溶性Klotho会发生相应的变化,如Sven-Jean等[42]发现,无论男女,受试者在大强度运动后即刻其血清可溶性Klotho浓度升高,而在半小时后回复到运动前水平。Amaro-Gahete等[43]也发现12周的运动干预可提高受试者血清Klotho的水平。而其它研究表明依据受试者年龄、性别、健康状况以及身体素质的不同,运动对血清可溶性Klotho的影响也有所不同,此外运动的强度及类型也能影响血清可溶性Klotho的变化,具体分述如下。
3.1 年龄
随着年龄的增长,血清可溶性Klotho的浓度也随之下降,这一点已经在人体中被证实[3]。而运动则能上调年龄引起的血清可溶性Klotho下降,且改善衰老相关症状。Behrouz等[44]发现中年大鼠(13~15月龄)血清可溶性Klotho浓度显著低于青年大鼠(4月龄),而经过中强度有氧运动后中年大鼠血清可溶性Klotho浓度升高,在第8周时出现明显升高(文中未给出具体数值,因此无法得知增加幅度)。此外,他们还发现与青年大鼠相比,中年大鼠心肌细胞氧化应激水平显著升高,且心肌出现纤维化,而经过8周有氧运动后上述情况得到改善;他们还观察到有氧运动后心肌ERK及P38 MAPK表达水平上调,因此他们认为有氧运动可增加可溶性Klotho的水平,进而激活ERK和P38通路,从而降低心肌细胞氧化应激水平,缓解年龄相关的心肌纤维化。在人体实验中,Tomoko等[45]也发现12周有氧运动后绝经期女性血清可溶性Klotho浓度增加,并且伴随着血管僵硬度下降,他们认为可溶性Klotho在其中发挥重要作用。虽然这两项研究都发现运动能改善年龄引起的血清可溶性Klotho浓度下降,但是运动能否增加青年时期血清可溶性Klotho的浓度?若是能增加,那么随着年龄的增加运动后血清可溶性Klotho的变化程度是否有差异?
针对上述问题,Elmira等[46]发现年轻橄榄球运动员(18~22岁)血清可溶性Klotho浓度(3.38 ng/ml)显著性高于对照年轻人群(18~27岁,1.39 ng/ml),表明运动确实能提高年轻人群的血清可溶性Klotho浓度。随后,Keith等[47]对年轻小鼠和老年小鼠进行一次急性的45分钟中强度有氧运动,两组小鼠之前都没有训练过,然后对比运动前和运动后血清可溶性Klotho浓度的变化。结果显示,与运动前相比,两组小鼠运动后血清可溶性Klotho浓度都显著性增加,且都增加到运动前的两倍左右。同时,他们还观察了经过16周训练的年轻女性(平均36岁)和12周训练的老年女性(平均68.3岁)在一次急性运动后血清可溶性Klotho的变化情况,结果显示急性运动后年轻女性血清可溶性Klotho增加了30.1%,而老年女性增加了15.3%。相似地,Moran等[48]对比男性年轻运动员(平均23.9岁)和非运动员(平均24.5岁)血清可溶性Klotho的水平,结果发现年轻运动员比非运动员高19.4%;同时他们还对比了男性老年运动员(平均58.1岁)和非运动员(平均58.6岁)血清可溶性Klotho的水平,发现老年运动员比非运动员高35.5%。
这些研究表明运动可引起血清可溶性Klotho浓度增加,且并不依赖于年龄。但现有的研究还无法确定年龄对运动后血清可溶性Klotho增加幅度的影响,这其中可能还与受试者性别、身体素质等有关。
3.2 性别
性别可能影响到运动后血清可溶性Klotho浓度的增加幅度。Alana等[49]分别检测了男性(平均32.7岁)和女性(平均36.3岁)一次急性20分钟大强度跑台运动后血清可溶性Klotho的变化,结果发现女性受试者运动后血清可溶性Klotho水平显著高于运动前,而男性运动前后血清可溶性Klotho浓度变化不大。因此,他们认为运动可引起血清可溶性Klotho浓度升高,特别是在女性人群中。然而,正如该作者在文章中交待的一样,这些受试者之前至少进行了一年的力量运动或耐力运动(每周3~4次),但作者并未区分男性和女性受试者中分别有哪些人参加了耐力运动、哪些人参加了力量运动,那么这些不同的训练类型是否会影响急性大强度运动后血清可溶性Klotho的变化?另一项试验中,Sven-Jean等[42]研究发现,男性(平均47岁)和女性(平均50岁)受试者在一次急性大强度运动(经典Bruce方案)后即刻血清可溶性Klotho浓度分别上升23.4%和14.3%。这项研究中,作者排除了吸烟以及药物的可能影响,但是他们并未交待这些受试者之前是否进行过运动锻炼、进行过什么类型的锻炼。因此,这两项实验在急性大强度运动后,男女受试者的血清可溶性Klotho上升幅度的趋势不一致。这种不一致可能是由于受试者身体素质不一样,或者之前所进行的运动项目不一样。因此,今后的研究应减少混淆因素,控制单一变量,才能更清楚地反映出性别对运动后血清可溶性Klotho变化的影响。
3.3 身体素质
年轻女性未经训练时,一次急性运动后血清可溶性Klotho浓度与运动前相比变化不大,而经过16周有氧运动训练后,再次进行一次急性运动,结果发现与运动前相比血清可溶性Klotho浓度升高30.1%,显著高于16周训练前的变化。该研究在老年女性身上得到了相似的结果,未经训练时老年女性急性运动后血清可溶性Klotho浓度变化不大,在经过12周的有氧训练后,急性运动可显著增加血清可溶性Klotho的浓度[47]。此外,还有研究表明同等年龄和性别的情况下,运动员血清可溶性Klotho浓度高于非运动员[46,48]。
这些结果表明,运动引起的血清可溶性Klotho浓度的变化可能与身体素质有关,身体素质越好,运动后血清可溶性Klotho的升高幅度越大。
3.4 健康状况
大鼠经16周高脂饮食后,血清可溶性Klotho浓度明显低于普通饲料组大鼠,而另外两组大鼠经24周高脂饮食,其中一组不做任何处理,另一组大鼠在16周时开始进行为期8周的游泳运动,在24周时检测两组大鼠血清可溶性Klotho浓度时发现运动组显著高于高脂对照组,而且运动组大鼠胰岛素抵抗得到一定的改善[50]。因此,该研究认为运动改善长期高脂饮食引起的胰岛素抵抗可能是通过提高可溶性Klotho浓度实现的。
Moran等[51]比较经一年有氧训练和未经训练的冠心病患者及年龄匹配的健康人群血清可溶性Klotho的浓度,结果发现,未训练的冠心病患者血清可溶性Klotho浓度略微低于健康人群,但没有显著性差异,而经过训练的冠心病患者其血清可溶性Klotho浓度显著高于未训练的冠心病患者,据此推测运动改善冠心病的效果可能是通过提高血清可溶性Klotho浓度实现的。
3.5 运动负荷
尽管之前的研究发现运动可提高血清可溶性Klotho的浓度,而且无论中强度还是大强度有氧运动都有效果,但是没有研究对比不同运动负荷对可溶性Klotho的增加效果是否一样。Stefania等[52]采用三种不同负荷(小、中和大负荷)有氧运动对大鼠进行为期四周的干预,结果发现三种负荷都能使大鼠血清可溶性Klotho浓度升高,但是运动负荷对可溶性Klotho的提高似乎没有剂量依赖性,三种负荷下各组大鼠血清可溶性Klotho浓度相差不大。然而,我们并不知道更长时间的运动干预后,不同负荷运动对血清可溶性Klotho变化幅度是否有影响。
3.6 运动类型
运动类型可能对血清可溶性Klotho的浓度有一定的影响。一项研究[53]观察了有氧运动和无氧运动对血清可溶性Klotho浓度的影响,这项研究的对象是15名国家级短跑运动员(平均24.2岁)和15名优秀耐力运动员(平均24.7岁)。75%最大摄氧量跑台运动后,有氧运动员(645 pg/ml)血清可溶性Klotho显著高于无氧运动员(427 pg/ml)。因此,该研究认为有氧运动可刺激可溶性Klotho水平升高,而无氧运动可能没有升高血清可溶性Klotho的效果,因而推荐人们进行有氧运动。然而,这项研究存在两个问题,首先两组实验对象都是运动员,与非运动员相比,这两种运动员急性运动后血清可溶性Klotho的变化处于什么水平?其次,两组实验对象都是在进行有氧运动后检测的血清可溶性Klotho浓度,若是都进行无氧运动后再检测会出现怎样的变化尚不得而知。Ji等[54]发现中强度有氧运动和间歇有氧运动都可以提高大鼠大脑和肾脏Klotho的水平,且两者对Klotho的提高效果相似,但是他们并未检测血清中可溶性Klotho的变化。Ramez等[55]发现高强度间歇运动和中强度运动都能使大鼠血清Klotho浓度升高,其中高强度间歇运动后大鼠血清Klotho水平也显著高于中强度运动组,表明高强度间歇运动可能对Klotho的影响更大。
目前没有文献报道力量训练是否会影响血清可溶性Klotho的浓度,也没有研究对比耐力运动与力量训练对血清可溶性Klotho的影响效果。未来需进行这方面的研究。
4 总结与展望
运动和Klotho给人类带来许多相似的益处,而多项研究表明运动可上调血清可溶性Klotho的水平,并且可改善年龄相关的症状和一些疾病。因此,Klotho可能是运动给人类带来益处的关键性执行因子。但是,目前没有直接的证据表明运动后血清可溶性Klotho的升高与一些疾病的改善直接相关,只是分析了两者的相关性。因此,今后应加强这方面的研究,印证两者是否直接相关。此外,目前关于运动和血清可溶性Klotho之间关系的研究仍然不够系统和严谨,许多问题仍未解决,如它的来源,骨骼肌是最大的运动器官,而骨骼肌中也表达Klotho,运动是否会导致骨骼肌表达的m-Klotho被剪切形成脱落型Klotho,随后进入血液,从而升高血清可溶性Klotho水平?除了肾脏外,骨骼肌是不是血清可溶性Klotho来源之一?还有运动类型、运动强度、一次运动持续时间、长期或短期训练等因素对血清可溶性Klotho的影响都有待进一步研究。此外,运动后Klotho是通过哪些途径发挥其生物学作用的,涉及到的分子信号通路有哪些?作用的靶器官有哪些?在不同靶器官中Klotho的作用是否相同?
随着老龄化的加剧,健康寿命无疑更应受到关注,运动能使生命更健康,但其机制还不明确。Klotho可能在运动促进健康寿命过程中发挥重要作用。揭示运动对Klotho的调控作用,阐明运动后血清可溶性Klotho的变化规律及机制,将进一步丰富运动促进健康寿命的理论依据。

