大鼠浆液性卵巢肿瘤的扩散峰度成像特点及病理对照研究
蔡宋琪 李 瀛 李勇爱 李 新 王 丽 强金伟
浆液性卵巢肿瘤是最常见的上皮源性肿瘤,可根据生物学行为分为良性、交界性及恶性[1]。其中,浆液性交界性卵巢肿瘤(serous borderline ovarian tumor,SBOT)生长方式特殊,多发生于年轻女性,可行保留生育能力的腔镜手术[2]。因此,术前正确诊断有助于临床决策。
目 前, 扩 散 峰 度 成 像(diffusion kurtosis imaging,DKI)在大脑胶质瘤、乳腺癌及前列腺癌诊断及分级的应用研究表明,其较常规扩散加权成像(diffusion weighted imaging,DWI)在诊断上更具优越性[3-5]。但DKI 在卵巢肿瘤中的应用价值鲜有报道[6]。本研究将探究DKI 在鉴别良性、交界性及恶性浆液性卵巢肿瘤中的诊断价值,并与Ki-67 增殖指数进行对照,为临床应用奠定基础。
方 法
1.动物模型制作
本实验严格遵守国家科学技术管理委员会关于实验动物饲养和使用条例。所有过程均受当地动物伦理委员会监督。实验过程尽量减少对动物的 伤 害。200±20g 雌 性SD(Sprague-Dawley)大鼠80 只(上海杰思捷实验动物有限公司,SCXK[沪]2012-0006)用10%水合氯醛0.33ml/100g腹腔给药麻醉至深度麻醉状态,手术暴露一侧卵巢,将含2mg DMBA 布片包裹于卵巢表面后用周围脂肪固定覆盖[7]。
2.MRI 检查方法
术后第110 天,大鼠经腹腔麻醉后行MRI 扫描。采用3.0 T 超导型磁共振扫描仪(Verio,Siemens Healthcare,Erlangen,Germany),8 通道相控阵大鼠线圈(CG-MUC29-H300-AS,辰光医疗科技股份有限公司,上海)。常规MRI 扫描序列包括:矢状位、冠状位及横断位T2 加权图像(T2-weighted imaging,T2WI),T1 加权(T1-weighted imaging,T1WI)抑脂增强扫描。DWI和DKI 扫描序列:采用单次激发EPI(Echo planar imaging)序列横断面扫描,扫描参数如下:TR/TE,3300ms/71ms;b 值0,1000s/mm2和0、700、1400、2100s/mm2;层厚2mm,层距1.2 mm;矩阵148×148;FOV120mm×64.9mm;激励次数4;扫描时间分别为1min 和5min;SPAIR 方法脂肪抑制。
3.图像分析
ADC 图使用系统自带的后处理软件(Syngo;Siemens Healthcare,Erlangen Germany)自动生成。K 图及D 图用西门子公司开发软件(MATLAB;Mathworks,Natick,Mass),DKI 的非线性计算方 程 为:S=S0·exp (2b·D+1/6·b2·D2·K)。S 是特定b 值下的扩散信号值,S0 表示未经扩散加权的基础信号值,K 为K 值的数值,代表峰度偏离正态分布的程度,无单位,K=0 是标准高斯分布,K 值越大越偏离高斯分布;D 是扩散率,是非高斯偏倚校正后的ADC 值[8]。感兴趣区的平均大小为18.2±2.1mm2(3 ~83mm2)。
4.组织病理学特征及免疫组化
卵巢肿瘤类型及分化程度诊断诊断依据H&E 染色病理学特征,分为浆液性良性肿瘤(serous benign ovarian tumors,SBT)、SBOT及浆液性卵巢癌(serous ovarian cancer,SOC)三组。Ki-67 以细胞核出现棕黄色颗粒为阳性,计算100 个细胞中Ki-67 的阳性细胞数,作为Ki-67 增殖指数。
5.统计分析
采用IBM SPSS Statistics 20.0(SPSS Inc.,Chicago,IL,USA) 及Medcalc 15.8(MedCalc Software,Ostend,Belgium)软件包进行统计分析。单因素方差分析及独立t 检验比较SBT、SBOT及SOC 的ADC 值、K 值及D 值差异。对于有意义的参数绘制受试者工作曲线(receiver operating characteristic,ROC)。McNemar 检验不同参数的敏感性和特异性差异。参数与肿瘤分化程度和Ki67增殖指数之间的关系用Spearman 相关性检验。统计显著性设定为P<0.05。
结 果
1.大鼠卵巢肿瘤成瘤情况
80 只大鼠中共67 只大鼠成瘤,获取67 个肿块,所有肿瘤均为浆液性。根据组织病理学结果被分为三组: SBT(23 个),SBOT(22 个)及SOC(22个)。其中2 个SBOT 及2 个SOC 因为图像扭曲被剔除。
2.各参数对浆液性肿瘤的诊断价值及诊断效能比较
SOC 的K 值 较SBOT 明 显 增 高(0.78±0.12和0.63±0.10,P< 0.000),SOC 的D 值 与ADC值较SBOT 明显减低(1.67±0.08)×10-3mm2/s 和(1.98±0.06)×10-3mm2/s,(1.10±0.05)×10-3mm2/s 和(1.24±0.03)×10-3mm2/s,P<0.05(表1,图1 ~2)。SBT 与SBOT 之间K 值和D 值无明显统计学差异。
ADC 值、K 值及D 值的ROC 曲线下面积分别为0.704、0.827 和0.770,三者之间无明显统计学差异(P>0.05)(表2)。K 值鉴别诊断SBOT 与SOC 的特异性高于ADC 值(90%[18/20]与 60%[12/20],P=0.031),敏感性与ADC 值相似(60%[12/20]与80%[16/20],P=0.117)。D 值 与ADC 值 比 较, 两者的敏感性与特异性无明显统计学差异(75%[15/20]与80%[16/20],P=0.246;80%[16/20]与60%[12/20],P=0.109)。
3.各参数与肿瘤分化程度及Ki-67 增殖指数相关性
K 值与Ki-67 增殖指数呈中度正相关(r=0.63,[95%CI:0.71,0.42])。D 值 与Ki-67 增殖指数亦呈中度负相关(r=-0.63,[95%CI:0.71,0.42])。ADC 值与Ki-67 增殖指数呈中度负相关(r=-0.57,[95%CI:0.67,0.18])(图3)。
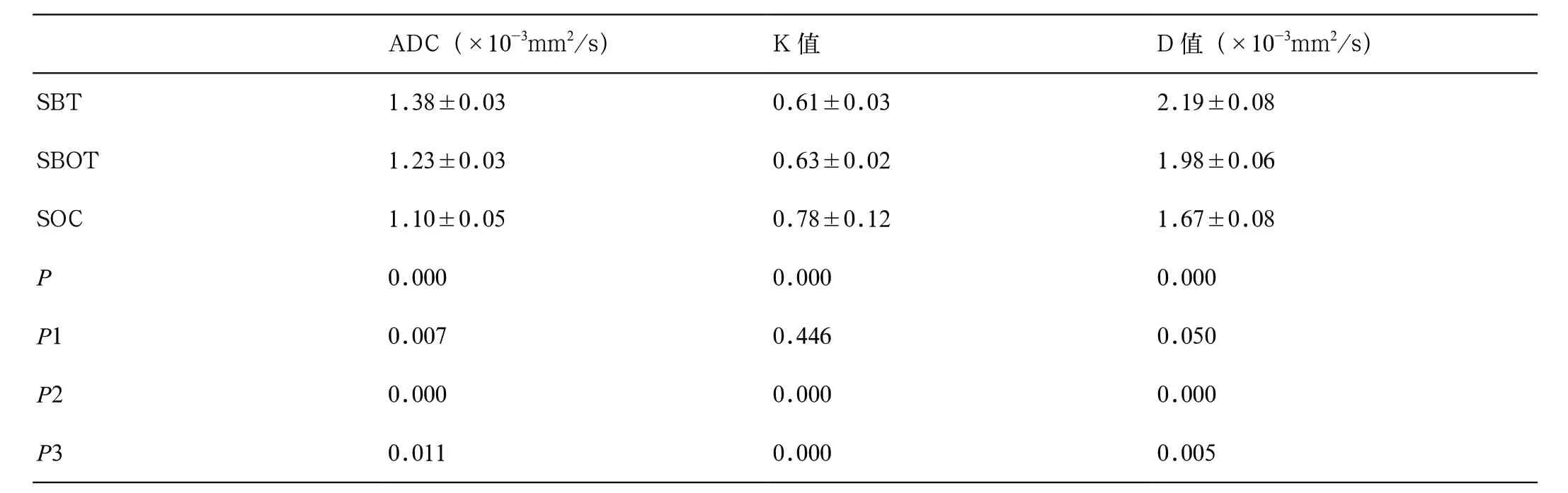
表1 ADC 值,K 值和D 值鉴别浆液性良性肿瘤,交界性肿瘤和卵巢癌

表2 ADC, K 值和D 值鉴别浆液性交界性肿瘤和卵巢癌的诊断效能比较

图1 浆液性交界性卵巢肿瘤。右侧附件区见一囊实性肿块(黑箭),T2WI(A)及横断位增强(B)可见囊内分隔。实性组织呈ADC 图:D 图低信号(C、D),K 图稍高信号(E)。镜下(F,H&E×400)为向腔内生长的珊瑚状结构伴不典型核异性,不伴间质浸润。

图2 浆液性卵巢腺癌。左侧附件区见一实性为主肿块(黑箭)(A),增强后可见实性区域明显强化(B)。实性组织呈ADC 图:D 图低信号(C、D),K 图高信号(E)。镜下(F,H&E×400)见显著的核异性及间质浸润。

图3 Ki-67 表达与DWI 和DKI 参数的相关性。浆液性良性肿瘤上皮的增殖指数为10%(A), 浆液性交界性卵巢肿瘤的增殖指数为30%(B),浆液性腺癌的增殖指数为40%(C)。Ki-67 增殖指数与ADC 值和D 值呈负相关(D、E),与K 值呈正相关(F)。
讨 论
通过DMBA 诱导的卵巢浆液性肿瘤模型与人卵巢肿瘤的基因表型相似,载瘤体具有完全的免疫能力,与人体内环境相仿,是研究浆液性卵巢肿瘤的良好模型[9]。Ki-67 是反映肿瘤细胞增殖情况的指标。研究表明,Ki-67 增殖指数与浆液性卵巢癌的侵袭性及预后相关[10]。我们的研究显示K 值、D 值均与细胞增殖指数相关,该结论与乳腺癌及人交界性肿瘤的研究结论相似[6,11]。说明DKI 的参数能一定程度反映浆液性肿瘤的侵袭性。
本研究首次将DKI 应用于浆液性卵巢肿瘤的分级诊断中,研究结果显示DKI 在鉴别诊断SBOT 与SOC 中具有一定价值,但无法鉴别SBT 与SBOT。对比DWI,K 值、D 值与ADC 值的诊断效能虽无明显统计学差异,但呈递减趋势(0.827,0.770和0.704)。我们课题组前期的研究显示ADC 值鉴别人交界性肿瘤及卵巢癌的敏感性和特异性分别为97%和92%,并与细胞密度相关[12]。理论上,随着恶性程度的增高,肿瘤细胞的密度增大、细胞外间隙变小,加之微血管生成增加及核质比的改变,肿瘤微环境异质性增强[13]。较DWI 所基于的线性模型,DKI 所基于的非高斯分布模型,更符合肿瘤组织内的水分子扩散运动情况,能够反映瘤体内的微结构复杂性[7]。
其中,K值是衡量偏离高斯分布程度的重要参数,既往肺结节及前列腺癌等的研究表明K 值联合ADC值能降低诊断误诊率[4,14]。本研究结果显示K 值鉴别SBOT 与SOC 的特异性明显高于ADC 值,这与DKI在乳腺肿瘤的研究结论相似[5]。但是,这种特征并未在人交界性卵巢肿瘤与卵巢癌的研究中体现出来[6]。究其原因,可能与人卵巢肿瘤研究中纳入了不同病理亚型的上皮源性肿瘤有关。不同亚型的肿瘤生物学特征有所不同,如内膜样交界性肿瘤中往往含有出血成分,易影响磁场均匀性,从而影响对DKI 诊断价值的客观判断。
总而言之,本研究结果显示DKI 有助于提高SBOT 与SOC 的鉴别诊断特异性,有望成为评估浆液性卵巢肿瘤侵袭性的无创性生物学标志物。但其特异性的诊断界值及与患者的实验室指标、临床分期的相关性仍需进一步研究。

