雷帕霉素-mTOR途径诱导自噬对抑制软骨细胞凋亡的影响
王芳芳,李鸿斌
骨关节炎(osteoarthritis, OA)是与软骨细胞凋亡相关的退行性疾病。至今尚无终止或逆转该病的药物。软骨细胞的凋亡及自噬作用在OA病理机制中受到重视[1]。OA软骨细胞凋亡机制及自噬对凋亡的影响机制,有可能成为治疗和预防OA的有效方法。自噬是一种依赖溶酶体降解不必要的和功能失调的自身成分应对损伤的适应性反应。自噬和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号对细胞生长的影响相互拮抗。mTOR受生长因子、能量水平及其他信号的影响。本研究探讨雷帕霉素(rapamycin, RAPA)-mTOR途径诱导自噬抑制软骨细胞凋亡的机制。
1 对象与方法
1.1 对象
收集2018年10月至2019年1月在内蒙古医科大学附属医院骨科手术室实施全膝关节置换术的膝骨关节炎患者的OA软骨标本7例,OA符合1995年ACR修订的诊断标准[2],同时收集同期在同一医院实施髋关节置换术的股骨颈骨折患者的正常软骨标本5例。排除标准:(1)近期有膝关节感染史;(2)梅毒、乙肝等阳性;(3)继发性OA;(4)6个月内使用过干扰骨代谢的药物,包括鲑鱼降钙素、双磷酸盐、特立帕肽、德尼单抗、雷洛昔芬和糖皮质激素者。所有患者均签署知情同意书。
1.2 方法
应用二步酶消化法,从关节软骨中分离软骨细胞,并经甲苯胺蓝及Ⅱ型胶原免疫组织化学染色鉴定,体外传代培养。应用地塞米松(dexamethasone, DEX)诱导软骨细胞凋亡,然后用RAPA干预。依据软骨细胞传代培养的处理方案,将正常软骨细胞和OA软骨细胞分别分为3组:(1)BSA组(未处理,BSA浓度为100 μg/ml,培养12 h);(2)DEX-BSA组(DEX剂量1×10-6mol/L,BSA浓度为100 μg/ml,培养12 h);(3)RAPA+DEX-BSA组(RAPA至终浓度为1 mmol/L培养2 h,再加DEX-BSA至终浓度为100 μg/ml培养12 h)。噻唑蓝(MTT)法检测软骨细胞活性;GFP-RFP-LC3腺病毒、Western blot和实时荧光定量PCR(qRT-PCR)法检测自噬流水平和自噬相关蛋白LC3、Beclin1和ULK1蛋白及基因表达。qRT-PCR和ELISA法检测IL-1、TNF-α浓度。Annexin V-FITC/PI法及TUNEL法检测凋亡。
1.3 统计学方法
SPSS 17.0软件分析,计量资料用均数±标准差表示,2组间计量资料比较用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共收集OA软骨标本7例,男3例,女4例,平均年龄为(67.7±5.8)岁;正常软骨标本5例,男3例,女2例,平均年龄为(67.6±8.0)岁。
2.2 MTT法检测细胞活性
与BSA组正常和OA软骨细胞活性(分别为100%±1.48%和98.25%±7.83%)比较,DEX-BSA组细胞活性(66.63%±2.17%和62.19%±1.92%)显著下降(P<0.001);与DEX-BSA组比,RAPA+DEX-BSA组细胞活性(88.94%±3.87%和85.42%±4.33%)显著升高(P<0.001)。
2.3 LC3自噬双标腺病毒检测自噬水平
mRFP-GFP-LC3腺病毒检测自噬流情况(图1)。各组自噬体荧光分光光度分析,OA软骨细胞DEX-BSA组(0.017±0.002 4)比BSA组(0.033±0.004 9)显著减少(P<0.01),RAPA+DEX-BSA比DEX-BSA组正常(0.038±0.005 3vs. 0.025±0.003 3)和OA软骨细胞(0.048±0.004 9vs. 0.017±0.002 4)显著增加(P<0.05)。
2.4 Western blot测定LC3B、ULK1、Beclin1表达
以GAPDH作为内参计算总LC3B的相对光密度=(LC3B-Ⅱ光密度+LC3B-I光密度)/GAPDH光密度。无论正常和OA软骨细胞,与DEX-BSA组比较,RAPA+DEX-BSA组总LC3B、LC3B-Ⅱ、Beclin1和ULK1表达显著增加(P<0.01);与BSA组比,DEX-BSA组ULK1、Beclin1和总LC3B、LC3B-Ⅱ显著下降(P<0.01)(表1)。
2.5 qRT-PCR测定LC3、ULK1、Beclin1、TNF-α和IL-1基因表达,ELISA法测定IL-1、TNF-α蛋白浓度
以GAPDH mRNA为内参,无论正常和OA软骨细胞,与BSA组比较,DEX-BSA组Beclin1、LC3和ULK1显著下降(P<0.001),TNF-α和IL-1显著增加(P<0.01);与DEX-BSA组比较,RAPA+DEX-BSA组LC3显著增加(P<0.01),TNF-α和IL-1显著下降(P<0.01)。RAPA+DEX-BSA组与DEX-BSA组比,Beclin1(P=0.147)和ULK1(P=0.157)正常软骨细胞无差异,OA软骨细胞显著增加(P<0.001)(表2)。IL-1、TNF-α蛋白浓度与基因表达相同,无论正常和OA软骨细胞,与BSA组比较,DEX-BSA组显著增高(P<0.001);与DEX-BSA组比较,RAPA+DEX-BSA组显著下降(P<0.01)(表3)。

图 1mRFP-GFP-LC3腺病毒检测自噬流情况
Fig1mRFP-GFP-LC3 adenovirus detected autophagic flow
2.6 自噬对软骨细胞凋亡的影响
TUNEL法检测软骨细胞凋亡小体(图2),进行荧光分光光度分析。DEX-BSA组与BSA组相比,正常软骨细胞(分别为0.037±0.003 7和0.032±0.006 8)升高不显著(P=0.33),OA软骨细胞(分别为0.055±0.006 8和0.038±0.000 7)显著升高(P<0.05)。RAPA+DEX-BSA组与DEX-BSA组比,正常软骨细胞(0.046±0.000 7)升高(P<0.05),OA软骨细胞(0.062±0.003 0)无差异(P=0.16)。Annexin V-FITC/PI法进一步明确自噬对凋亡的影响,无论正常和OA软骨细胞,与BSA组(1.34%±0.20%和21.09%±0.73%)比较,DEX-BSA组(26.02%±0.86%和34.96%±0.68%)凋亡显著增加(P<0.001)。与DEX-BSA组比,RAPA+DEX-BSA组(21.02%±0.76%和27.48%±0.81%)凋亡显著降低(P<0.01)(图 3)。

表1 各组细胞自噬相关基因的蛋白表达比较Table 1 Comparison of protein expression of autophagy related n=3)

表2 各组细胞自噬相关基因及炎性因子基因表达比较Table 2 Comparison of the expression of autophagy-related genes and inflammatory factor n=3)

表3 各组细胞炎性因子蛋白浓度比较 Table 3 Comparison of inflammatory factor protein concentration cells n=3, pg/ml)
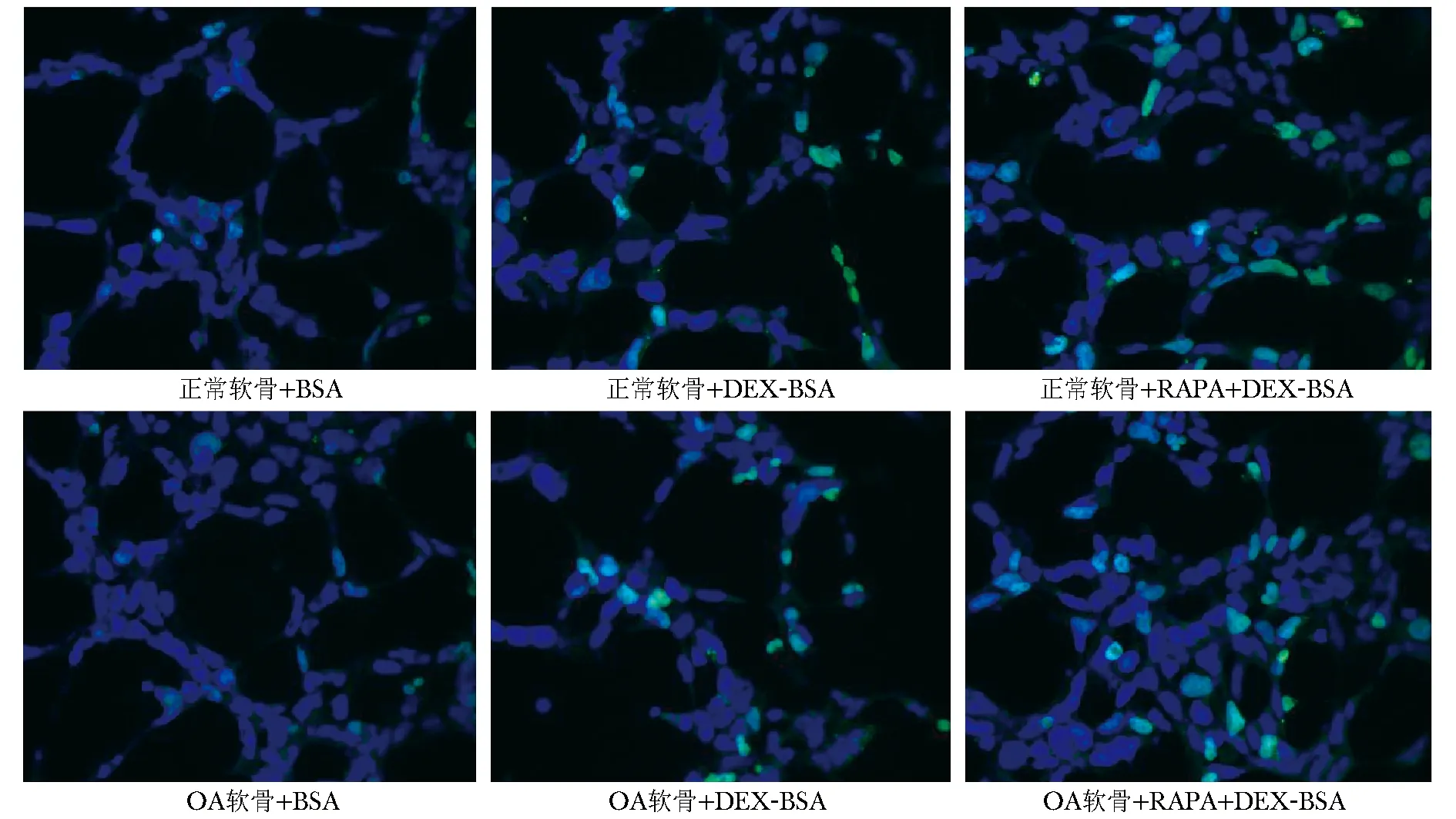
图 2TUNEL法检测各组细胞凋亡
Fig2TUNEL detected chondrocyte apoptosis
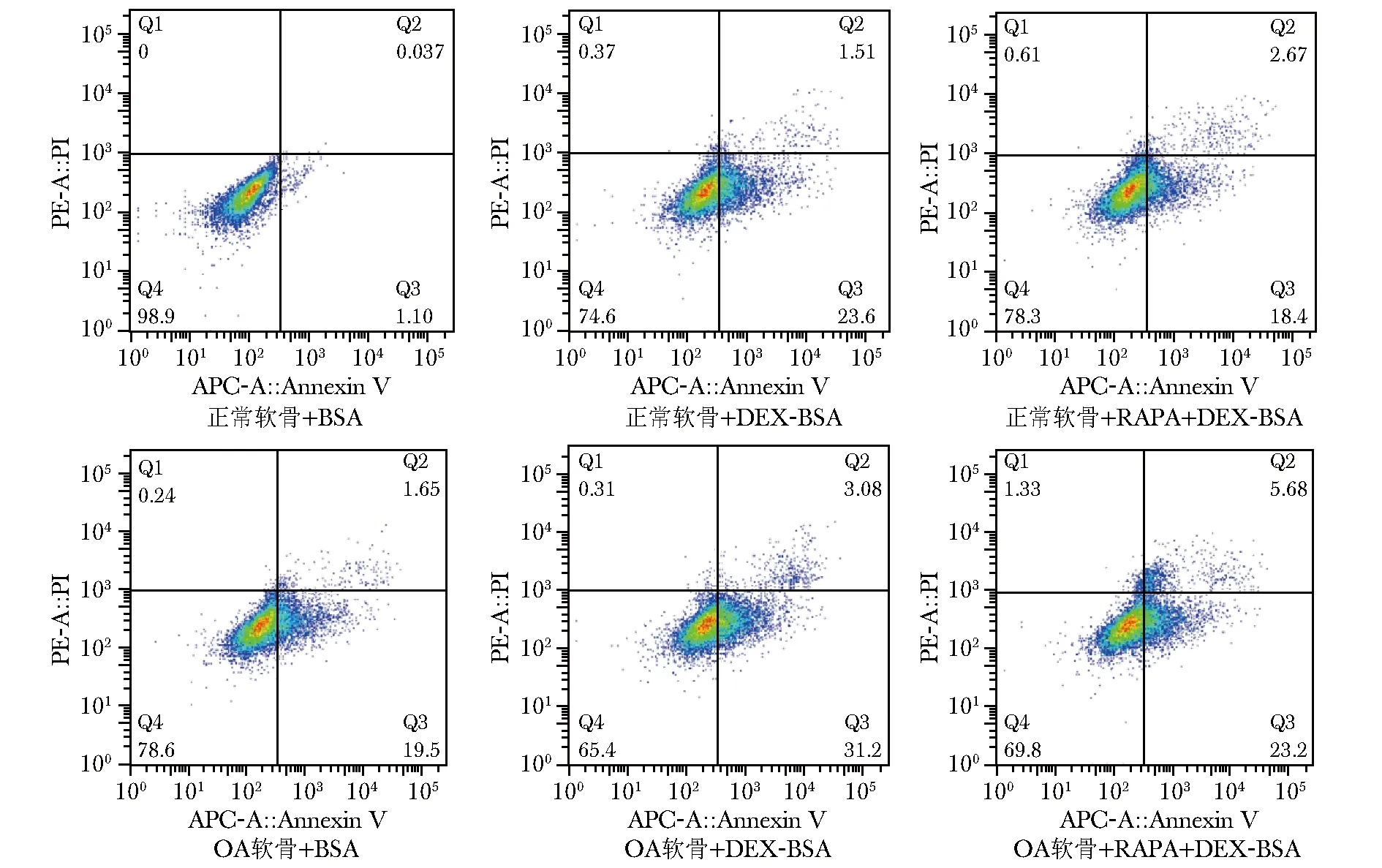
图 3Annexin V-FITC/PI法检测各组细胞凋亡
Fig3Detection of apoptosis of chondrocytes by Annexin V-FITC/PI
3 讨论
有研究证实DEX促进软骨细胞线粒体凋亡及软骨基质分解,引起细胞凋亡[3]。MTT法显示无论正常或OA软骨细胞,DEX处理后的存活率显著下降(P<0.001)。为确定DEX对软骨细胞的损伤作用,用Annexin V-FITC/PI法检测凋亡,无论正常或OA软骨细胞,与BSA组比较,DEX-BSA组凋亡显著增加(P<0.01)。此外,TUNEL法检测显示,在OA软骨细胞DEX处理后凋亡显著升高(P<0.05),表明DEX对软骨细胞活性有影响。
对正常和OA软骨细胞,DEX处理后ULK1、Beclin1、总LC3B和LC3B-Ⅱ蛋白表达显著下降(P<0.01);DEX处理后Beclin1、ULK1和LC3基因表达亦显著下降(P<0.001)。mRFP-GFP-LC3腺病毒标记自噬体荧光分光光度分析显示,OA软骨细胞DEX-BSA组比BSA组显著降低(P<0.01),表明DEX对软骨细胞自噬有下调的影响。
研究发现软骨细胞凋亡中炎症因子起着重要作用[4]。抑制mTOR可以降低IL-1β的表达[5]。由软骨细胞和滑膜细胞合成的IL-1β和TNF-α破坏软骨损伤和修复过程的平衡[6],是诱导和保持软骨损伤状态的关键驱动因子。并且TNF-α能够刺激蛋白多糖再吸收并抑制其合成[7]。IL-1β、TNF-α诱导产生前列腺素和NO[8],NO干扰软骨细胞功能致基质金属蛋白酶活化,诱导细胞凋亡或抑制蛋白多糖和Ⅱ型胶原合成,进一步导致软骨基质减少[9]。qRT-PCR和ELISA法检测结果显示无论正常或OA软骨细胞,DEX处理后IL-1β和TNF-α水平显著升高(P<0.01);预先2h加入RAPA处理正常和OA软骨细胞,与DEX-BSA组比较,TNF-α和IL-1水平均显著下降(P<0.05),表明自噬对DEX引起的TNF-α和IL-1有影响。
RAPA抑制mTOR途径而激活自噬[10]。本实验Western blot和qRT-PCR检测LC3B、ULK1、Beclin1蛋白和基因表达结果表明,OA软骨细胞中LC3B、ULK1、Beclin1的蛋白及基因表达均在RAPA干预后显著升高。结果一致,无论正常或OA软骨细胞,mRFP-GFP-LC3自噬双标腺病毒标记自噬体荧光分光光度分析显示在RAPA干预后显著增高,表明预先2 h加入RAPA有上调软骨细胞自噬的作用。
自噬能清除细胞内功能障碍的细胞器,维持细胞稳态而提高细胞的存活力[11]。细胞器的损伤在凋亡启动中发挥重要作用,及时地消除受损细胞器能够延缓甚至使凋亡停止。有研究显示软骨细胞凋亡在软骨退行性变过程中起关键作用[12]。因此,阻断软骨细胞凋亡可能减轻或避免细胞损伤,从而延缓或阻止OA发生。MTT法显示,无论正常或OA软骨细胞,RAPA处理后活性显著升高(P<0.001)。Annexin V-FITC/PI法显示,RAPA+DEX-BSA组比DEX-BSA组凋亡显著降低(P<0.01),表明预先2 h加入RAPA能够降低软骨细胞的凋亡。
综上所述,本研究通过RAPA诱导软骨细胞自噬、抑制凋亡、减少TNF-α和IL-1的表达而促进细胞存活,为调节自噬预防和治疗骨关节炎提供了研究基础。

