PMS2、C-met及MSH6联合检测在结肠息肉与结肠癌中的意义
杜锦波,刘明发,李梅岭,刘杰,朱春景
(沧州市人民医院,1.胃肠(微创)外科;2.内分泌科,河北 沧州 061000)
近些年,伴随人们的生活条件及习惯的改变,结直肠癌发病率逐年升高,已成为男性第3位、女性第2位的高发肿瘤,且发病人群逐渐年轻化[1-2]。结肠位于腹腔,有着较为丰富的淋巴系统,血液系统和比邻器官(肝脏、胰腺、胃、脾脏、输尿管、膀胱等)。这些特点导致结肠癌的恶性程度比较高,容易局部侵犯,使得结肠癌的规范的外科治疗成为难点。结肠息肉是一种常见的结肠疾病,息肉来源于粘膜上皮。随着结肠镜在各大医院的广泛应用,结肠息肉受到更多的重视,特别是绒毛状腺瘤,家族性息肉病被更多的学者认为更易发生癌变[3]。随访研究结果显示,结肠息肉的整体恶变率为10%,一般需要10年左右时间,尤其是腺瘤性息肉,腺瘤愈大,绒毛越多,癌变率愈高。目前,关于大肠息肉发生癌变的具体机制尚不清楚。本研究选取结肠管状腺瘤、绒毛状腺瘤、家族性息肉病、结肠癌标本分别检测PMS2、C-met、MSH6的表达,以探索其在结肠息肉癌变中所起的作用。
1 资料与方法
1.1 一般资料
收集沧州市人民医院胃肠微创外科2010年1月至2012年8月住院病例病理标本。其中,结肠管状腺瘤42例,绒毛状腺瘤41例,家族性息肉病40例,结肠癌42例。标本均使用10%甲醛溶液固定,石蜡包埋并且制成切片备用。
试剂与仪器 :兔抗人MSH6 PMS2 C-met的抗体购于武汉博士德公司。SP免疫组化二步法检测试剂盒、抗原修复液,DAB显色液、PBS缓冲液均购自北京迈新生物技术有限公司。免疫组化主要仪器有显微镜、切片机,组织脱水机、孵育盒等。
1.2 方法
本研究所需切片均脱蜡水化;3%H2O2室温孵育10 min; 蒸馏水2次冲洗,PBS浸泡6 min;再行抗原修复;10% 正常山羊血清(PBS稀释)封闭,室温孵育10 min。倾去血清,分别滴加(1∶100) 的PMS2、C-met、MSH6的单克隆抗体、4 ℃过夜;PBS冲洗3次,每次5 min;生物素标记二抗工作液37 ℃孵育30 min;PBS冲洗3次,每次5 min; 滴加2滴辣根酶标记链霉卵白素37 ℃ 孵育30 min;PBS 冲洗3次,DAB显色剂显色;自来水充分冲洗,封片。每例染2张。在光学显微镜5个高倍视野下观察,分析。进行视野内阳性细胞计数,并计算阳性细胞所占比例。肿瘤细胞无着色为(-);<25%的细胞着色(+);25%~50%的细胞着色为(++);>50%的细胞着色为(+++)。
1.3 统计学分析
采用SAS9.2统计软件对数据进行分析处理,计数资料以百分率(%)表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PMS2在结肠管状腺瘤、绒毛状腺瘤、家族性息肉病、结肠癌中的表达
PMS2主要表达于细胞核,且在结肠癌中的表达明显低于家族性息肉病(P<0.05),在家族性息肉病中的表达明显低于结肠管状腺瘤、绒毛状腺瘤(P<0.05)。见图1和表 1。

表1 PMS2在结肠管状腺瘤、绒毛状腺瘤、家族性息肉病、结肠癌中的表达

项目阴性阳性表达率(%)结肠管状腺瘤(n=42)33992.6绒毛状腺瘤(n=41)53687.8家族性息肉病(n=40)122870.0#结肠癌(n=42)231945.2∗
*P<0.05,与家族性息肉病相比;#P<0.05,与结肠管状腺瘤、绒毛状腺瘤相比。
2.2 C-met在结肠管状腺瘤、绒毛状腺瘤、家族性息肉病、结肠癌中的表达
C-met的表达以细胞浆为主,呈棕黄色或棕褐色为阳性染色。且在结肠癌中的表达明显高于家族性息肉病(P<0.05),在家族性息肉病中的表达明显高于结肠管状腺瘤、绒毛状腺瘤(P<0.05)。见图2和表 2。

表2 C-met在结肠管状腺瘤、绒毛状腺瘤、家族性息肉病、结肠癌中的表达

项目阴性阳性表达率(%)结肠管状腺瘤(n=42)311126.2绒毛状腺瘤(n=41)281331.7家族性息肉病(n=40)221845.0#结肠癌(n=42)123071.4∗
*P<0.05,与家族性息肉病相比;#P<0.05,与结肠管状腺瘤、绒毛状腺瘤相比。
2.3 MSH6在结肠管状腺瘤,绒毛状腺瘤,家族性息肉病,结肠癌中的表达
MSH6主要表达于细胞核,部分在胞质中表达,且染色呈棕黄色。且在结肠癌中的表达明显低于家族性息肉病(P<0.05),在家族性息肉病中的表达明显低于结肠管状腺瘤、绒毛状腺瘤。差异有统计学意义(P<0.05)。见图3和表 3。

表3 MSH6在结肠管状腺瘤、绒毛状腺瘤、家族性息肉病、结肠癌中的表达
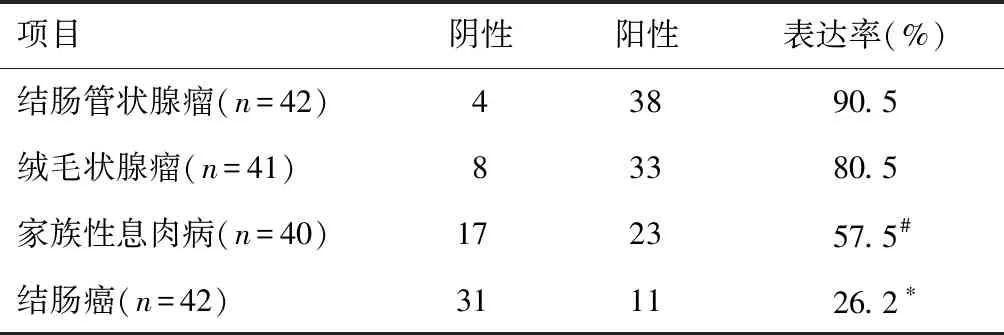
项目阴性阳性表达率(%)结肠管状腺瘤(n=42)43890.5绒毛状腺瘤(n=41)83380.5家族性息肉病(n=40)172357.5#结肠癌(n=42)311126.2∗
*P<0.05,与家族性息肉病相比;#P<0.05,与结肠管状腺瘤、绒毛状腺瘤相比。
2.4 MSH6表达与PMS2、C-met的相关性
MSH6的表达与C-met表达呈负相关性,与PMS2的表达呈正相关性,且均有统计学意义(P<0.05)。见表4。

表4 MSH6表达与PMS2、C-met的相关性
3 讨论
在实际临床工作中以结肠镜来发现结肠息肉,当结肠息肉发展为恶性肿瘤时又以结肠癌的TNM分期,有无脉管癌栓,有无神经侵犯等因素来预测结肠癌患者的预后。但是经常遇到相同TNM分期的结肠癌患者,预后却不完全相同[4]。有些TNM分期较早的患者却很早的出现了远处转移,导致预后很差。结肠均位于腹腔,按照解剖学可分为升结肠,横结肠,降结肠,乙状结肠。按照血管供应则分为右半结肠,左半结肠。结肠的主要功能为吸收水分,形成和传输大便。结肠的血液供应主要来自于腹主动脉的分支肠系膜上动脉及肠系膜下动脉。结肠的淋巴系统非常丰富,非常容易淋巴转移,并且有重要的大血管,使得结肠癌的淋巴清扫成为难点。结肠周围有着较多重要的毗邻器官(肝脏、胃、胰腺、小肠、脾脏、输尿管等),使得结肠癌容易造成局部侵犯导致手术无法完整切除。以上这些结肠癌的临床特点使得结肠癌的外科手术治疗成为难点。近些年结肠镜的大量应用使得结肠癌能够早期发现,其预后也有所改善。结肠癌很多是由结肠息肉发生,发展演变而来。结肠息肉直径越大,个数越多,分布越密集,绒毛越多,越容易发生癌变。家族性息肉病几乎都会发展为结肠癌,故家族性息肉病也成为了外科手术的适应症。然而哪些息肉容易恶变,哪些息肉是外科手术的适应症,尚无明确共识,所以有必要对结肠息肉和结肠癌的关系,相互发生发展的机制进行深入的研究,以便尽可能提供结肠癌的更全面的预防、筛查等的理论实验依据,有助于结肠癌患者的二级预防。错配修复系统(Mismatch Repair,MMR) 是正常人体重要的修复方式,这一系统广泛的存在于自然界的所有生物体内,是人类不可缺少的重要修复方式。在正常的人体内,所有组织及细胞每时每刻都在有条不紊的进行着基因的重组和复制,在这一持续的过程中不可避免地会出现碱基的错配及基因重组的错配。这一错配的发生使得正常人体无法进行有序的新陈代谢。MMR的作用就在于及时检测发现并且能够纠正使已经发生错配的基因序列能够恢复到正常的碱基配对。这一作用能够有效维持正常人体内遗传物质传递的稳定性和准确性。MMR这一修复系统几乎存在于自然界的所有正常生物体内,其主要的作用是对人体核苷酸复制、重组过程中不可避免产生的错误进行有效监测并及时修复。MMR修复系统的作用不仅可以有效检测遗传物质的复制是否正确而且还可以及时的纠正遗传物质在重组和复制过程中不可避免产生的错误。这一作用能够有效地保持了遗传物质复制重组过程中的正确性以及核苷酸序列的稳定性。在正常的人体内MMR这一修复系统具有重要的作用,然而这一修复系统一旦发生自身的突变,将会直接影响基因的监测,以及对已经发生的错误进行修正。这一修复系统的失效便会直接导致正常人体内的DNA产生微卫星不稳定(microsatellite instability MSI)以及正常人体内的遗传物质在复制和重组过程中出现错误。 MSI的作用结果还表现为正常人体内致癌基因的过度激活与抑癌基因抑制,这一作用使得正常人体内致癌基因与抑癌基因这一互相平衡制约的基因被打破。这样在我们正常人体细胞中的基因物质的突变频率便会有所增加,这一作用的结果将直接导致人体正常的细胞发展为恶性肿瘤的可能性有所增加[5-6]。MMR修复系统的失效将可能成为正常人体细胞突变为恶性肿瘤的机制之一。
恶性肿瘤的发生,发展是由机体自身及外界多种因素共同作用的结果,结直肠癌的发生,发展同样也是自身DNA受损后由于修复机制出现异常,最终引起DNA突变而导致癌变[7]。机体在正常情况下存在一套完整的DNA修复系统,包括错配修复、重组修复、直接修复、SOS 修复、切除修复[8-9],这些修复系统可以保证DNA复制的准确进行。碱基配对错误作用于非重复 DNA,从而引起配对错误;碱基插入会使DNA的序列出现紊乱,从而引起微卫星的缺失或插入,进一步导致MSI[10]。MMR基因主要作用在于细胞复制后进行修复即对DNA错配碱基进行修复,从而有预防基因变异以及维持DNA复制正确的作用[5-6],如不能充分发挥MMR的作用将导致微卫星 DNA 不稳定甚至出现复制错误, 进而引起细胞增殖及分化异常, 这将成为肿瘤发生发展的基础[11]。MSH6、PMS2基因属于MMR,它的的突变是导致结直肠癌发病的主要原因[12]。本研究证实,结肠管状腺瘤、绒毛状腺瘤、家族性息肉病、结肠癌标本中的MSH6、PMS2的表达呈下降趋势,且在结肠癌中的表达明显低于家族性息肉,在家族性息肉病中的表达明显低于绒毛状腺瘤。
C-met(肝细胞生长因子受体)是由原癌基因编码合成,为肝细胞生长因子受体,其重要的生物学活性之一为酪氨酸激酶活性,它的重要功能为细胞之间的信息传导,并且能够控制细胞骨架的重排,这样对于细胞的增殖、分化,细胞的运动这些功能有着重要的推进作用。许多国内外大型机构研究已经表明C-met参与了机体多种恶性肿瘤的发生发展[13]。本研究表明,结肠管状腺瘤、绒毛状腺瘤、家族性息肉病、结肠癌标本中的C-met的表达呈逐渐增高趋势,且在结肠癌中的表达明显高于家族性息肉,在家族性息肉病中的表达明显高于绒毛状腺瘤。C-met的作用机制与PMS2及MSH6的作用机制恰恰相反,这三种蛋白对结肠癌发生发展的作用结果与它们对结肠癌的作用机理保持了相互一致性。C-met的表达越强往往预示结肠息肉患者更容易发生发展为结肠癌。C-met的高表达也预示结肠癌的发展迅速,预后较差。而PMS2与MSH6的低表达往往预示结肠息肉患者更容易发生发展为结肠癌。PMS2与MSH6的低表达也预示结肠癌的发展迅速,预后较差。MSH6在结肠癌中的表达与C-met的表达呈负相关;MSH6的表达与PMS2的表达呈正相关性。PMS2与MSH6均属于错配修复基因;错配修复基因编码合成的这两种蛋白质对结肠癌的发生,发展具有相似的作用机制,PMS2、MSH6的高表达往往提示结肠息肉不容易发展为结肠癌。即使发展为结肠癌,也预示结肠癌的分期较早,无脉管癌栓,淋巴结转移较少,预后较好。这两种蛋白如果表达缺失则意味着结肠息肉更容易演变为结肠癌,且发展为癌后的预后也较差。PMS2、MSH6的表达具有正相关性,在结肠癌中的作用具有一致性。这一结果与它们的作用机理一致[12],也说明它们之间的表达可能具有协同性或者相互促进作用。MSH6在结肠癌中的表达与C-met的表达呈负相关性。C-met在正常人体的器官、组织、细胞中表达低下。然而当这些正常组织发生,发展演变为恶性肿瘤组织时,由C-met基因编码而成的蛋白质水平则会明显升高,当C-met处于较高表达水平时,便可以通过旁分泌和自分泌等多种途径来激活多种信号通路,从而刺激正常的组织、细胞发生,发展,最终演变为恶性肿瘤细胞。PMS2,MSH6与C-met在结肠正常组织和细胞中的作用机制完全不一样,它们在结肠息肉与结肠癌中阳性表达意义也截然相反。本研究得出的结果与这三种蛋白的作用机制的理论保持了一致性。本研究还揭示了PMS2、MSH6与C-met这三种蛋白对结肠息肉发生发展为结肠癌的作用以及这三种蛋白相互之间的关系,对用更全面系统的指标来预测哪些结肠息肉患者更容易转变为结肠癌有着重要的指导意义。
综上所述,MSH6、PMS2、C-met可能是结直肠恶性肿瘤发生发展的基础,了解三者在结肠息肉与结肠癌中的表达可为结肠息肉的危险度评估、预防、治疗、随诊提供参考依据。

