基于三氯生医用缝合线表面抗菌涂层的制备及性能
童汇慧,张威迪,胡惠文,程 逵
(1.浙江工商大学,浙江 杭州 310027;2.浙江大学材料科学与工程学院,浙江 杭州 310027)
1 前 言
医用缝合线是外科手术中必不可少的医疗耗材,其性能的优劣对术后恢复等具有很大影响。人体术后缝合部位由于细菌残留等原因可能会产生细菌感染[1-2],而细菌感染的过程常为细菌先期附着于植入材料表面,进而形成一层“生物膜”保护细菌,之后细菌繁殖、迁移感染周围组织。在这种情况下,注射或口服抗生素药物,不仅抗菌效果有限,而且全身性的药物使用会产生一定的副作用,有可能会导致细菌的耐药性等[3]。
因此,对于医用缝合线而言,采用缝合线表面载抗菌药,将有可能使药物直接作用于细菌,提升杀菌和抑菌的效果,并通过抑制“生物膜”的形成抑制细菌感染的进一步发展,是一种直接而高效地抑制细菌染的方式[2,4-6]。
采用简单的表面吸附方式可以在手术缝合线负载一层抗菌药物,但药物大多在与体液接触初期爆发性释放,初始浓度过大、持续释放性能差。这既不利于伤口恢复,也不利于缝合线表面抗菌作用的持续[7]。Hammond教授研究组[8]利用喷涂层层组装技术,以抗生素万古霉素、生物多糖等作为构筑基元在医用绷带表面沉积了负载有万古霉素的聚合物膜。而且,表面沉积的药物膜使得医用绷带表面更光滑,万古霉素药物分子可以随着聚β胺酯的降解而释放出来,保持良好的药物活性,对引起伤口感染的病菌有着显著的抑制效果。因此,抗菌时效与缝合线作用相吻合的抗菌表面的构建对医用缝合线具有重要的意义。
近年来,贻贝等生物的粘附性引起广泛关注。研究发现,此类粘附特性主要来源于3,4-二羟基-1-苯丙氨酸和富含赖氨酸的蛋白质[9]。而与3,4-二羟基-1-苯丙氨酸结构相似的多巴胺同样可以在各种无机和聚合物表面形成聚多巴胺(PDA)薄膜[10]。一般认为,单体多巴胺在碱性溶液中(p H>7.5)被氧化而自发自聚合是其主要原因:多巴胺的邻苯二酚基团被氧化形成醌键,生成多巴胺醌化物;之后多巴胺醌化物和多巴胺之间产生歧化反应,生成半醌自由基,然后偶合形成交联键,进一步增加了它的内聚力,从而形成了紧密的交联复合层[11]。这种机制可以方便地将PDA 粘附到多种不同种类材料表面[12],且反应条件非常温和,适用条件也非常广泛。
PDA 同时具有良好的生物相容性、可降解性及细胞响应性[13],非常适用于固载抗菌物质形成具有抗菌性能的表面。Mao等[14]在棉织物表面利用PDA 的还原性沉积生成了银纳米颗粒,制造出抗菌棉织物,在大肠杆菌抗菌测试中几乎可以杀死所有细菌,并且洗涤30次后,仍能持续杀死99.9%的大肠杆菌。Sileika等[15]通过在聚碳酸酯基板沉积PDA 厚薄膜,随后嫁接聚乙二醇支链并在硝酸银溶液中反应使银纳米粒子沉积PDA 涂覆的基材上,所得到的涂层不仅具备杀菌性还能抑制细菌的附着。然而,考虑到医用缝合线需植入人体,采用纳米颗粒进行抗菌还需进一步研究。
鉴于此,本研究利用PDA 的特性,将三氯生(TCS,二氯苯氧氯酚,C12H7Cl3O2,)固载于医用缝合线表面形成了抗菌涂层,并对其固载特性和抗菌特性进行研究和讨论。
2 实 验
2.1 表面涂层制备与表征
涂层制备所需的原料试剂均为市售,TCS,纯度为97%;盐酸多巴胺,纯度为98%,无水甲醇、Tris均为分析纯,医用缝合线为聚乙醇酸(PGA)。
首先,量取150m L去离子水,加入182.1mg三羟甲基氨基甲烷(Tris)到水溶液中调节溶液p H 值至弱碱性,待Tris搅拌溶解后,按设定比例加入盐酸多巴胺,形成PDA 溶液;之后将适量TCS溶解于乙醇中,形成TCS乙醇溶液;将两种溶液混合形成混合溶液,封口并留下气孔,并不断搅拌。24h后,将医用缝合线截取适当长度后,放入前述混合溶液中,37℃烘箱静置24h。取出后用去离子水冲洗后烘干,即获得具有PDA-TCS涂层的缝合线。缝合线表面形貌采用扫描电子显微镜(SU-70,SEM)观察,并利用电子能谱仪(EDS)分析表面成分的变化。
2.2 TCS的体外释放实验
将具有PDA-TCS涂层的缝合线精确称取质量后放入20m L混合磷酸盐缓冲液(PBS)中,置于37℃烘箱中。分别在浸泡4h、8h、1d和2d后将对应的医用缝合线取出,用去离子水冲洗去除表面残余PBS缓冲液后放入烘箱中烘干。之后,通过甲醇溶液超声处理50min提取缝合线表面的残余TCS,并利用紫外-可见吸收光谱(Shimadzu UV1800,UV-Vis)测定其吸光度,按照标准曲线计算TCS含量并换算成缝合线表面浸泡后剩余的TCS 量。标准曲线采用已知浓度的TCS甲醇溶液在UV-Vis光谱中280nm 左右处的吸收峰强度进行绘制,如图1所示。
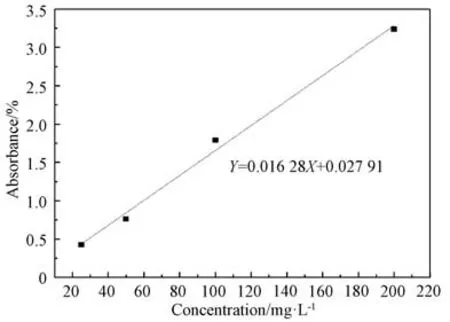
图1 TCS浓度测量标准曲线Fig.1 Standard curve of concentration determination
2.3 体外抗菌实验
采用体外抗菌实验评价表面PDA-TCS涂层的抗菌效果。先用无菌棉拭子蘸取1.5×106个/m L 菌液,用棉拭子均匀涂抹整个琼脂培养基表面,反复3次,每次将平板旋转60°,最后沿周边旋转2圈,待平面上的水分被琼脂完全吸收后,再用无菌镊子将灭菌后的缝合线放在固体培养基平板上,每个样品间距不少于24mm,样品中心距边缘不少于15mm,在细菌接种后15min内贴完。然后置于37℃保温箱中分别培养1、3和7d,观察抑菌圈的范围,以评价具有涂层的缝合线的抗菌性能。
3 结果与讨论
3.1 PDA-TCS涂层表面形貌及TCS含量
缝合线表面初始为浅蓝色,经溶液浸泡后表面转变为深棕色,如图2所示。EDS分析显示,涂层中有较高含量的Cl元素。由于缝合线本身不含Cl,能谱结果证明缝合线表面已有TCS的存在。进一步对典型形貌(5g/L的溶液浸泡)的观察显示(图3),组成缝合线的纤维表面变得较为粗糙,且在高放大倍数下,可以进一步观察到其表面形成了较多的颗粒析出。综合考虑涂层制备过程、多巴胺的自聚合过程、缝合线表面转变为棕色以及TCS不溶于水等特性,缝合线表面形成了PDA-TCS涂层。

图2 缝合线及表面化学成分Fig.2 Appearance and surface chemical composition of the suture

图3 PDA-TCS涂层的表面形貌照片Fig.3 Typical surface morphology of coated suture
图4为不同浓度的TCS 对PDA-TCS 涂层表面形貌的影响。从图可见,缝合线的表面形貌随着溶液中TCS含量的变化而产生显著变化。随着溶液中TCS含量的增加,缝合线纺织纤维的表面逐渐变的更为粗糙,表面覆盖膜层及颗粒量显著增加。利用EDS计算而来的Cl元素原子百分含量结果显示,随着浸泡溶液中TCS含量的增加,表面Cl元素含量从1.0%逐渐增加到1.2%、1.6%和1.7%。这与SEM 的观察结果完全一致。这显示,缝合线表面的TCS含量可以通过浸泡溶液中的TCS含量进行调控。

图4 TCS浓度对PDA-TCS涂层表面形貌的影响照片(a)3g/L;(b)4g/L;(c)5g/L;(d)6g/LFig.4 Effect of TCS concentration on surface morphology of the coated suture (a)3g/L;(b)4g/L;(c)5g/L;(d)6g/L
3.2 PDA-TCS涂层的稳定性及TCS的释放行为
为了进一步研究缝合线表面的TCS在体液中的稳定性和释放特性,采用模拟体液浸泡的方案,将具有PDA-TCS涂层的缝线放入PBS缓冲液中,并保持在37℃烘箱中,分别研究在浸泡4h、8h、1d和2d后的表面氯含量,并观察其表面形貌的变化。
根据图1的标准曲线,可以获得缝合线表面经不同浸泡时间TCS释放量。对检测模拟生理条件下(PBS,p H=7.4)涂层的体外累计释放特性分析如图5所示。从图可见,TCS的释放与涂层负载的TCS含量相关,相对TCS含量较高的涂层在浸泡初期即释放出负载量近60%以上的TCS。而TCS含量相对较低的涂层仅释放出约40%。但随着浸泡时间的延长,涂层所释放出的TCS相对量趋于一致。究其原因,可能是第一阶段为接近PDA涂层表层的TCS的释放,然后随着时间的延长,由于键合作用吸附在PDA 上面的TCS,随着PDA的逐渐降解随之释放,而这个过程进行得较为缓慢。这种释放行为显示,部分与PDA 结合的TCS可以较为稳定地存在于涂层之中,而涂层降解较为缓慢,这对于缝合线具有长效地有抗菌作用是十分有益的。

图5 医用缝线表面TCS的释放Fig.5 Release of TCS from suture surface
如图6的扫描电镜表面形貌分析所示,在包覆完毕后,缝线表面的PDA 涂层厚且覆盖广,可以观察到缝线纤维本身的结构几乎都被遮盖。在释放4h后,表面的涂层有部分减少,但仍覆盖了缝线的绝大部分面积,且纤维与纤维之间可以明显观察到涂层在缝隙处减少。在释放1d后,这种情况尤为明显,已露出了缝合线原有的纤维之间的空隙,这显示涂层的部分溶解及TCS的释放。而当浸泡2d后,这种情况变得更为明显。这显示涂层在与模拟体液接触的条件下逐渐部分溶解,部分TCS可以释放到溶液中。表面形貌变化与涂层表面及浸泡液中的TCS含量的变化趋势相当一致。

图6 TCS释放不同时间后表面形貌化照片(a)4h;(b)8h;(c)1d;(d)2dFig.6 Morphology after different time of TCS release(a)4h;(b)8h;(c)1d;(d)2d
3.3 PDA-TCS涂层的抗菌性能
不同含量TCS 的涂层的抗菌效应如图7 所示。棉拭子将金黄色葡萄球菌落均匀涂抹整个琼脂培养基,并放置一段具有PDA-TCS涂层的缝合线后,一开始菌落均匀地充满整个培养基,但随着培养时间的延长,3d后缝合线周围的菌落消失。这表明制备得到的涂层具有一定的抗菌效果。而且,从图可见,随着TCS负载量的提高,缝线周围抑菌区域的面积有所增大,这表明抗菌性能的提高。涂层对不同种类的细菌均具有杀灭效果。
结合涂层稳定性和TCS释放实验结果,这一结果显示初期能够稳定存在于缝合线表面的涂层及其所含的TCS有效地杀灭了细菌,抑制菌落的形成,从而起到抑制细菌感染的作用。也就是说,制备所得的PDA-TCS涂层的抗菌性能具有一定长效性。这对医用缝合线所经常面临的术后初期的细菌感染是非常有益的。而且,其对医用缝合线表面特性未做过多改变,特别适用于需要较快降解的医用缝合线。

图7 具有不同含量TCS的涂层的抗菌效应(a1)~(d1):金黄葡萄球菌;(a2)~(d2):大肠杆菌;(a1)~(a2):3g/L;(b1)~(b2):4g/L;(c1)~(c2):5g/L;(d1)~(d2):6g/LFig.7 Anti-bacterial effects of PDA/TCS coatings(a1)~(d1):S.A.;(a2)~(d2):E.coli;(a1)~(a2):3g/L;(b1)~(b2):4g/L;(c1)~(c2):5g/L;(d1)~(d2):6g/L
4 结 论
本研究基于采用PDA 作为TCS的载药涂层来覆盖在医用缝合线上,并对其进行SEM、XPS、体外释放和抗菌实验等一系列测试,研究结果如下:
1.通过多巴胺的自聚合反应可在医用缝合线表面有效固载TCS形成PDA-TCS复合薄膜。
2.涂层中TCS的含量可以通过TCS 浓度调节,但随着TCS浓度的增加其含量逐渐饱和。
3.涂层对大肠杆菌和金黄葡萄球菌具有杀灭性能,且浸泡2d后,仍有约25%的TCS 剩余。这显示涂层能够满足缝合线初期抗菌的需要。

