长链非编码 RNA肌动蛋白纤维相关蛋白1-反义RNA1对人绒毛膜癌细胞增殖、迁移和凋亡的影响
高玉霞,董学彩,王文翔,盛修贵
(1.新乡市中心医院妇瘤一科,河南 新乡 453000;2.山东省肿瘤医院妇瘤科,山东 济南 250000)
绒毛膜癌是女性常见的恶性肿瘤之一,多继发于葡萄胎、流产或足月分娩以后,少数发生于异位妊娠后,偶发于未婚妇女的卵巢(原发性绒毛膜癌)[1]。寻求绒毛膜癌的新型分子治疗靶点一直是研究的热点。长链非编码RNA(long noncoding RNA,LncRNA)被认为可以调节癌细胞的生长、凋亡和转移。有研究证明,肌动蛋白纤维相关蛋白1-反义RNA1(actin filament-associated protein 1-antisense RNA1,AFAP1-AS1)与乳腺癌、食管癌、肝癌等密切相关[2-4]。目前,尚未见关于LncRNA AFAP1-AS1在绒毛膜癌发病机制中作用的相关研究。基于此,本研究通过构建LncRNA AFAP1-AS1过表达载体,探讨LncRNA AFAP1-AS1对人绒毛膜癌细胞增殖、迁移和凋亡的影响。
1 材料与方法
1.1实验细胞人绒毛膜癌细胞JEG-3购自中国科学院上海细胞研究院。
1.2主要试剂与仪器RPMI 1640培养基、胰蛋白酶、磷酸盐缓冲液(phosphate buffered solution,PBS)、胎牛血清均购自美国Gibco公司,TRIzol RNAiso、反转录试剂盒、Lipofectamine 2000转染试剂购自上海赛默飞世尔科技(中国)有限公司,Transwell小室、细胞计数试剂盒-8(cell counting kit-8,CCK-8)、Western blot检测试剂盒购自苏州宇恒生物科技有限公司,山羊抗人Caspase-3、Caspase-9蛋白一抗以及山羊抗人Caspase-3、Caspase-9蛋白二抗购自美国Novus Biologicals公司;酶标仪购自北京普天新桥技术有限公司,流式细胞仪购自广州艺得诺生物科技有限公司,倒置显微镜购自上海玉研科学仪器有限公司,实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪购自深圳瑞安康医疗器械有限公司,凝胶电泳分析系统购自英国CLEAVER公司。
1.3实验方法
1.3.1人绒毛膜癌细胞JEG-3的复苏及培养将冷冻保存的JEG-3细胞在37 ℃水中融化,复苏后将细胞株接种于RPMI 1640培养基,加入体积分数10%的胎牛血清,在37 ℃、含体积分数5%CO2的培养箱中传代培养,培养期间常规换液。
1.3.2构建LncRNAAFAP1-AS1过表达载体在美国国立生物技术信息中心数据库中检索LncRNA AFAP1-AS1的序列,由上海吉凯基因化学技术有限公司构建LncRNA AFAP1-AS1过表达载体,并进行基因测序,实验室人员进行验证。
1.3.3实验分组与干预措施取对数生长期细胞,胰蛋白酶消化后,以均匀密度接种于6孔板中进行培养,将细胞分为空白对照组、空白载体组和LncRNA AFAP1-AS1过表达组。空白对照组细胞未做任何处理,空白载体组细胞转染空白载体,LncRNA AFAP1-AS1过表达组细胞转染LncRNA AFAP1-AS1过表达载体。
1.3.4实时荧光定量PCR检测JEG-3细胞中Caspase-3和Caspase-9mRNA表达取各组转染后培养48 h的细胞,胰蛋白酶消化,应用放射免疫沉淀裂解液进行细胞裂解,采用TRIzol法提取细胞中总RNA,并检测RNA纯度。取20 μg总RNA,反转录为cDNA,反转录操作步骤参照TaKaRa反转录试剂盒说明书。Caspase-3上游引物序列为5′-CAAGAGGTCCTGTCTTCAGATGA-3′,下游引物序列为5′-TCTGTTTCCGTTTCCTGGTTC-3′;Caspase-9上游引物序列为5′-GTGATAAAGGTTTCGGTTGCTG-3′,下游引物序列为5′-TGTTTTCTGTGGCTCCTCCTC-TGG-3′。PCR反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循环40次;每个样本重复3次。采用2-△△CT法计算Caspase-3和Caspase-9 mRNA相对表达量。
1.3.5Westernblot法检测JEG-3细胞中Caspase-3和Caspase-9蛋白表达取各组转染后培养 48 h 的细胞,经胰蛋白酶消化后接种于96孔板,调整细胞密度为每孔1×108个,加入1 mL放射免疫沉淀细胞裂解液,各组细胞在冰上裂解30 min,收集1.5 mL裂解后细胞溶液于离心管中,在预冷 4 ℃ 的离心机中 5 000 r·min-1离心5 min,取上清液,95 ℃煮沸后应用二喹啉甲酸法检测总蛋白浓度。取40 μg总蛋白,将其在120 g·L-1十二烷基硫酸钠-聚丙烯酰胺凝胶中电泳分离,采用电转移法转移至聚偏氟乙烯膜,室温条件下 50 g·L-1脱脂奶粉封闭2 h,加入一抗山羊抗人Caspase-3、Caspase-9蛋白抗体(110 000),4 ℃ 孵育过夜;磷酸盐吐温缓冲液(phosphate buffered saline tween,PBST)稀释液洗涤3次;加入山羊抗人Caspase-3和Caspase-9蛋白二抗(11 000)孵育2 h,PBST稀释液洗涤3次;二氨基联苯胺显影液处理样本。采用Image J软件分析蛋白条带。
1.3.6CCK-8实验检测细胞增殖能力空白对照组、空白载体组及LncRNA AFAP1-AS1过表达组转染后细胞经胰蛋白酶消化后,按照CCK-8试剂盒说明书进行操作,将3组转染后的细胞以5×107L-1密度接种于96孔板,72 h后每孔加入10 μL CCK-8试剂,37 ℃下孵育箱中避光孵育24 h。用酶标仪在450 nm波长处测定吸光度值,每组设3个复孔。
1.3.7Transwell小室检测细胞迁移能力收集3组转染后培养48 h细胞,胰蛋白酶消化后,PBS重悬细胞,将细胞密度调整为2.5×109L-1待用。按照试剂盒说明书中的操作步骤检测细胞迁移能力。将基底膜的基质原液储存于4 ℃冰箱,隔夜融化,然后将经过预冷的无血清RPMI-1640与其按31的比例调配上室凝胶液体,在Transwell小室的上室中每孔用55 μL凝胶液体进行包被,置于37 ℃恒温孵育箱中孵育2 h,等待上室成胶。然后在上室内接种200 μL细胞悬液,在下室中加入500 μL RPMI-1640培养液(含体积分数10%胎牛血清)。取Transwell板置于37 ℃恒温孵育箱内孵育培养24 h,以结晶紫染色剂进行染色,应用倒置光学显微镜观察并拍照,对细胞进行计数,重复3次,取均值。
1.3.8流式细胞术检测JEG-3细胞凋亡情况取3组转染后培养48 h的细胞,胰蛋白酶消化后接种于96孔板,每孔1×108个细胞;取1 mL细胞悬液,转移至离心管内,4 ℃ 1 000 r·min-1离心10 min,取沉淀物,PBS冲洗3次,加入结合缓冲液200 μL,并加入Annexin V和PI各5 μL,避光条件下充分反应15 min,加入结合缓冲液400 μL,流式细胞术检测60 min内细胞凋亡情况。
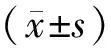
2 结果
2.13组JEG-3细胞中Caspase-3、Caspase-9mRNA和蛋白的相对表达量比较结果见表1和图1。LncRNA AFAP1-AS1过表达组JEG-3细胞中Caspase-3、Caspase-9 mRNA和蛋白相对表达量均高于空白对照组和空白载体组,差异有统计学意义(P<0.05);空白对照组和空白载体组JEG-3细胞中Caspase-3、Caspase-9 mRNA及蛋白相对表达量比较差异无统计学意义(P>0.05)。
表13组JEG-3细胞中Caspase-3、Caspase-9mRNA及蛋白相对表达量比较


组别Caspase-3 mRNACaspase-9 mRNACaspase-3蛋白Caspase-9 蛋白空白对照组0.129±0.0040.464±0.0080.165±0.0220.235±0.021空白载体组0.131±0.0020.512±0.0070.171±0.0270.241±0.024LncRNA AFAP1-AS1过表达组1.121±0.209a1.171±0.139a1.273±0.231a1.413±0.091a
注:与空白对照组和空白载体组比较aP<0.05。
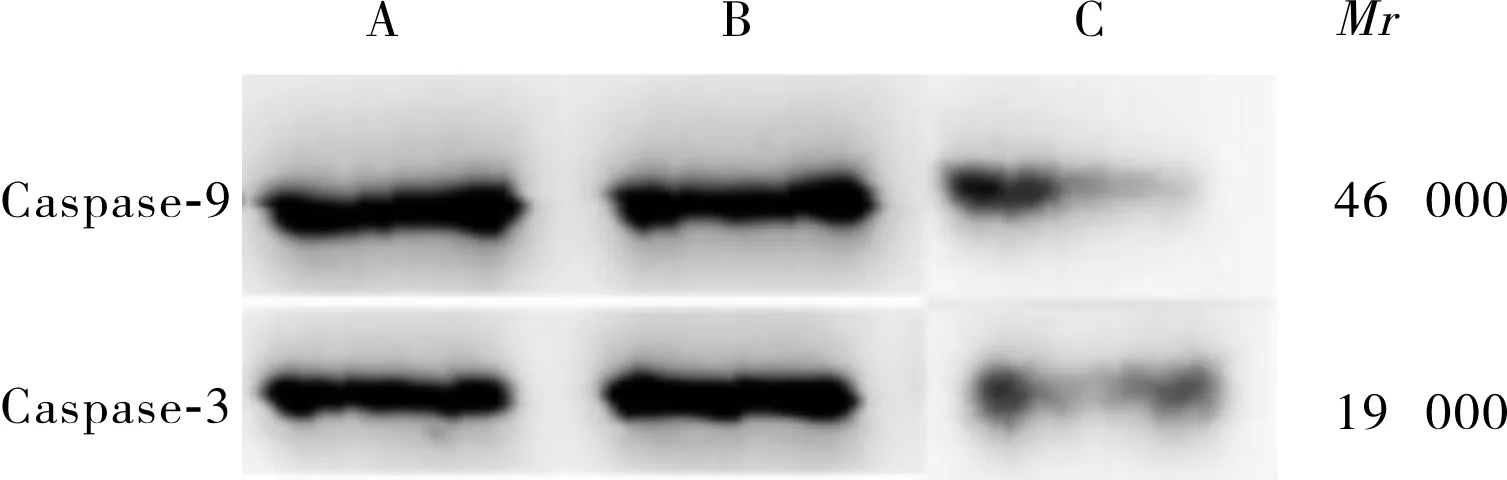
A:空白对照组;B:空白载体组;C:LncRNA AFAP1-ASI过表达组。
图13组JEG-3细胞中Caspase-3和Caspase-9蛋白表达(Westernblot)
Fig.1ExpressionofCaspase-3,Caspase-9proteininJEG-3cellsinthethreegroups(Westernblot)
2.23组JEG-3细胞增殖能力比较空白对照组、空白载体组及LncRNA AFAP1-AS1过表达组JEG-3细胞吸光度值分别为0.45±0.04,0.40±0.05,0.28±0.02。LncRNA AFAP1-AS1过表达组JEG-3细胞的增殖能力(吸光度值)低于空白对照组和空白载体组,差异有统计学意义(P<0.05);空白对照组与空白载体组JEG-3细胞增殖能力(吸光度值)比较差异无统计学意义(P>0.05)。
2.33组JEG-3细胞迁移能力比较结果见图2。空白对照组、空白载体组及LncRNA AFAP1-AS1过表达组中透过分子筛的细胞数分别为(142.11±18.39)、(131.32±14.02)、(52.11±4.09)个。LncRNA AFAP1-AS1过表达组透过分子筛的细胞数显著低于空白载体组和空白对照组,差异均有统计学意义(P<0.05);空白对照组和空白载体组透过分子筛的细胞数比较差异无统计学意义(P>0.05)。
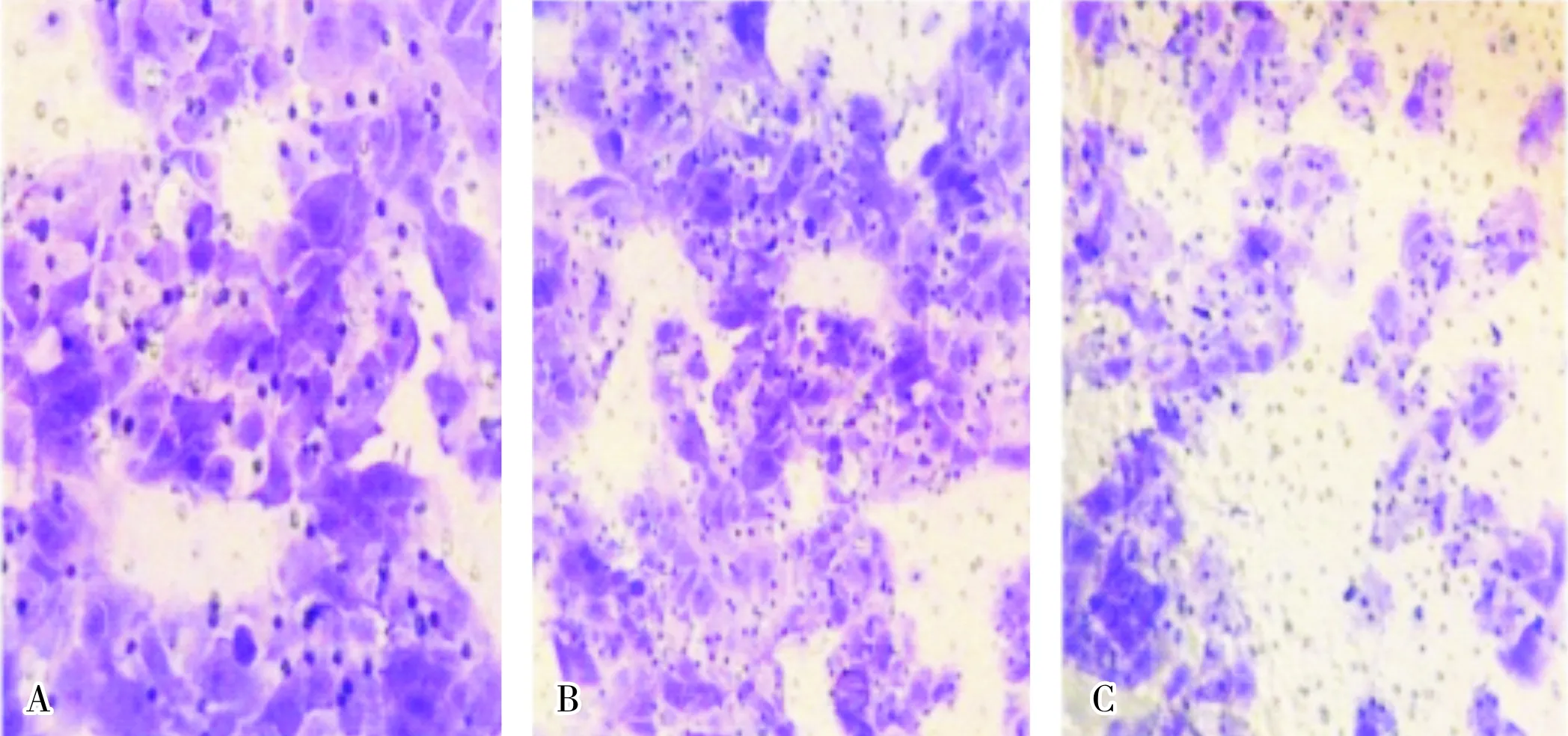
A:空白对照组;B:空白载体组;C: LncRNA AFAP1-AS1过表达组。
图23组JEG-3细胞迁移能力(结晶紫染色,×400)
Fig.2MigrationofJEG-3cellsinthethreegroups(crystalvioletdyeing,×400)
2.43组细胞凋亡率比较结果见图3。空白对照组、空白载体组及LncRNA AFAP1-AS1过表达组细胞凋亡率分别为(4.21±1.24)%、(3.09±1.13)%、(35.21±13.31)%。LncRNA AFAP1-AS1过表达载体组细胞凋亡率显著高于空白对照组和空白载体组,差异有统计学意义(P<0.05);空白对照组与空白载体组细胞凋亡率比较差异无统计学意义(P>0.05)。

A:空白对照组;B:空白载体组;C:LncRNA AFAP1-AS1过表达组。
图3流式细胞术检测各组细胞凋亡情况
Fig3Apoptosisofthecellsinthethreegroupsdetectedbyflowcytometry
3 讨论
LncRNA本身不具有编码蛋白及转录功能,其长度不超过200个片段。LncRNA已经被证实在相关肿瘤细胞的增殖、侵袭和凋亡过程中起十分重要的作用。既往研究表明,LncRNA是肺癌、前列腺癌、结肠癌及肝癌等发生、发展中的重要转录因子,并且与肿瘤瘤体的体积大小及患者的临床分期密切相关[5-6]。本研究主要探讨LncRNA AFAP1-AS1对人绒毛膜癌细胞的增殖、侵袭及凋亡的影响,为临床治疗提供新的目标靶点。
Caspase-3是一种蛋白酶,1994年FERNANDES-ALNEMRI等[7]在表达序列标记数据库中找到一段与半胱氨酸蛋白酶抑制剂活性中心同源的序列,用它合成探针后筛选人Jurkat T淋巴细胞基因文库,从中克隆出一种新基因,因其编码相对分子质量为 32 000 的半胱氨酸蛋白酶而称之为CPP32,随后这种蛋白酶被命名为Caspase-3[8]。Caspase是近年来发现的一组存在于细胞质基质中的半胱氨酸蛋白酶,它们的一个重要共同点是活性位点都含有半胱氨酸,可特异地断开天冬氨酸残基后的肽键[9-10]。本研究通过实时荧光定量PCR检测了人绒毛膜癌细胞中凋亡基因Caspase-3、Caspase-9 mRNA表达,结果发现,LncRNA AFAP1-AS1过表达组JEG-3细胞中Caspase-3、Caspase-9 mRNA表达均明显高于空白对照组和空白载体组,提示LncRNA AFAP1-AS1对人绒毛膜癌细胞的凋亡具有促进作用。另外,LncRNA AFAP1-AS1过表达组JEG-3细胞中Caspase-3、Caspase-9蛋白表达水平显著高于空白对照组和空白载体组,提示LncRNA AFAP1-AS1可以调控人绒毛膜癌细胞中凋亡因子蛋白表达水平,进而影响细胞凋亡。
本研究中,作者利用CCK-8实验检测JEG-3细胞的增殖能力结果发现,LncRNA AFAP1-AS1过表达组细胞的增殖能力低于空白对照组和空白载体组,说明LncRNA AFAP1-AS1对人绒毛膜癌细胞的增殖具有明显的抑制作用。而GUO等[11]研究结果发现,敲除胃癌细胞中的AFAP1-AS1相关基因,可以有效提高抑癌基因PTEN mRNA及蛋白的表达水平,从而抑制胃癌细胞增殖,该研究也说明了AFAP1-AS1的表达可以通过多种信号通路抑制胃癌细胞的增殖。本研究还发现,AFAP1-AS1过表达可以抑制JEG-3细胞的迁移能力。而ZHOU等[12]研究显示,AFAP1-AS1高表达可促进食管癌细胞的迁移,与本研究结果不一致。
本研究中流式细胞术实验结果发现,LncRNA AFAP1-AS1过表达组细胞凋亡率显著高于空白对照组和空白载体组,说明LncRNA AFAP1-AS1对人绒毛膜癌细胞的过度凋亡具有明显促进作用。而LUO等[13]研究显示,AFAP1-AS1表达上调可以减少肿瘤细胞凋亡,与本研究结果不一致。谢兵[14]研究发现,AFAP1-AS1表达可以抑制乳腺癌细胞增殖,同时降低肿瘤淋巴结转移概率,与本研究结果一致。
本研究证实了LncRNA AFAP1-AS1过表达可以抑制人绒毛膜癌细胞的增殖和迁移,促进细胞凋亡。但本研究只是初步研究了LncRNA AFAP1-AS1在人绒毛膜癌细胞增殖、迁移和凋亡中的作用,但其具体分子生物学机制尚未完全明了,需要进一步研究探讨。

